紫杉醇-顺铂方案经导管动脉灌注化疗治疗不可切除非小细胞肺癌的临床应用
2020-06-30黄坤林刘玉金
黄坤林,刘玉金
非小细胞肺癌(NSCLC)是最常见的恶性肿瘤之一[1],其发病率和死亡率高居首位[2-3]。 静脉化疗和放疗在NSCLC 的治疗中有着广泛的应用。然而,由于年龄的增长或患者体力状态(performance status,PS)不佳,许多患者无法耐受这些治疗。 近年来,经动脉灌注化疗(TAI)因其重复性好、不良反应少而被应用于 NSCLC 的治疗[4-7]。 然而,TAI 对 NSCLC 的疗效尚未得到公认。 本研究旨在评价TAI 治疗不可切除NSCLC 的疗效,并分析影响生存预后的因素。
1 材料与方法
1.1 材料
1.1.1 病例资料 本研究选取2014年1月至2018年12月我院收治的不可切除NSCLC 患者64 例,其中男 48 例,女 16 例,年龄 49~89 岁,平均(68.4±9.0)岁。本研究得到了医院伦理委员会的审查批准,所有患者均被告知TAI 治疗的详细信息,并签署书面知情同意书。
1.1.2 入组标准 ①细胞病理学确诊的NSCLC 患者;②影像学评估不可切除或拒绝手术、静脉化疗、放疗、局部消融、粒子植入等治疗者;③基因检测EGFR、AIK 突变阴性或者不能耐受分子靶向治疗者;④接受TAI(TP 方案)治疗;⑤未接受其他特殊治疗者。
1.1.3 排除标准 ①有心、肝、肾等严重疾病及其功能严重障碍者,严重精神病不能配合患者;②凝血功能障碍、活动性感染、活动性出血不能纠正者;③骨髓抑制严重及其他化疗相关禁忌者。 ④无肺外转移。
1.2 方法
1.2.1 TAI 治疗 一般选择股动脉穿刺入路,2 例经桡动脉入路。 常规消毒、铺巾,以2%利多卡因局麻后,以Seldinger 方法穿刺股动脉或桡动脉,在DSA透视下将 MIK 或 Cobra 导管(COOK 公司)分别插管至双侧支气管动脉、肋间动脉、膈下动脉和胸廓内动脉,造影证实确定为肿瘤供血动脉后,缓慢注入稀释后的化疗药物(紫杉醇80 mg/m2和顺铂60 mg/m2)(图1),若有多支供血动脉,则将药物适宜分配。 并随时询问、检查患者胸部及双下肢感觉及肌力。 IAI 后,将 2.6~2.8 F 微导管(ASAKI、Terumo)避开脊髓动脉、肋间动脉等超选择插管至肿瘤供血动脉后,透视下缓慢地漂注混合对比剂的明胶海绵栓塞颗粒(150~350 μm,杭州爱立康公司)栓塞肿瘤供血动脉(图2)。
TAI 每3~6 周重复1 次,直到肿瘤进展或因体力状态等原因无法继续。所有患者在每次TAI 前后进行止咳、化痰等对症治疗。 每例患者在TAI 前1 周内进行血常规和肝肾功能及胸部CT 检查及后续随访。
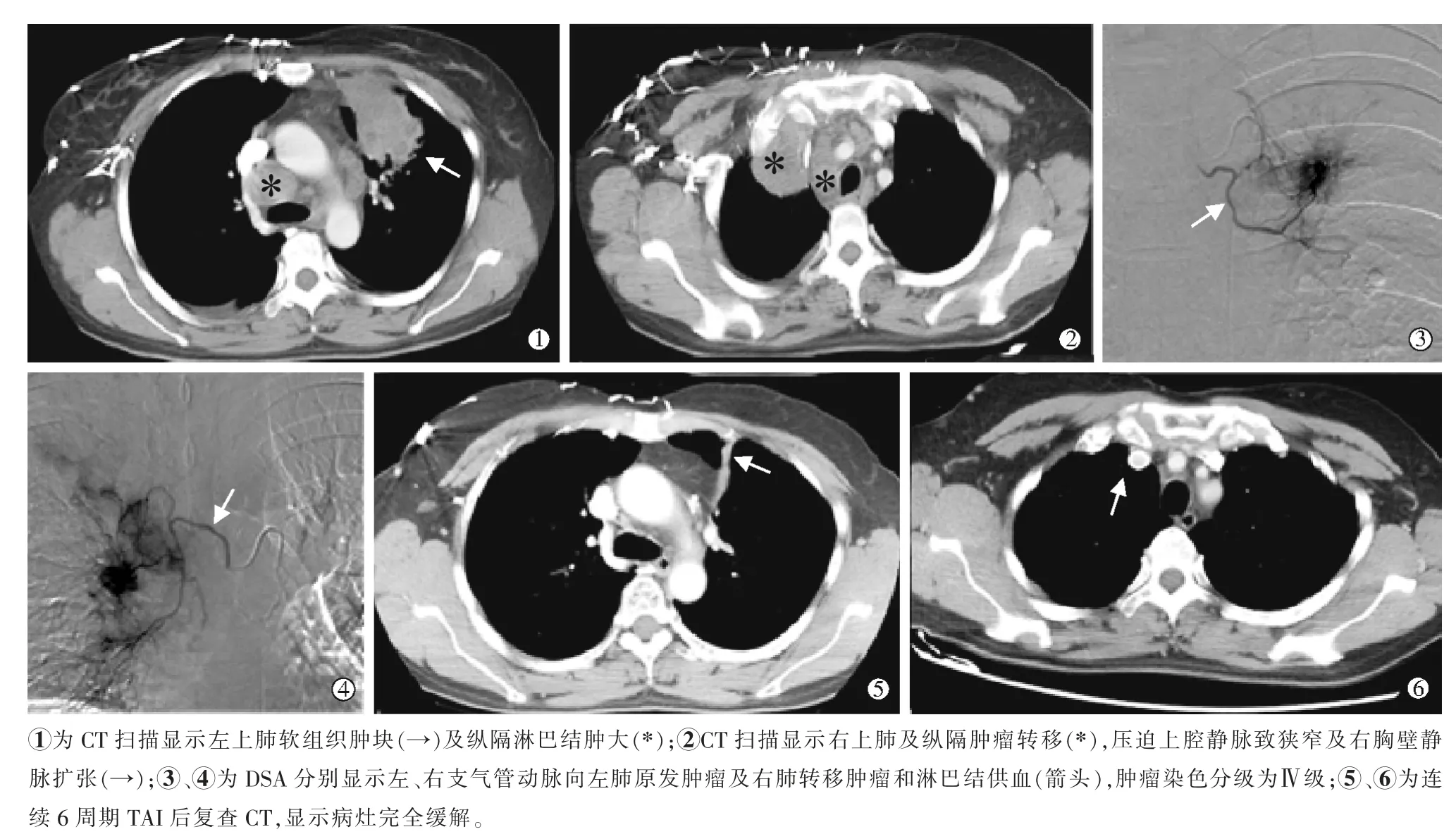
图1 女性,49 岁,不可切除肺腺癌治疗过程
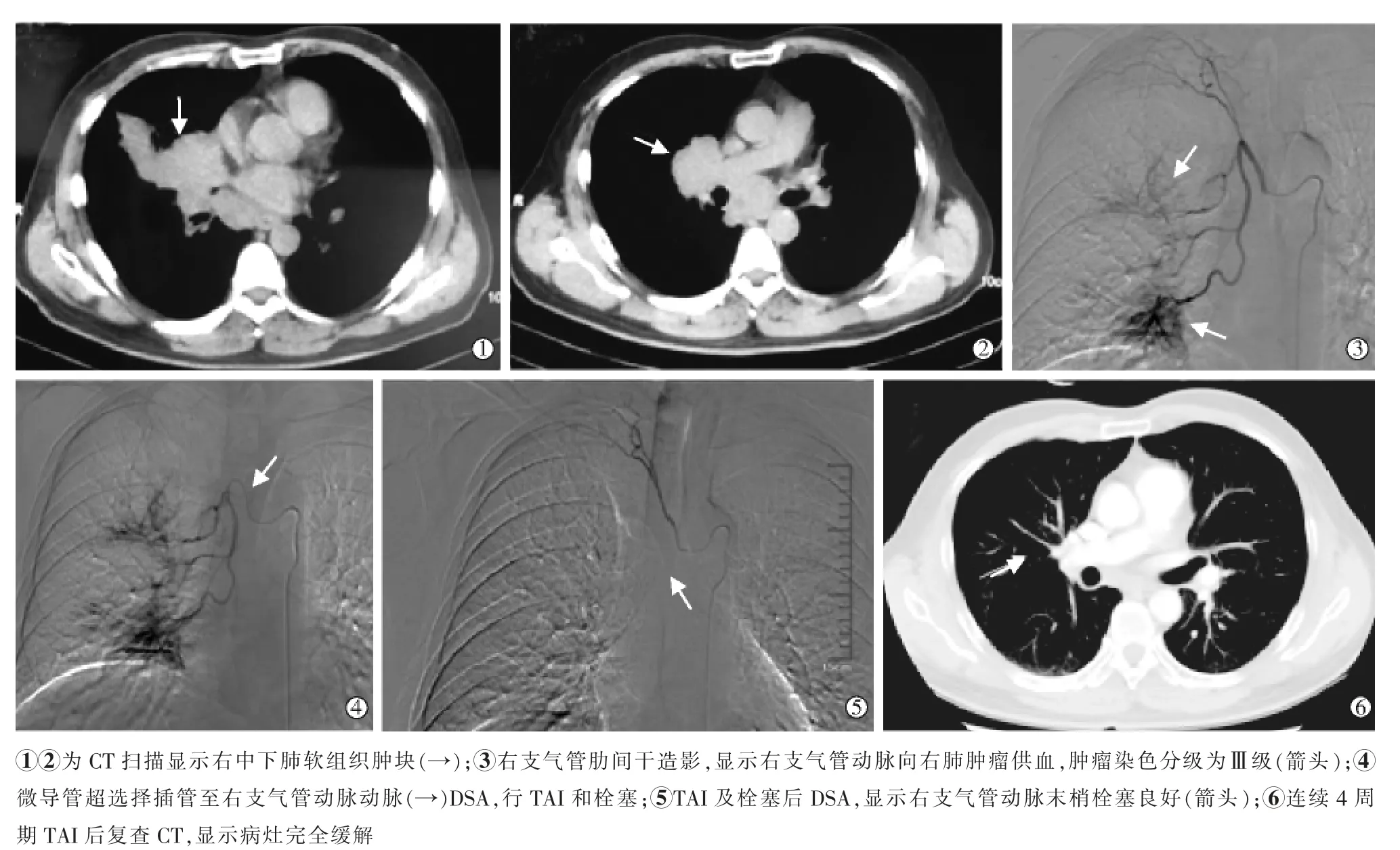
图2 男性,50 岁,右中、下肺不可切除肺鳞癌治疗过程
1.2.2 评价标准 对每例患者进行肿瘤染色分级。 肿瘤染色按Ⅰ到Ⅳ级表示肿瘤染色程度分别为0~25%、26%~50%、51%~75%和>75%[8]。用 RECIST1.1 评价肿瘤的治疗反应[9]。 疾病客观缓解定义为CR+PR,疾病控制定义为CR+PR+SD。使用3.0 版《不良反应通用术语标准》评估治疗不良反应[10]。 肿瘤进展时间(tumor progression time ,TTP)定义为从第 1 次 TAI治疗到首次检查显示肿瘤进展(PD)的时间长度。那些从未稳定过的患者被定义为有0 个月的TTP。 生存期(overall survival,OS)的定义是从第 1 次 TAI 到患者死亡的时间。 在每个TAI 周期后1 个月进行胸部CT 检查,在最后一个TAI 周期后2~3 个月进行胸部CT 检查,以确定治疗反应和TTP。每3~6 个月行脑部MRI 和腹部CT、 骨扫描或PET-CT 检查评估。随访结束于患者死亡时或本研究结束时。
1.3 统计学方法
所有统计计算均使用SPSS 21.0 软件进行。 计量资料用表示。 用 Kaplan-Meier 曲线计算 OS和TTP。应用单因素和多因素Cox 回归分析确定OS和TTP 的影响因素。 多因素分析中的协变量是单因素分析中有统计学意义(P<0.05)的因素。 P<0.05被认为差异具有统计学意义。
2 结果
2.1 患者的基线数据
64 例患者共进行 172 个TAI 周期(平均每例2.7 个周期)。 29 例患者接受至少3 个周期的 TAI(16 例接受 3 个周期,2 例接受 4 个周期,3 例接受5 个周期,8 例接受 6 个周期)。 35 例患者进行 1 个周期(n=23)或 2 个周期(n=12)TAI 治疗。 64 例患者中有102 支支气管动脉和42 支非支气管动脉确定为肿瘤供血动脉。39 例患者仅以支气管动脉作为肿瘤供血动脉。 25 例除支气管动脉供血外,15 例合并胸廓内动脉供血,5 例合并2~3 支肋间动脉、3 例合并膈动脉和2 例合并胸外侧动脉作为肿瘤供血动脉。 肿瘤病理类型:43 例为腺癌,18 例鳞癌,3 例鳞腺癌。 低分化50 例,中分化11 例,高分化 3 例。肿瘤染色分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级,分别占 4 例(6%)、22例(34%)、32 例(50%)和 6 例(10%)。
2.2 TAI 相关并发症
TAI 相关并发症包括咳嗽(n=6)、轻度胸痛(n=3)和一过性双下肢麻木感(n=2)。 这些并发症无需特殊处理。 经支气管动脉栓塞术的患者均未发生异位栓塞。 无其他严重与操作相关的并发症。
2.3 随访
随访至研究终点,63 例死亡,1 例生存。死亡原因包括肿瘤进展(n=26)、多脏器功能衰竭(n=19)、肺部感染(n=15)和呼吸衰竭(n=3)。 完全缓解(CR)2 例,部分缓解(PR)29 例,疾病稳定(SD)22 例,客观缓解率(CR+PR)46.9%,疾病控制率(CR+PR+SD)81.3%。
全部患者平均TTP 为 6.7 个月,中位 TTP3 个月(图 3)。 平均 OS 为 9.8 个月,中位 OS 6 个月。6 个月、12 个月、24 个月累积生存率分别为54.7%、29.7%、9.4%(图 4)。
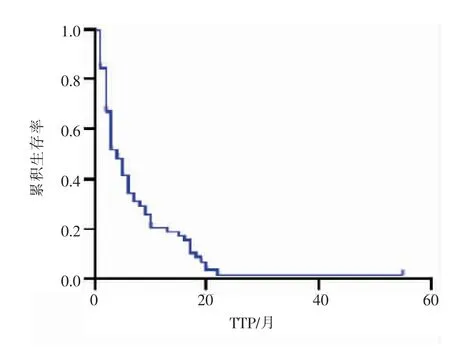
图3 经TAI 治疗的NSCLC 患者的肿瘤进展时间图
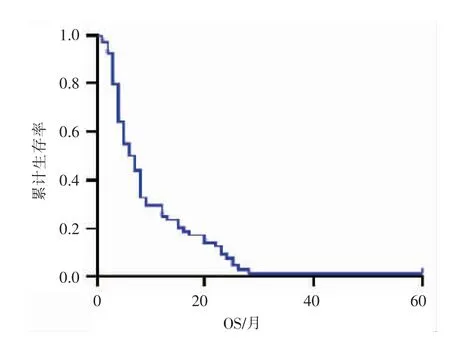
图4 经TAI 治疗的NSCLC 患者的总生存期
根据单因素分析,影响预后的因素是存在支气管动脉之外的异位体动脉供血(HR,3.026;95%CI 1.387-6.602;P=0.005)和治疗周期数≥3(HR,0.352;95%CI 0.151-0.819;P=0.015)。基于多因素分析,影响预后的独立因素也是存在支气管动脉之外的异位体动脉供血(HR,3.171;95%CI 1.574-6.387;P=0.001)和治疗周期数≥3(HR,0.278;95%CI 0.133-0.580;P=0.001)(表 1)。
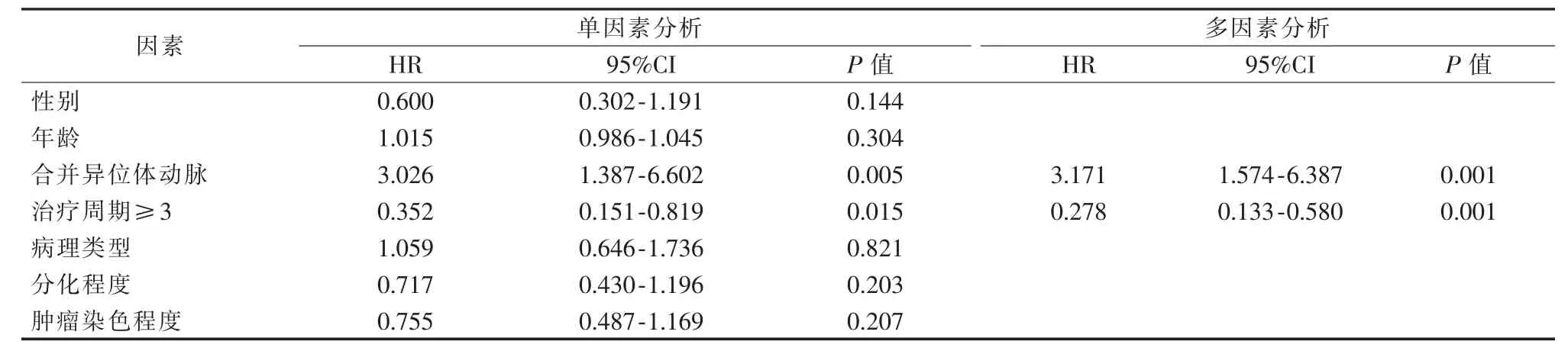
表1 NSCLC 影响预后的单因素和多因素分析
3 讨论
本研究探讨TAI 治疗不可切除NSCLC 的临床疗效及安全性。结果显示总有效率为46.9%,疾病控制率为81.3%,与先前关于TAI 治疗晚期NSCLC 的研究结果相当[4-6]。
血管生成对于肿瘤的生长至关重要,也是TAI治疗的解剖基础。 由于肺有两个独立的循环,即负责气体交换的肺循环和负责肺、支气管自身营养的支气管动脉等体循环。 早期不少学者想当然地认为肺癌是双重血供,因此需要经肺动脉和支气管动脉等体循环分别进行区域性灌注化疗。 但是,随着现代医学影像学的发展,证实肺癌的供血动脉是支气管动脉等体循环,肺动脉不参与肺癌的血供[11-12]。有研究表明虽然肺循环可以满足肿瘤发生的代谢需要,但肿瘤的进一步生长需要从高度增殖的支气管循环中生成血管[13]。 一项研究对 59 例肺癌患者的供血动脉进行多层螺旋CT 血管造影,提示79%左右的肺癌供血动脉为支气管动脉,5%为肋间动脉,7%为胸廓内动脉,9%为膈动脉[14]。所以目前越来越多的学者接受肺癌的供血动脉主要是支气管动脉、肋间动脉、胸廓内动脉、膈动脉等体循环动脉的观点。
TAI 病变区局部化疗药物的药效可达到静脉化疗的 2~6 倍[15]。 因此,TAI 可以通过使用相对少量的化学药物来达到肿瘤区域较高的有效浓度[15],从而降低全身药物不良反应。 这也是TAI 能以较低的毒性达到良好疗效的原因。 另外,在保证安全的前提下给予适当栓塞阻断肿瘤血供也是获益的重要保障。
通过单因素和多因素分析,发现除支气管动脉外,更多的肿瘤供血动脉是TTP 和OS 的影响因素。肿瘤细胞可以产生血管生成因子,如血管内皮生长因子,以诱导新血管的形成,肿瘤通过血管生成获得营养[16]。 肺癌供血动脉除支气管动脉外,更多的肿瘤供血动脉,还可能提示肿瘤具有较强的血管生成和进展能力。 因此本研究认为TTP 和OS 可能与除支气管动脉外的异位供血动脉有关,TAI 就要尽可能顾及肿瘤所有供血动脉。
综上,本研究表明TAI 对晚期不可切除NSCLC的生存质量及生存期是明显获益的,也是安全可靠的,值得临床推广应用。 因回顾性研究有其局限性,需要进一步的扩大样本及随机对照研究。
