大脑前动脉A1 段发育不全与脑出血关系研究
2020-06-30李永东王建波
何 钰,李永东,陈 力,张 琪,王建波
大脑前动脉A1 段发育不全指一侧A1 段明显增粗,对侧 A1 段未显影或直径小于优势侧 1/2[1],是大脑Willis 环中最常见的解剖变异,发生率为10%~35%[2]。 A1 段发育不全可能改变 Willis 环血流状态,并与缺血性脑卒中发生与预后[3]、前交通动脉瘤发生与进展[4-5]相关。 脑出血指原发性、自发性、非创伤性脑实质出血,是脑卒中第二大原因,占全球脑卒中发病率10%~15%[6]。 脑出血发病率(1/万~3/万)和死亡率(30%~50%)很高,并随年龄增长而增加[7],大多数幸存患者往往残存严重神经功能损伤。 因此,确定可改变的危险因素非常重要。 脑出血常见危险因素包括年龄、性别、高血压、糖尿病、吸烟、饮酒,与血脂水平异常存在复杂相关性[8-9],脑血管畸形、颅内动脉瘤、脑动脉淀粉样变性等血管性因素也占一部分。 目前尚未见根据影像学资料探索A1 段发育不全与脑出血间可能存在关系的研究。 本研究回顾性探索A1 段发育不全与脑出血间可能存在的关系,为脑出血临床防治提供更好的预防策略,从而进一步预测脑出血风险。
1 材料与方法
1.1 研究对象
连续性收集上海市第六人民医院2017年1月至2019年7月期间所有诊断为脑出血患者神经影像学资料。患者均经头颅CT/MRI 检查明确诊断,并经严格排除标准筛选,最后入组248 例(脑出血组),其中男 177 例,女 71 例。 另外选取同时期段有完善头颅MRA 资料的中医科住院患者作为对照组,与脑出血组男女性别1∶1 匹配。两组患者既往无脑出血史,无应用抗凝、抗血小板药物史。 排除标准:①后循环脑出血;②创伤性或医源性脑出血,硬膜下/外出血;③脑梗死后出血,即本次出血部位与既往急性脑梗死部位相近;④其他颅内疾病致脑出血,如原发性或转移性颅内肿瘤、颅内动静脉畸形、蛛网膜下腔出血;⑤影像学检查提示有明确颅内血管狭窄、颅内动脉瘤、前循环开窗畸形存在。
1.2 临床和影像学指标
从患者病历系统及医技报告中获取临床数据,如性别、年龄、高血压史、糖尿病史、吸烟史、饮酒史,从本次入院5 d 内首次实验室报告中获取总胆固醇,三酰甘油,高、低密度脂蛋白,载脂蛋白E,脂蛋白A。 由2 名影像科高年资医师盲法读片,完成双侧大脑前动脉A1 段直径测量,出现测量差异时由第3 名影像科医师重新评估,并取得一致。 血管直径在容积再现后图像上用数字标尺测量:在A1段起始、中部、末端三点处,垂直于血管方向[10]分别测量,取平均值;以较小A1 段直径比较大A1 段直径比值(D)表示,D≤0.5 认为 A1 段发育不全[4]。 大脑前动脉A1 段测量方法及判定标准见图1。
1.3 统计学处理
采用 SPSS 25.0 软件进行统计学分析。 两组间A1 段发育不全发生率差异分析用卡方检验。 单因素和多因素logistic 回归分析评估A1 段发育不全与脑出血间相关性。 所有分析中P<0.05 被认为具有统计学意义,并计算变量比值比(OR)及其95%可信区间(95%CI)。
2 结果
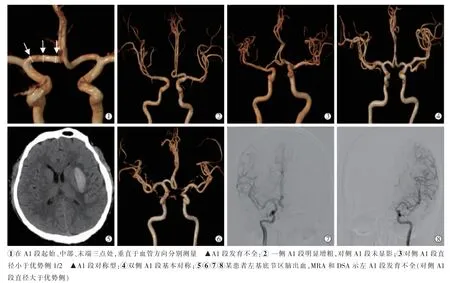
图1 大脑前动脉A1 段测量方法及判定标准
两组患者一般资料见表1。 两组患者年龄差异无统计学意义(t 检验,P=0.675)。两组共 496 例患者中78 例(15.7%)A1 段发育不全,其中脑出血组 50 例,对照组 28 例,差异有显著统计学意义(P=0.007)。 脑出血伴A1 段发育不全患者出血好发于基底节、丘脑区(38 例),部分发生于额顶叶(11 例),极少发生于颞叶(1 例),且出血侧在 A1 段优势侧(26 例)、发育不全侧(24 例)均匀分布(P>0.05)。 两组患者伴A1 段发育不全比较,差异有统计学意义(P<0.05)(表 2)。
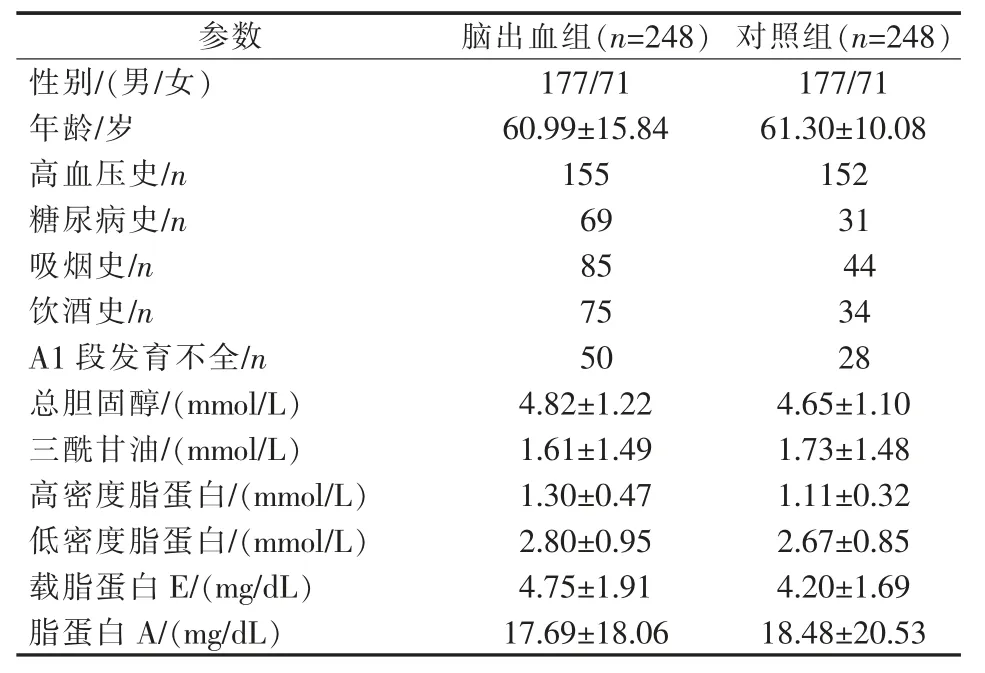
表1 两组患者一般信息
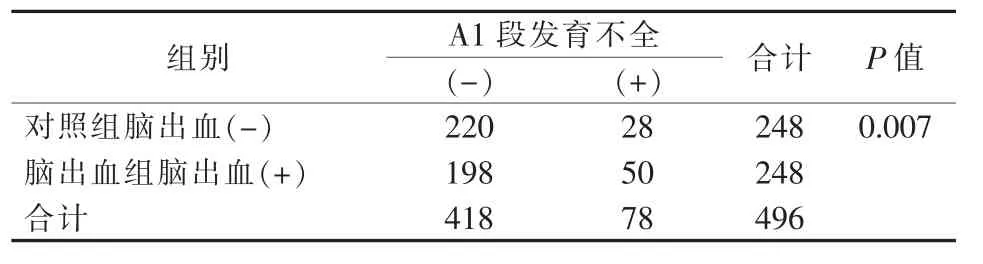
表2 两组患者大脑前动脉A1 段发育不全比较 n
单因素logistic 回归分析结果显示,A1 段发育不全、糖尿病史、吸烟史、饮酒史、高密度脂蛋白、载脂蛋白E 是与脑出血显著相关的危险因素(P<0.05)(表3);多因素logistic 回归分析结果显示,即使在多个因素互相影响下,A1 段发育不全与脑出血仍呈相关性(P=0.004,OR=2.215)(表 4)。
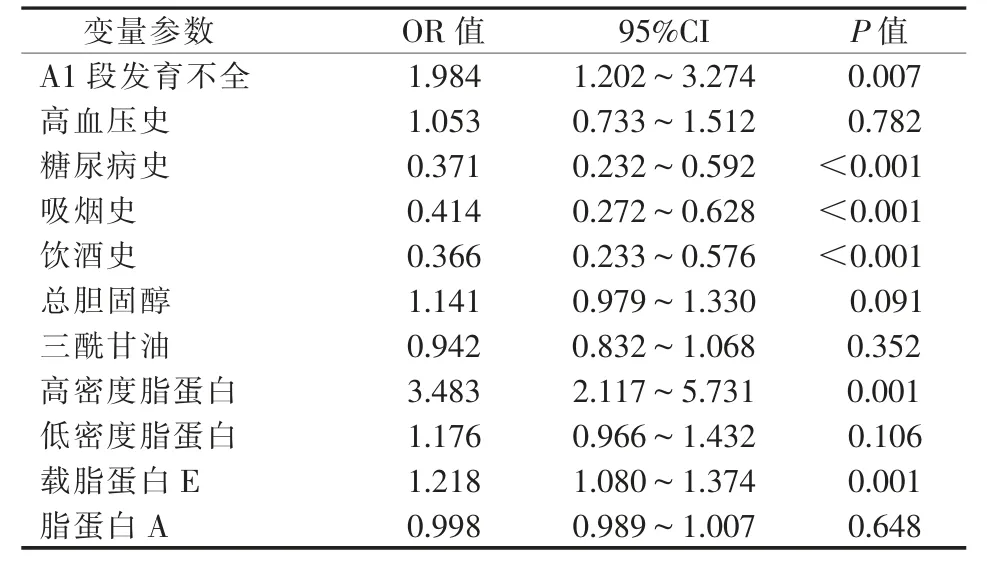
表3 两组单因素logistic 回归分析结果
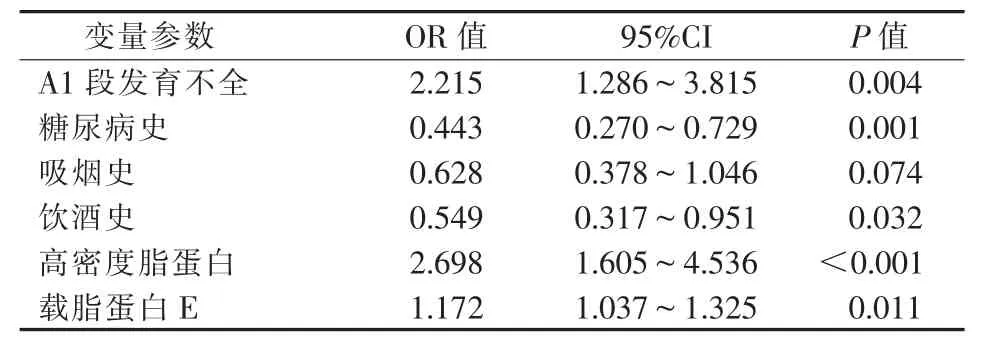
表4 两组多因素logistic 回归分析结果
3 讨论
脑出血自定义以来,发病率并未呈下降趋势,且预后不佳。 A1 段发育不全是Willis 环中常见的血管变异,越来越多研究报道了其与颅内动脉瘤发生与破裂的关系。脑出血与颅内动脉瘤破裂患者出血部位不同,但发病机制上存在部分共同性。 A1 段发育不全是否也与脑出血存在相关性?近年来CTA和MRA 检查技术越来越成熟,为本研究提供了技术支持。
脑出血作为一种进行性小血管疾病的急性表现,多数发生于颅内动脉穿透性小动脉分支处[6]。脑出血好发于基底节区,主要因为豆纹动脉为此处供血,其以近乎垂直方式由大脑中动脉发出[11],血流速度、压力梯度、方向改变较大,从而更易对血管壁造成冲击损伤,在高水平压力下更容易破裂出血。分支小动脉管径细小,抗压强度弱,在长期不对称血流冲击下,还会形成微动脉瘤,血流压力发生波动致微动脉瘤破裂出血。 本研究患者中A1 段发育不全发生率为15.7%(78/496),且右侧多于左侧,这与既往研究结果相仿[3,12]。 A1 段发育不全被认为可影响整个Willis 循环的血流动力学,有研究通过构建模型计算研究得出结论,A1 段直径差大于50%时前交通动脉血管壁受到的剪切力会显著增加[13]。这种血流动力学变化预测,同样也存在于大脑中动脉、大脑前动脉,甚至颈内动脉及其分支。 因此,A1段发育不全与脑出血关系可能是血管不对称局部流入,增加血管壁上血流动力学压力所致[14-15],进而引起动脉壁损伤或局部扩张形成微动脉瘤。
本研究期望A1 优势侧可能遭受更大的脑出血风险,然而结果并未检测到A1 段缺如与优势侧间脑出血分布的显著差异。 A1 段优势侧好发前交通动脉瘤,且与复发密切相关[4],主要是由于其血管壁和动脉瘤口承受A1 段供血血流的直接冲击作用,而脑出血通常发生于大脑中动脉分支供血的基底节区,与A1 段供血关系并不密切。 然而A1 段发育不全对血流动力学改变的影响是客观存在的,A1 缺如可能导致大脑半球侧支循环衰竭,在长期血流动力学不足情况下形成脆弱、 不成熟的侧支血管,类似烟雾病穿通动脉形成。 这些血管在血流冲击下更易形成微动脉瘤,或破裂出血。 A1 段发育不全对整个Willis 循环血流的影响是复杂的,血流动力学在A1 劣势侧可能反而呈优势改变,或形成完全相反的血流,导致湍流发生。 由于出血往往发生在血流速度、压力较大部位,一旦发生A1 段发育不全,需要检测双侧颈内动脉末端、大脑中动脉和大脑前动脉A1 段起始部位血流参数,以确定A1 段改变引起的Willis 环血流动力学变化。
本研究中平衡了自发性脑出血最重要的危险因素高血压史,还排除了继发性脑出血病因,如颅内动脉瘤、蛛网膜下腔出血、脑梗死后出血、肿瘤、血管畸形等[16],以及与前循环关系较弱的后循环脑出血;在研究相关性时除纳入目标危险因素外,还将常见的脑出血危险因素一同分析;单因素和多因素logistic 回归分析结果均表明,A1 段发育不良与脑出血密切相关。
本研究依然存在局限性,如系回顾性设计,纳入患者数量相对较少且为单中心研究,不可避免有抽样误差和选择偏倚;尽管A1 段发育不全经仔细评估,但容积再现测量法仍存误差,同时由于扫描质量、对比剂负荷、血流伪影差异,可靠评估依然困难。
本研究结论认为,大脑前动脉A1 段发育不全与脑出血关系密切,是脑出血的重要危险因素。 这一发现为脑出血病因理解提供了新方向,为制定有效的脑出血预防措施提供了更多信息。 但脑出血并不具有按优势A1 段呈特征性分布,即与出血侧和出血部位无相关性。 其潜在机制尚需通过血流动力学指标检测进一步验证。
