2016-2018年山东省部分地区猪流行性腹泻流行病学调查
2020-06-30韩英明孙秋艳范作良袁东芳
韩英明孙秋艳范作良袁东芳
调查报告
2016-2018年山东省部分地区猪流行性腹泻流行病学调查
韩英明孙秋艳 范作良 袁东芳
(山东省莱州市土山畜牧兽医站 261400) (山东畜牧兽医职业学院 山东 潍坊)
为了解山东猪流行性腹泻(PED)病流行情况,对2016-2018年山东省部分地区发病猪病的876份样品进行PED病毒(PEDV)的RT-PCR检测,共鉴定出92份PEDV阳性样品,通过从时间、区域、猪群日龄等方面进行了研究。结果显示:PEDV检出率为10.5%,其中单纯感染检出率为7.6%,混合感染检出率为2.9%;不同地区间PEDV检出率存在差异,差异率为5.71%~15.7%;每年的1~2月份是该病高发季节;该病易感猪的日龄为1~70d(检出率为18.5%~42.4%),1~28d是该病最易感日龄,大于270d猪PEDV未检出;肉用型猪群检出率为11.7%,种用型检出率为7.6%,表明肉用猪和种用猪均有可能感染PEDV。本研究通过对山东省部分地区PEDV流行病学调查,为山东省大型养猪场有效防控PED提供科学依据。
猪流行性腹泻(PED)是由冠状病毒科、冠状病毒属中的猪流行性腹泻病毒(PEDV)引起的一种高度接触性肠道传染病[1, 2]。病毒主要侵害猪的消化系统,呈现呕吐、腹泻和脱水等临床症状[3, 4]。研究发现,不同地区、不同年龄、不同品种猪都能感染发病,尤其以哺乳仔猪最为严重[5]。我国自2010年以来,PEDV感染出现大面积暴发,近些年PEDV与猪传染性胃肠炎病毒(PEDV)、猪轮状病(PRTV)混合感染的趋势日益加剧,给养猪业造成严重危害[6]。本研究采集2016-2018年山东省潍坊市、青岛、烟台市等16个地区规模化养猪场病料样品,通过一步法RT-PCR试验进行鉴定,并对检测数据进行了统计学分析,了解3年来山东省规模化养猪场不同地区、不同月份、不同日龄、不同品种的猪群PED流行规律,为山东省大型养猪场有效防控PED提供科学依据。
1 材料与方法
1.1 病料样品来源 876份病料样品来自2016年-2018年采集自山东省潍坊市、烟台市、威海市、青岛、日照市、东营市、济南市、泰安市、枣庄市、德州市、淄博市、聊城市、菏泽市、滨州市、济宁市、临沂市16个地区的规模化养猪场,以及客户送检病料样品,并对每份样品记录猪的品种、发病季节、日龄等。
1.2 主要试剂 动物疫病基因诊断试剂盒,购自山东绿都生物技术有限公司,该试剂盒是高效合成和扩增的一步法RT-PCR通用试剂盒,根据检测病毒的需要,购买该公司该病毒相应的引物即可。各病毒PCR扩增片段长度见表1。

表1 各病毒PCR扩增片段长度
1.3 病料样品处理 将采集的病死猪的小肠、结肠样品用生理盐水1:5稀释研磨,反复冻融3次,9000r/min离心30min,取上清液,-20℃保存。
1.4 RT-PCR的鉴定 按照动物疫病基因诊断试剂盒说明书操作,鉴定各病料样品中病毒。
1.5 数据处理 利用SPSS Statistics 19.0统计分析软件进行数据分析,多重比较采用LSD法进行统计学分析。
2 结果
2.1 单纯感染PEDV检出率 从山东省16个地区采集的876份病料样品中,共检出单纯感染病毒性疾病600份,其中单纯感染PEDV的病料样品67份,检出率为11.2%。其中PRRSV、PCV检出率极显著高于其它病毒性传染病(P<0.01),见表2,因此PEDV可以单独致病。
2.2 混合感染PEDV检出率 876份病料样品中,共检出混合感染病毒性疾病71份,其中混合感染PEDV的病料样品25份,检出率为28.5%。混合感染主要是PEDV+TEGV,检出率为21.1%;PEDV+PRTV和PEDV+PCV,检出率均为4.2%;PEDV+TGEV+PRTV,检出率为2.8%;PEDV +PRRSV,检出率为2.8%。PRRSV+PCV检出率极显著高于其它病毒性传染病(P<0.01),检出率为64.8%(见表3),PEDV能与其它病原混合感染。
2.3 PEDV的检出情况 876份病料样品中,PEDV的检出率为5.71%~15.7%。不同地区PEDV检出率差别较大,潍坊市PEDV检出率显著高于其他地区(P<0.05);威海市PEDV检出率显著低于其它地区(P<0.05),见表4。
2.4 不同年份PEDV的流行情况 876份病料样品检测显示,2016-2018年单纯感染PEDV阳性率从9.8%降到5.5%,不同年间PEDV阳性率差异显著(P<0.05);混合感染PEDV阳性率从4.3%降到2.3%,2016年度PEDV阳性率显著高于其他年度(P<0.05),2017年度和2018年度PEDV阳性率差异不显著(P≥0.05),见表5。表明不论是单独感染还是混可感染,PEDV呈现逐年递减的趋势。
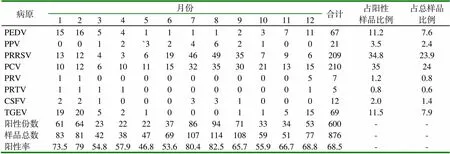
表2 2016年~2018年间山东省16个地区病毒性疾病单纯感染的检出情况 (%)
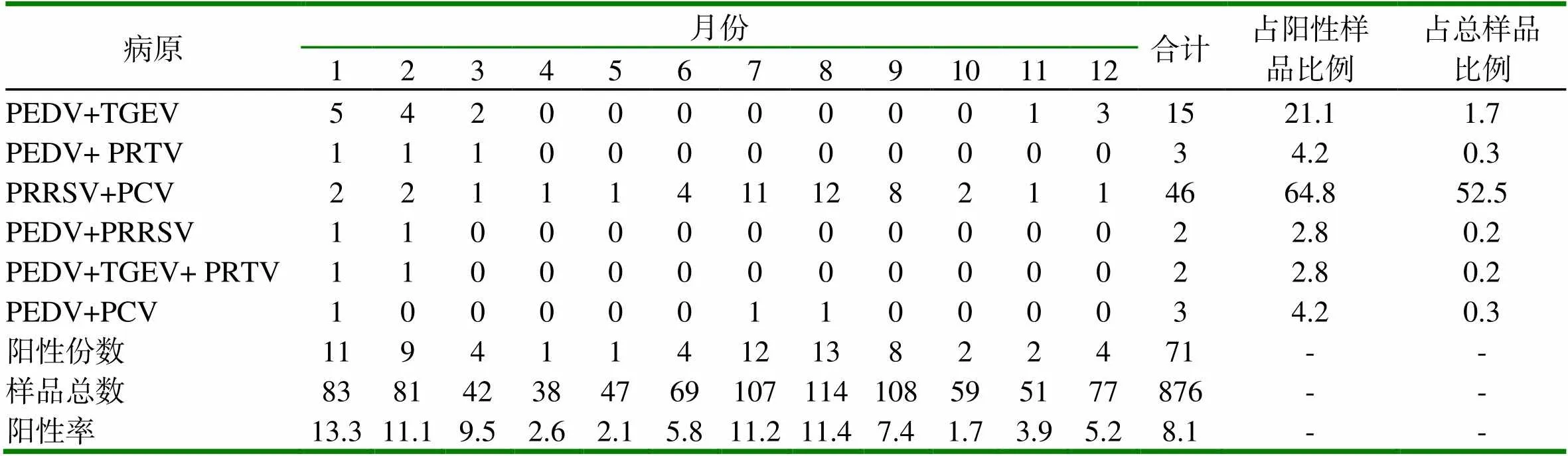
表3 2016年~2018年间山东省16个地区病毒性疾病混合感染的检出情况 (%)
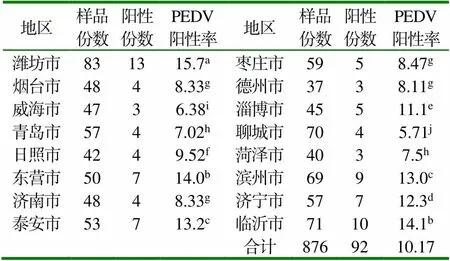
表4 2016-2018年间山东省16个地区PEDV的检出情况
注:同列数据字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P≥0.05),大写字母表示差异极显著(P<0.01),下同。

表5 2016-2018年间山东省16个地区PEDV的检出情况(%)
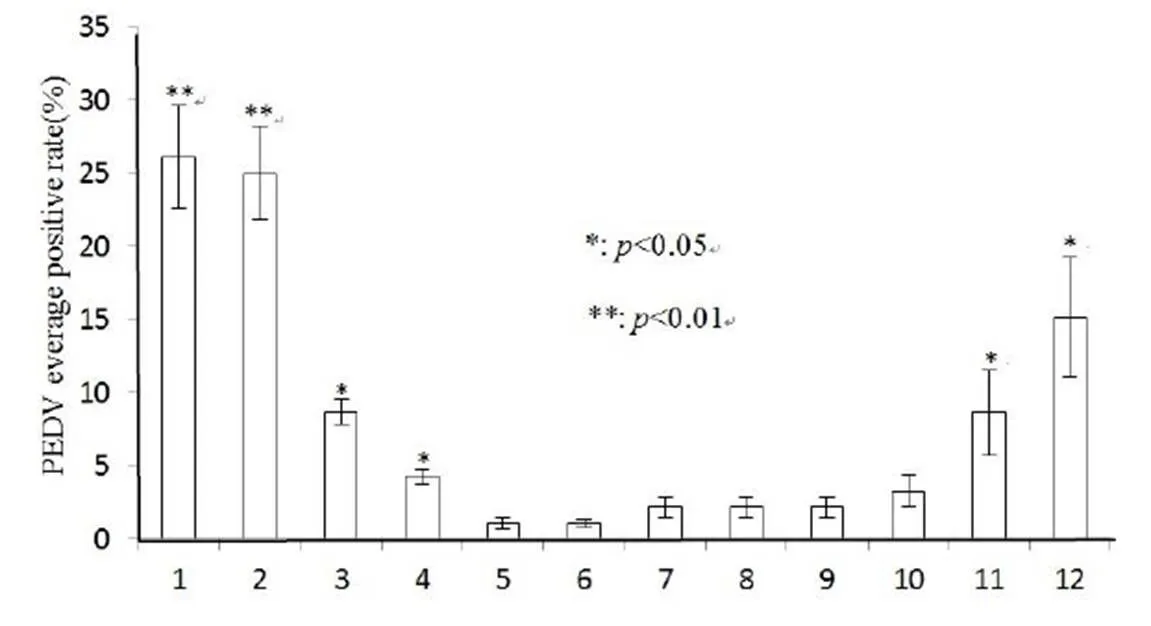
图1 2016年~2018年间山东省16个地区不同月份PEDV的检出情况
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
2.5 不同月份PEDV的流行情况分析 2016 ~2018年间山东省17个地区样品检测结果按不同月份统计,PEDV检出率位于1.1%~26.1%,其中1月份检出率最高为26.1%,5、6月份检出率最低为1.1%。1,2月份PEDV检出率极显著高于其它月份(P<0.01);3,4,11,12月份PEDV检出率显著高于5,6,9,10月份(P<0.05),见图1。
2.6 不同日龄猪PEDV检出情况 2016-2018年间山东省16个地区样品中1日龄~14日龄猪的样品数量为253头,14日龄~28日龄猪的样品数量为216头,28~70日龄猪的样品数量为232头,70~120日龄猪的样品数量为102头,120~270日龄猪的样品数量为55头,大于270日龄猪的样品数量为18只。各个日龄段PEDV检出率差异均显著(P< 0.05);1日龄~14日龄猪和14日龄~28日龄猪PEDV检出率与其它日龄段相比差异极显著(P<0.01);其它日龄段PEDV检出率差异均显著(P<0.05),见图2。表明PED最易感猪的年龄为1~28日龄。
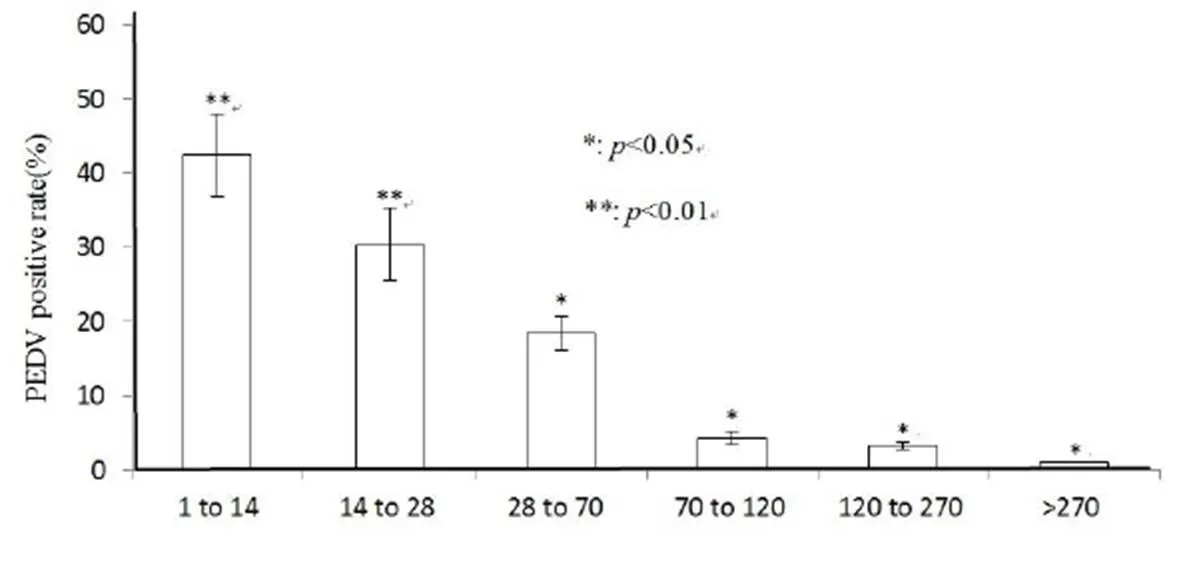
图2 2016年~2018年间山东省17个地区不同日龄猪PEDV的检出情况
2.7 不同品种猪PEDV检出情况 876份样品中肉用型样品为625份,种用型样品为251份。肉用型三元品种的检出率与其它品种检出率差异显著(P<0.05);种用型大白品种检出率与其它品种检出率差异显著(p<0.05);肉用型特种野猪和种用型杜洛克均为检出,与其它品种检出率相比差异显著(P<0.05),见表6,表明不同品种的猪均有可能感染PED。

表6 2016年~2018年间不同品种猪PEDV检出情况 (%)
3 讨论
(1)对来自山东省不同地区2016年~2018年间规模化养猪场的876份肠组织器官样品进行病毒分离,有671份样品检测到致病性病毒,其中92份检测到PEDV,PEDV既能单独感染,也能混合感染。受感染PED的猪通过粪便排出病毒后,污染环境、饲料、饮水、交通工具及用具等造成易感猪的感染,感染PEDV的猪免疫力下降,更容易感染PRRS、PC等其他病毒性疾病[7, 8];或感染了其他病毒性疾病的猪免疫力下降,在PED存在的猪场,更容易感染PEDV。(2)3年间对山东省16个市的PEDV检测表明,不同地区PEDV检出率差别较大。检出率超过10%的地区从高到低分别为潍坊市、临沂市、东营市、泰安市、滨州市、济宁市和淄博市,因此随着养殖规模的不断增加,养殖场需要注重生物安全的控制,减少PED对养猪业造成的经济损失。(3)3年间病料样品PEDV平均检出率为10.5(92/876)%,2016年PEDV检出率为14.1%,2016年为9.1%,2018年为7.8%,PEDV呈逐年降低的趋势,该病自2010年在我国暴发以来,越来越引起人们的重视,表明PED危害逐渐降低,但是仍然是山东省养猪业的重要病毒性疾病之一。PEDV单纯感染检出率2016年为9.8%,2016年为6.7%,2018年为5.5%;混合感染检出率2016年为4.3%,2016年为2.4%,2018年为2.3%,因此不论是单独感染还是混可感染,PEDV呈现逐年降低的趋势,这表明改善山东养猪业的大环境,做好饲养管理和健全生物安全体系,PEDV流行将逐渐降低。(4)3年间检测结果表明不同月份PEDV检出率差别较大,1、2月份PEDV检出率极显著高于其它月份,3、4、11、12月份PEDV检出率显著高于5、6、7、8、9、10月份,这与资料报导相符[9]。(5)调查发现不同年龄的猪PEDV检出率差异极大,该病易感猪的年龄为1月以内,1~28日龄猪是该病最易感年龄。通过对不同品种猪PEDV检出率调查发现,肉用猪和种用猪均有可能感染PED,而肉用型检出率高于种用型,可能是种用型养殖场生物安全控制较好的原因。
本研究对山东省16个地区PEDV检测数据进行了统计学分析,了解了3年来山东省规模化养猪场PED流行规律,为目前山东省大型养猪场有效防控PED提供科学依据,对PED有效防控策略的制定具有重大意义。
[1] Song D, Park B. Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus genes, 2012, 44(2): 167-175.
[2] 白小磊, 崔进, 崔甜甜等. 广东部分地区猪流行性腹泻病毒流行病学调查[J]. 中国兽医学报, 2016, 36(11): 1823-1828, 1863.
[3] 王飞, 陈小芬, 苏丹萍等. 2014-2015年我国部分省份猪流行性腹泻病毒S基因的遗传性变异分析[J]. 中国兽医学报, 2016, 36(9): 1484-1488.
[4] 孙贤刚, 唐蕊涵, 蔡雨涵等. 2011-2012年四川省猪流行性腹泻病毒的遗传变异分析[J]. 中国兽医学报, 2015, 35(1): 16-21.
[5] Yao-wei Huang, Alllan w.Dichenman, Pablo pineyro, et al.Origin, evolution, and genotyping of emergent Porcine Epidemic Diarrhea virus stains in United states[J].American society for Mircobiology, 2013, 4(5): e00737-13.
[6] Yunfang Su, Yunchao Liu, Yumei Chen, et al.A novel duplex TaqMan probe-based real-time PT-Qpcr for detecting and differentiating classical and variant porcine epidemic diarrhea viruses[J].Mol cell probes, 2018, 37(2): 6-11.
[7] LI R, QIAO S, YANG Y, et al.Phylogenetic analysis of porcine epidemic diarrhea virus(PEDV)field strains in central china based on the ORF3 gene and the main neutralization epitopes[J].Arch Virol, 2014, 159(5):1057-1065.
[8] Yang X, Huo J Y, CHEN L, et al. Genetic variation analysis of reemerging porcine epidemic diarrhea virus prevailing in central china from 2010 to 2011[J]. Virus Genes, 2013, 46(2): 337-344.
[9] 甘振磊, 汤德元, 李春燕等. 猪流行性腹泻流行特点及流行现状的研究[J]. 猪业科学, 2010, 12: 24-18.
(2020–04–02)
S851.31+3
A
1007-1733(2020)06-0053-04
