高中化学解题中守恒法的有效应用
2020-06-29周媛
周 媛
(安徽省华东师范大学芜湖外国语学校 241000)
高中化学解题中守恒法是一种常见的解题方式.守恒定律主要是参与化学反应物质,其反应物和生成物的总质量、原子总数、化合价升降总数以及电荷等保持不变.借助守恒法考虑化学反应前后的状态,优化相关计算活动,有效降低化学问题解题难度,提高学生解题效率,保证解题的准确性.高中化学中存在着很多种守恒,如质量守恒、电子守恒、元素守恒以及电荷守恒等,有效借助守恒定律,优化化学问题解题,提高学生解题能力.
一、化学解题中应用质量守恒法
质量守恒法主要是在任何与周围不联系的物质系统中,发生的任何一种变化,其总质量不会发生变化.高中化学解题中,应用质量守恒法解题,应当按照化学反应前后反应物和生成物总质量不变的原理,对化学题目进行思考和解题.
例1 在混合物中包含A、B、C三种物质,A物质的重量是25 g,B物质的重量是10 g,C物质的重量是5 g,将混合物放置在密封的容器中,通过加热直到反应停止,反应之后容器内有10 g物质A,21 g物质B,同时产生了一种新的物质D,求解反应物和生成物的质量比.
在此题解答的过程中,如果按照传统的解题方式,求解生成物的质量,整个过程会比较复杂,而且很容易出现计算错误.守恒法的应用中,需要引导学生仔细分析题目,根据题目中的已知条件,寻找解题的突破点.在此题中结合题目中的条件,明确参与反应前各物质质量和和反应后各物质和相等.解题题目分析可以了解,A和C是反应物,通过分析可以得出A和C反应的质量为15 g,B的质量增加,生成的质量是11 g,生成物D的质量需要求解.根据质量守恒法完成解题,假设D的质量是x,根据相应的求解,得出D的质量,最终得出反应物和生成物的质量比.
二、化学解题中应用元素守恒法
元素守恒是守恒法的重要方式之一,主要是化学反应前后元素类型不会发生变化,元素的原子个数和物质质量不会发生变化.一般来说,元素守恒主要有原子守恒和离子守恒,原子守恒法主要是反应前后原子种类和个数不发生变化,完成相关化学题目的推导和解答.
例2 在一定量的水中添加9.8g过氧化钠和铝的混合物,如果化学反应完全,没有多余的固体,之后加入180.00 mL 5 mol/L的盐酸,使得反应生成的沉淀完全消失,求解原来混合物中过氧化钠和铝的质量分别是多少?
此题解答的过程中,根据题目中的条件,利用常规解题方式较为困难,如果利用元素守恒法解题,可以使得解题更加简单.在解题的过程中,需要明确解题的关键,对加入盐酸之后溶液中的物质是氯化钠和氧化铝.在解题中,假设铝的物质的量是xmol,过氧化钠的物质的量是ymol,根据质量守恒列出相应的计算等式,结合元素守恒方式列出计算式,通过两个算式可以得出过氧化钠和铝的质量,完成题目的有效解答.
三、化学解题中应用电荷守恒法
溶液或者物质呈现出电中性时,溶液或者物质的内部电荷存在守恒现象,阴离子电量和和阳离子电量和相等.因此,在具体的解题中,需要灵活利用电荷守恒法,掌握化学解题技巧,提高学生的解题能力.
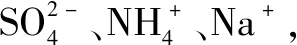
四、化学解题中应用电子守恒法
一般来说,高中化学解题中,电子守恒法主要是在氧化还原反应中使用,在整个化学反应中,氧化剂和还原剂的得失电子数量是相等的,根据这样的电子守恒定律,考查学生对化学史的补充和配平,完成相关问题解答.
例4 一些铁镁合金的重量是18.8g,将其放入一定量的硝酸溶液中,在合金完全溶解之后,收集到4.48L的NO气体,如果在还原产物中只有NO气体,在反应后的溶液中加入足够的NaOH溶液,可以生成多少克沉淀物?
一般来说,在解题中根据常规方式求解混合物的组分,但是,需要住的注意的是Fe和稀硝酸会发生反应,生成的产物是氧化产物,可能有二价铁离子,也可能是三价铁离子,也可能是两者的混合物.因此,根据电子守恒定律解题,利用铁和镁失去电子数量和氮元素得到电子数量相等,可以轻松的解答问题.
高中化学知识内容比较多,知识点内容复杂,题目类型丰富多样,为了帮助学生更好的解题,注重解题方法的传授.守恒法是一种有效的解题方式,在化学解题中应用,降低化学解题难度,提高学生解题效率.因此,高中化学解题中,应当重视守恒法的应用,加强课堂指导和引导,培养学生良好的解题思维,有效利用质量守恒、电荷守恒、元素守恒等方式,保证学生解题准确性,培养学生的综合能力和素养.
