血清尿酸水平与帕金森病发病间关系的前瞻性研究
2020-06-28邵丹丹马建芳
邵丹丹,付 洋,罗 琪,陈 捷,马建芳,黄 雷
(1.上海黄浦区五里桥街道社区卫生服务中心a.预防保健科,b.行政科,上海 200023;2.上海交通大学医学院附属瑞金医院神经内科,上海 200025)
帕金森病(Parkinson disease,PD)是一种以中脑黑质致密部多巴胺能神经元丢失为特征性病理改变的神经退行性疾病。目前流行病学研究发现,我国65岁以上人群中PD 的患病率约为1.7%[1]。PD 的主要运动症状为静止性震颤、肌强直、运动迟缓、姿势平衡障碍[2]。目前PD 的诊断主要依靠临床表现,患者等到确诊时其神经变性大多已经非常显著,只能进行症状性治疗,且疗效欠佳。因此,如何早期诊断PD,发现疾病相关的危险因素,并及早进行防治,一直是PD 研究领域的关键问题。
关于PD 的发病机制仍不明确,目前认为遗传因素 (SNCA、PARK2、PINK1、DJ-1、LRRK2 等危险基因)与环境因素(重金属、农药等)的相互作用可能是其主要病因,而致病的可能分子机制包括蛋白质错误折叠和聚集理论、线粒体功能障碍假说、神经炎症理论、肠道胶质细胞紊乱假说等。有研究发现,氧化应激损伤可能是导致多巴胺能神经元变性死亡的关键途径[3]。一方面,多巴胺在代谢过程中会产生活性氧,另外线粒体功能障碍、钙超载及铁沉积等也会导致氧化产物的增加;另一方面,随着年龄的增长或其他原因,超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶、谷胱甘肽、维生素B 等抗氧化物质的减少也会增加细胞内的氧化应激损伤。
血清尿酸(uric acid,UA)作为人体内含量最为丰富的天然抗氧化物质之一,具有类似维生素C 的抗氧化作用。有研究表明,血清UA 提供了血浆中约60%以上的自由基清除能力[4],同时具有螯合金属离子的能力。体外实验还显示,生理浓度的血清UA能够阻止脂质过氧化,减少自由基对DNA 的氧化损伤,同时能清除超氧化物、羟自由基及单线态氧。UA 可阻止超氧化物歧化酶的降解以促进其清除超氧化物,还能阻止蛋白酪氨酸残基的硝化反应,减少过氧化亚硝基阴离子的形成[5]。因此,高血清UA作为PD 的一种保护因素具有一定的理论可行性。已有较多大型前瞻性研究发现,高血清UA 水平可能是PD 发病的一个保护因素[6-8]。荷兰鹿特丹的一项基于社区人群队列的随访研究发现,在9.4 年的随访时间里,4 695名受访者中有68例新发PD 患者;在校正了性别、年龄、吸烟史、饮酒史、体质量指数等混杂因素后发现,高血清UA 水平人群(血清UA>374 μmol/L)较低血清UA 人群(血清UA为107.0~267.8 μmol/L) 的PD 患病风险下降了29%[风险比 (hazard ratio,HR)=0.710;95%置信区间(confidence interval,CI)为0.510~0.980][8]。但上述研究中绝大多数的研究对象都是欧美人群,很少有中国或者除日裔人群以外的亚洲人群。由于UA 受环境、饮食、基因等多种因素的影响,中国人群血清UA 水平与PD 发病间的联系是否与欧美人群一致,还有待进一步验证。因此,本研究对上海某社区正常老年人群中血清UA 水平与PD 发病间关系进行探索,进一步了解中国人群的PD 发病机制,寻找可能的生物标志物,以期对PD 的早期诊断和治疗有一定帮助。
资料与方法
一、资料
2011 年,上海市某社区随访队列在该社区进行流行病学调查,共纳入50岁以上对象4 495例,并于2013 年、2016 年分别进行2 次随访。随访者自愿、定期接受当地医生的当面诊断、体格检查及静脉血标本采集。具体筛选流程见图1。
二、方法
1.资料采集:基线资料主要包括以下内容。①一般人口学资料,包括姓名、性别、出生日期、民族、婚姻状况、职业、文化程度、身高、体重;②生活习惯和环境,包括吸烟饮酒史、饮水饮食习惯、运动情况、二便情况、有毒有害物质接触史、每晚平均睡眠时间、夜眠中有无打鼾;③疾病及用药史、手术外伤史,包括高血压、糖尿病、脑梗死、高脂血症、冠心病、房颤等疾病史,同时包括婚育月经史(女性)、记忆力下降病史、头部外伤史、利血平及阿司匹林等药物服用史、全身麻醉史。
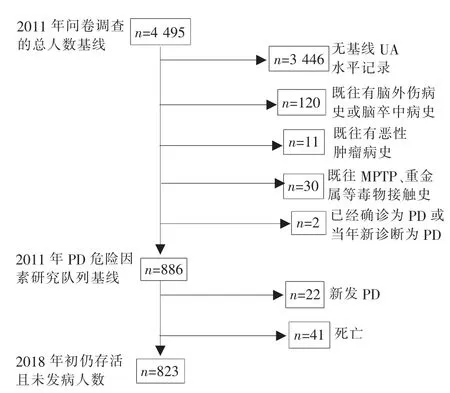
图1 PD 危险因素前瞻性研究队列筛选流程图
2.血生化检测及量表评估:行血清UA、空腹或餐后血糖、血肌酐、血总胆固醇、血甘油三酯、氨基转移酶水平检测和简易精神状态检查(mini mental status examination,MMSE)量表评估。2013 年随访的内容主要是再次对受访者进行MMSE 量表评估及血生化检测,并收集一般人口学和诊断信息。2016 年随访的内容同前次。
3.疾病定义:高UA 血症定义为男性血清UA>416 μmol/L,女性血清UA>356 μmol/L[9-10]。其他疾病及生活方式的定义同之前文献所述[11]。
4.新发PD 患者的确诊: 首先行调查问卷及经当地医师当面诊断、初步筛查受访者是否为PD;其次在征得患者同意的前提下,查看其相关医疗记录,对其被确诊为PD 的日期进行核对。最后,所有新发PD 患者均由专业神经科医师进行再次确诊。
5.统计学处理:应用SPSS 18.0 软件对资料进行统计学描述及分析。连续变量以“平均值±标准差()”表示,分类变量以“例数(百分比)”表示。用t检验比较连续变量的组间均值差异,卡方检验比较分类变量的组间构成差异。采用Cox 回归分析计算HR,并用95%CI 表示。
结果
一、一般情况比较(见表1)
最终纳入本研究统计的队列基线人数为886 人,平均年龄为 (67.01±7.56)岁,其中男性362 人(40.9%)。根据高血清UA 的定义,分为非高UA 组(294 人)及高UA 组(592 人)。2 组人群在年龄、性别及文化程度构成差异上无统计学意义。
高UA 组的体质量指数、睡眠时间、血肌酐水平显著高于非高UA 组,高UA 组的经常饮绿茶、吸烟习惯、利血平使用史及高血压、高脂血症患病率均明显高于非高UA 组。
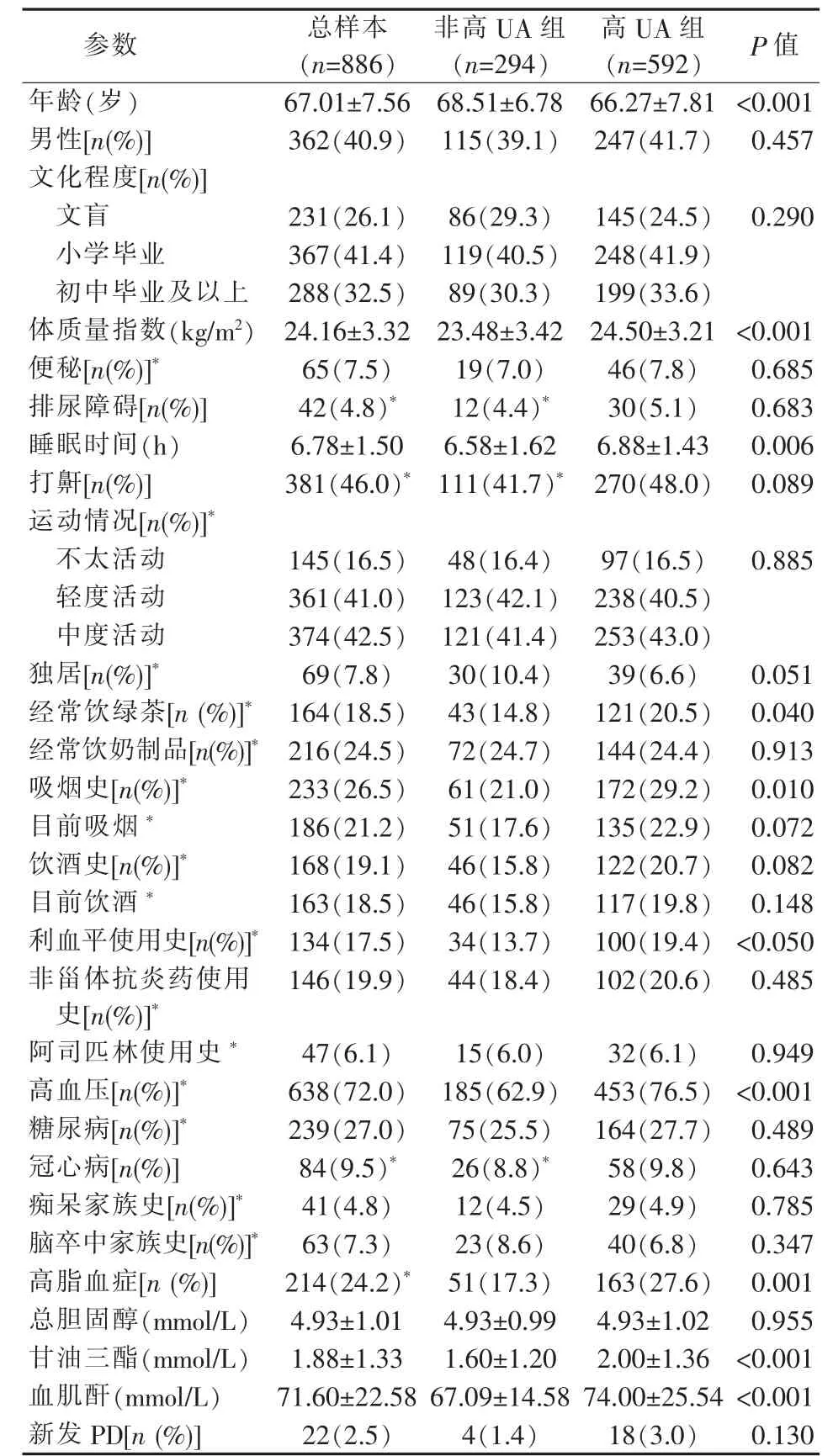
表1 基线人群一般资料情况
在6 年的随访中,新发PD 共22例,其中非高UA 组的294 人中新发PD 为4例(1.4%),高UA 组新发PD 为18例(3.0%)。2 组间新发PD 病例的占比差异无统计学意义(P=0.130)。
二、Cox 回归分析结果(见表2、表3)
单因素分析结果显示,年龄、文化程度与PD 的发病风险相关,随着年龄的增长,PD 的发病风险增加,而相对较高的教育水平可能是PD 发病的保护因素。但高UA 血症及其他因素对PD 发病的影响尚无统计学意义。
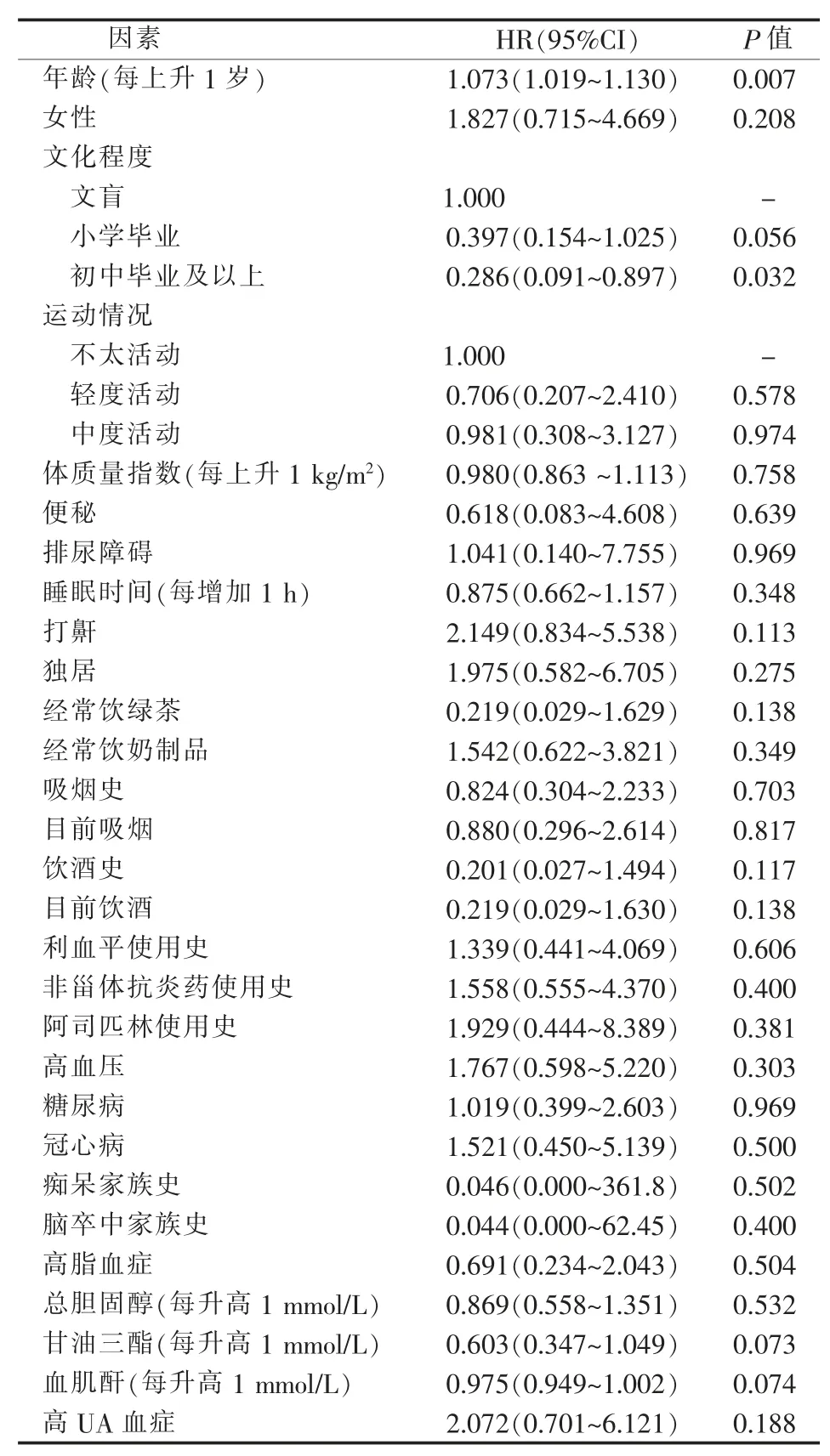
表2 PD 发病风险的单因素Cox 分析

表3 PD 发病风险的多因素Cox 回归分析
多因素Cox 回归分析结果显示(见表3),在校正了年龄、性别、文化程度、体质量指数、吸烟史、饮酒史、高血压、糖尿病、冠心病、高血脂、脑卒中及痴呆家族史、经常饮绿茶、睡眠时间、血肌酐、非甾体抗炎药、利血平使用史、便秘、排尿障碍后,仍未发现高UA 血症与PD 患病风险有关 (HR=3.368,P=0.070)。
讨论
一、血清UA 与PD 发病间的关系
本研究以上海某社区老年人群(≥50岁)队列为研究对象,通过6 年的长期随访,对新发PD 的危险因素进行了分析,是目前国内首次关于血清UA 与PD 发病间关系的前瞻性研究。队列统计结果未发现高UA 血症与PD 发病率之间有统计学相关性(HR=3.368,95%CI 为0.904~12.546,P=0.070)。这可能与本研究纳入的样本量较小,新发PD 人数过少有关。但一个以美国社区人群为基础的队列研究也发现,高血清UA 人群(血清UA>500 μmol/L)的PD 发病率并不会降低,而是低血清UA 人群(血清UA<300 μmol/L)的PD 发病率较中等血清UA 人群(血清UA 300~500 μmol/L)的发病率升高(OR=1.690,95%CI 为1.030~2.780)[12]。笔者推测,UA 对PD 发病的保护因素曲线可能呈U 形,UA 水平过低或过高,其保护作用将不再明显。
健康专业相关人群随访研究 (Health Professionals Follow-up Study,HPFS) 的流行病学研究发现[7,13],校正了年龄、吸烟史、咖啡因摄入情况后,人群的PD 发病风险随着血清UA 水平的升高而下降,最高四分位血清UA 水平(血清UA>411 μmol/L)人群较低四分位(血清UA<309 μmol/L)人群的PD发病率下降了57%(OR=0.43;95%CI:-0.02~-0.82)。Chen 等[6]及Gao 等[14]的研究也得出类似的结果,但是这种血清UA 对PD 发病的保护作用似乎只在男性中存在[15]。美国一项关于护士健康的流行病学队列研究结果显示,在女性中没有发现不同血清UA水平人群间的PD 发病率差异有统计学意义[16]。
总之,UA 对PD 的影响较为复杂,血清UA 对PD 的保护作用还有待更多相关前瞻性研究来证实。
二、其他相关因素与PD 发病间的关系
本研究在筛查PD 危险因素的过程中发现,年龄是PD 的危险因素,这与其他研究一致。PD 作为一种神经退行性疾病,在50岁前发病少见,60岁时发病率开始显著上升,80~90岁时发病率上升到4%[17]。另外,本研究还发现较高的文化程度(初中及以上)是PD 的保护因素。
除了年龄和文化程度外,其他可能的危险因素均无统计学意义。尽管有报道显示,较高的体质量指数是PD 发病的危险因素,但最近一项荟萃分析显示,体质量指数的增加并没有增加PD 的发病风险[18],这与本研究的结果一致。
目前,血脂与PD 发病关系不明确,鹿特丹的一项研究(6 465 人,平均随访时间为9.4 年)发现,高总胆固醇血症是PD 的保护因素 (HR=0.77,95%CI为0.64~0.94)[19]。也有研究报道,高胆固醇血症增加了PD 的发病风险[20],而本研究的结果则为阴性。有研究发现,收缩压与PD 发病呈负相关[21];但芬兰(59 540 人,平均随访时间为18.8 年)的一项研究则发现,女性高血压是PD 发病的危险因素[22]。尽管有部分流行病学调查[23-25]及相关分子研究[26]的证据显示,糖尿病与PD 的发病间有着密切关系,但也有其他流行病学研究发现PD 发病与糖尿病无关[27],这与本文的结果一致。较多研究发现,目前或既往吸烟是PD 发病的保护因素[28],但本研究人群的分析中并未揭示类似结果,可能是由于样本量较小所致。新加坡的一项研究(63 257 人,平均随访时间为7 年)发现,红茶而非绿茶是PD 发病的保护因素(摄取量最高组与最低组之间的相对危险度为0.29,95%CI为0.16~0.52)[29]。这与本研究并未发现经常饮绿茶具有保护作用的结果一致。作为一种神经退行性疾病,PD 患者的小胶质细胞激活十分显著,有队列研究(>14 万人,随访15 年以上)发现,经常使用非甾体抗炎药(≥2 次/周)较不使用者能降低45%的PD发病风险[30],但本研究人群中并未发现非甾体抗炎药的作用。便秘、排尿障碍等早期非运动症状是PD发病的危险因素[31],但本研究人群的结果并无统计学意义。这些与其他研究不一致的阴性结果均可能由于样本量少(886 人)、随访时间较短(6 年)而导致结果存在假阴性。
尽管体质量指数、吸烟饮酒史、高血压、糖尿病、高血脂、饮绿茶习惯、血肌酐、非甾体抗炎药、便秘、排尿障碍等在单因素筛查中并无统计学意义,本研究结合其他研究结果,依旧将其纳入最终模型进行校正。
本研究的不足之处在于,入组人群中高UA 血症人群占比较大(72.3%),明显高于一般老年人群的高UA 血症患病率[32],因有文献报道中国南方地区高UA 血症的患病率为18.6%[33],因而存在人群的选择偏倚;另外,大量受访者的血清UA 等基础资料残缺导致可分析的样本量较少,故分析结果可信度不高。此外,由于PD 本身在人群中的发病率并不高,因此较小样本且随访时间不够长的流行病学调查难以反映不同血清UA 水平人群中PD 发病率的真实情况。在今后的随访工作中,笔者将更加重视随访的质量,尽量减少关键资料的缺失;增加队列的随访时间,增加PD 的样本量。
