NEAT1在胃癌中的表达及与胃癌患者临床病理学参数相关性分析
2020-06-27张敬伟于秀娟原芸姿郭秀珍董孟华郝志慧
张敬伟 于秀娟 原芸姿 郭秀珍 董孟华 郝志慧
1 滨州医学院基础医学院病理学教研室 山东 烟台 264003;2 山东协和学院 山东 济南 250109
胃癌(gastric cancer,GC)是消化系统最常见的恶性肿瘤之一,虽然在治疗方面有所进展,但其死亡率仍然居恶性肿瘤的第2位[1]。GC的高死亡率缘于发病的特定生物学特点,如诊断是否及时,临床表现是否延迟以及高侵袭率和转移率等。GC的具体发病机制尚未完全阐明,因此,寻找GC的生物标志物或潜在治疗靶点对GC的早期确诊、治疗及预后有重要的指导意义。
目前,研究者主要在编码基因中筛选相关的GC分子标记物,然而编码序列仅占人类基因组的2%。长链非编码RNA(long non-coding RNA,LncRNA)不具有编码DNA的能力[2]。LncRNA通过调控基因表达参与表观遗传、转录、翻译等不同生命活动过程,在肿瘤发生、侵袭等过程中发挥重要功能[3]。核富集转录本(nuclear paraspeckle assembly transcript1,NEAT1)属于LncRNA,其位于细胞核内,参与构成核旁斑的核心结构,并参与众多基因转录调节。它位于人类第11号染色体上一个被称为多发性内分泌瘤病(MEN)1型的基因位点上,由RNA聚合酶2转录而来,是一种未拼接的、多聚腺苷酸化的,且受核限制的非编码转录本[4]。LncRNAs位于特定的核体周围,即位于亚核体paraspeckles周围,是维持其结构和功能必不可少的组成部分。Paraspeckles包含数个蛋白因子,如SFPQ、P54nrb、pspl、RBN14等,而SFPQ和P54nrb直接与NEAT1结合,共同参与paraspeckles的形成[5]。
已有研究证实NEAT1在人类很多恶性肿瘤中异常表达,包括白血病[6]、神经胶质瘤[7]、非小细胞肺癌[8]、卵巢癌[9]和乳腺癌[10]等,并参与肿瘤的发生、转移和预后等过程。但是在GC中,NEAT1与GC患者的相关性及在GC中发挥的作用尚不明确。本研究通过检测GC组织及癌旁正常组织中NEAT1的表达水平,分析NEAT1表达与GC患者临床病理特征及预后的相关性。
1 资料与方法
1.1 一般资料 选取2015年1月至2016年2月于济南市某三甲医院进行手术切除治疗的78例GC患者的GC组织及癌旁(距肿物切除边缘>5 cm)处正常组织标本,所有患者均经病理学证实。将手术切除的GC组织(GC组)及癌旁组织标本(正常组)迅速放入液氮中,并置于-80℃超低温冰箱中保存待测。GC患者中,男46例,女32例,年龄为47~72岁,平均为(55.23±9.20)岁。GC患者临床病理资料包括年龄、性别、分化程度、有无脉管侵犯、有无淋巴结及远处转移情况、TNM分期情况以及是否复发。临床分期情况为:Ⅰ期者11例,Ⅱ期者13例,Ⅲ期者22例,Ⅳ期者32例。分化程度为:高分化者21例,中分化者41例,低分化者16例。淋巴结转移者50例,淋巴结未转移者28例。浸润深度为:T1者7例,T2者10例,T3者21例,T4者40例。复发者28例,未复发者50例。所有参与本研究的患者在实验前对本次实验目的及过程均有充分的了解,患者表示自愿参与本次实验,并签署知情同意书,符合医学伦理学要求并经本院伦理委员会审批通过。
纳入标准为:①受试者经病理证实为GC;②均没有在术前进行过放疗或化疗;③所有患者知情且签署同意书。排除标准为:①自身免疫性疾病患者;②心力衰竭或呼吸衰竭患者;③合并其他恶性肿瘤患者;④合并心、肾等器质性损伤;⑤临床资料不完整者。
1.2 方法
1.2.1 分离RNA 用TRIzol法分别从GC组织、癌旁正常组织处提取总RNA。
1.2.2 实时荧光定量PCR(qRT-PCR)检测NEAT1表达水平 按照Takara试剂盒说明书将RNA反转录为cDNA,并采用qRT-PCR法检测NEAT1相对表达量。
1.3 随访 术后采用打电话访问、门诊复查等方式对患者随访,随访时间截止于2018年8月,统计无病生存期(Disease-free survival,DFS)与总体生存期(overall survival,OS),并绘制Kaplan-Meier生存曲线,比较GC患者DFS及OS。
1.4 统计学方法 应用SPSS 21.0软件分析数据。采用t检验比较GC组织与癌旁正常组织中NEAT1的表达,采用χ2检验分析NEAT1表达水平与GC患者临床病理学参数的相关性,采用Kaplan-Meier法绘制生存曲线,采用Log-rank检验比较生存率,采用COX单因素与多因素回归模型分析影响GC患者预后的相关因素。P<0.05 为差异有统计学意义。
2 结果
2.1 NEAT1在GC中的表达情况 qRT-PCR结果显示,NEAT1在GC组织中的表达水平高于在癌旁正常胃黏膜上皮组织中的表达水平,P<0.01,见图1。
2.2 NEAT1在GC中的表达与临床病理学参数的相关性 按照GC组织中NEAT1的表达水平(NEAT1表达的中位数)将GC患者分为NEAT1高表达组与低表达组。采用χ2检验分析NEAT1表达与患者年龄、性别、分化程度、脉管侵犯、淋巴结及远处转移情况、临床分期情况、复发等临床病理特征的相关性。结果显示,NEAT1表达与脉管侵犯、远处转移、复发显著相关(P<0.05或<0.01),而与患者年龄、性别、分化程度、有无神经侵犯、分期、淋巴结转移无显著相关性,见表1。

表1 NEAT1表达水平与GC患者临床病理学参数的相关性
注:*P<0.05,***P<0.001。
2.3 NEAT1表达与患者预后的相关性 单因素COX回归分析显示,NEAT的表达水平与GC患者的DFS相关;多因素COX回归分析显示,NEAT1表达水平为患者DFS的独立危险因素,见表2。单因素COX回归分析显示,NEAT1的表达水平与GC患者的OS相关;多因素COX回归分析显示,NEAT1表达水平为患者OS的独立危险因素,见表3。Kaplan-Meier生存分析结果显示NEAT1高表达组的GC患者术后OS与DFS均少于较NEAT1低表达组GC患者,P<0.01,见图2、3。
图2 NEAT1表达与患者OS 的Kaplan-Meier生存曲线
图3 NEAT1表达与患者DFS的Kaplan-Meier生存曲线
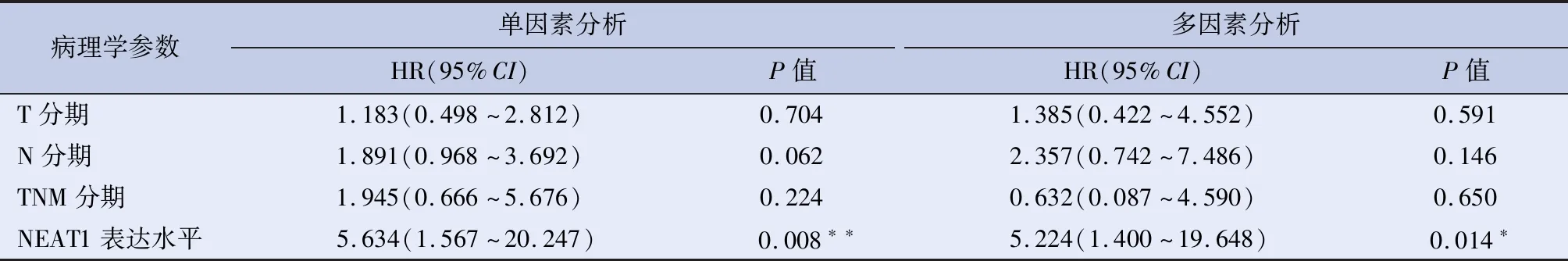
表2 GC患者DFS的单因素与多因素COX回归分析
注:*P<0.05,**P<0.01。
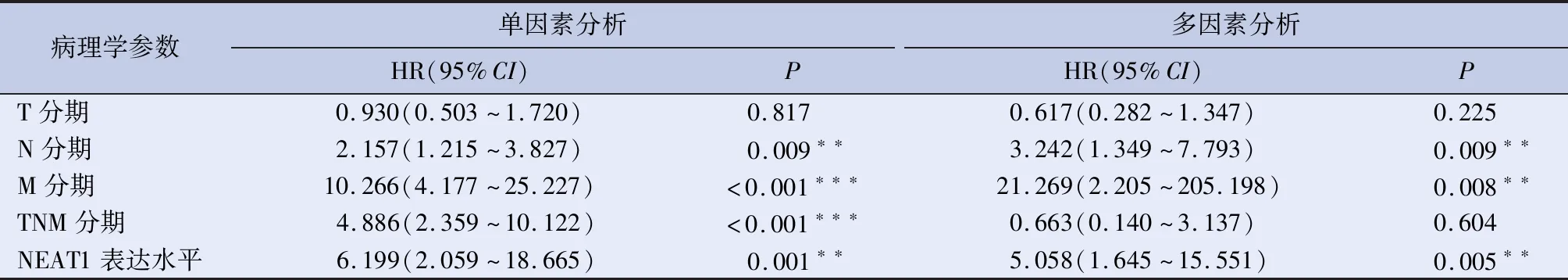
表3 GC患者OS的单因素与多因素COX回归分析
注:**P<0.01,***P<0.001。
3 讨论
NEAT1在某些肿瘤组织和细胞系中的表达明显高于正常组织,且NEAT1高表达提示着较差的预后和更低的五年生存期[6-10]。NEAT1在卵巢癌组织中高表达,可以成为诊断卵巢癌的重要标志物,并且其表达水平与卵巢癌组织的大小以及肿瘤的分期呈正相关[11]。此外,NEAT1的表达与肺腺癌转移相关转录子1(metastasis-assoiated lung adenocarcinoma transcript1,MALAT1)相关,NEAT1高表达常伴随着MALAT1的高表达,MALAT1是一种通过调节肿瘤相关基因剪切发挥原癌基因作用的LncRNA。NEAT1参与了前列腺癌原癌基因的修饰和转录调节过程。NEAT1高表达提示肝细胞癌患者预后较差,NEAT1高表达和患者肿瘤大小、数目,淋巴结转移,门静脉癌栓形成和TNM分期相关[12]。但关于NEAT1在人GC中异常表达的报道较少。
本研究显示,NEAT1在GC组织中的表达水平高于癌旁正常组织,这与严华等[13-14]的研究是一致的。NEAT1表达与GC脉管侵犯、远处转移、以及是否复发显著相关,而与患者年龄、性别、分化程度、神经侵犯、分期、淋巴结转移无关。这说明NEAT1在GC以及其他恶性肿瘤的发生中可能起着促癌基因的作用。NEAT1表达水平为患者DFS与OS的独立危险因素。NEAT1高表达组GC患者的术后OS与DFS与NEAT1低表达组GC患者相比均较差。已有关于NEAT1和肝癌的研究表明,NEAT1高表达提示肝细胞癌患者预后较差。这说明NEAT1高表达可能影响某些恶性肿瘤患者的预后。
综上所述,NEAT1在GC的发生、发展过程以及预后中可能发挥着一定的作用,可将其作为临床诊断及评估患者预后的潜在指标。至于NEAT1在GC的增殖、转移等过程的具体机制有待于进一步探索求证。
