大毒中药对机体的不良反应和肝脏药物代谢酶调节研究进展
2020-06-24吕新尹航阎明睿范晓宇贾艳艳姜丽丽刘勇
吕新 尹航 阎明睿 范晓宇 贾艳艳 姜丽丽 刘勇
摘要 近十几年来,随着中药在世界的应用范围不断扩大,中华人民共和国药典中所记载的10种大毒中药也逐渐被应用于临床。但人体服用此类药物后,在肝脏药物代谢酶的介导下达到治疗效果的同时,也可能会对代谢酶产生影响,从而造成机体器官的损伤等不良反应,严重时会危及到人的生命。因此,对大毒中药的不良反应和肝脏代谢酶研究极为重要。本文将10种大毒中药国内外的相关研究资料进行总结,为大毒中药的研究和临床的合理应用提供科学依据。
关键词 大毒;中药;毒性成分;不良反应;肝脏代谢酶;细胞色素P450酶;尿苷二磷酸-葡萄糖醛酸转移酶;研究进展
Research Progress on the Adverse Effects and Regulation of Liver Drug Metabolism Enzymes in the Body of Large Toxic Chinese Medicine
LYU Xin,YIN Hang,YAN Mingrui,FAN Xiaoyu,JIA Yanyan,JIANG Lili,LIU Yong
(School of Life and Medicine,Dalian University of Technology,Panjin 124221,China)
Abstract In recent decades,with the continuous expansion of the scope of application of Chinese medicine in the world,10 types of large toxic Chinese medicines are recorded in the Chinese Pharmacopoeia and have gradually been used in clinics.However,after taking these drugs,the liver drug-metabolizing enzymes are mediated to achieve the therapeutic effect.The metabolic enzymes are affected,resulting in organ damage and other adverse reactions,which may endanger human life in serious cases.Therefore,it is extremely important to study the adverse reactions of large toxic Chinese medicines and liver metabolic enzymes.This paper summarizes the relevant research data of 10 kinds of large toxic Chinese medicines worldwide,providing scientific basis for the research and reasonable clinical application of large toxic Chinese medicines.
Keywords Large toxic; Chinese medicines; Toxic components; Adverse reaction; Liver metabolic enzymes; Cytochrome P450 enzyme; UDP-glucuronosyltransferase; Research progress
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.23.010
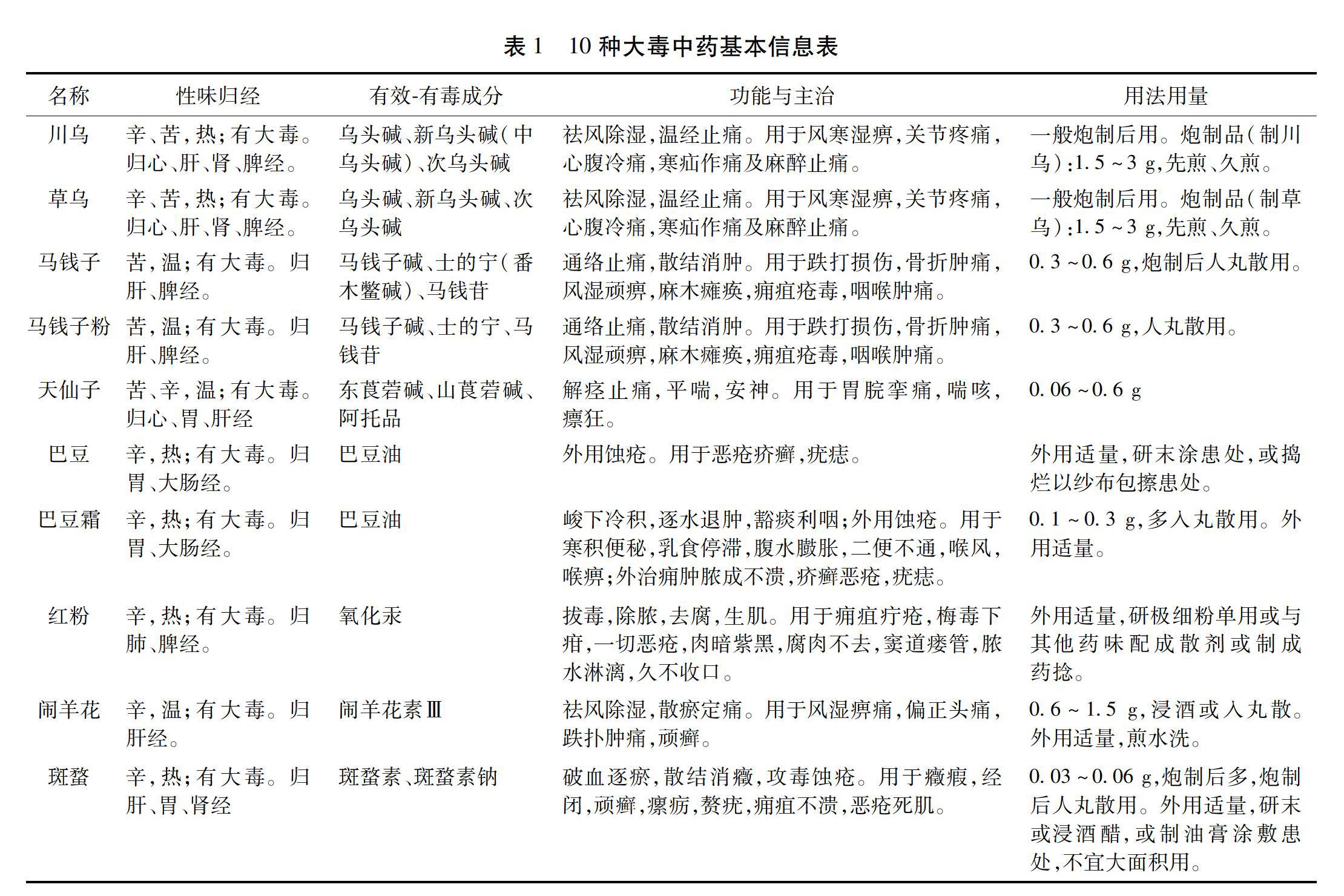
中药作为一种药用化合物和天然产物,在疾病治疗方面已经拥有了几千年的历史,并且越來越受到人们的重视,已在世界范围内得到了广泛的使用。现今,研究资料表明可根据毒性的强烈程度对中药进行分类,即极毒、大毒、有毒和小毒中药[1]。小毒和有毒中药的临床和记录应用最多,大毒中药次之,极毒中药最少;虽然大毒中药具有较强毒性,但其对于顽疾、恶疾等病症效果良好。见表1。在2020年版《中华人民共和国药典》中收录川乌、草乌、马钱子、马钱子粉、闹羊花、斑蝥、红粉、天仙子、巴豆、巴豆霜10种大毒中药[2],应用最早的是天仙子、斑蝥、川乌和草乌,始载于《神农本草经》,其他大毒中药在《伤寒论》《本草图经》中均有明确记载。随着大毒中药的临床应用不断增加,各医家对此类中药的认识也逐渐增多。由于大毒中药所含的有效成分与毒性成分多数相同,故其对治疗剂量要求较为严格。见表1。大毒中药在机体内可经肝脏代谢酶代谢,而外源性物质的摄入对代谢酶的激活或抑制均可使有进而毒成分含量发生变化,从而可能发生中毒等不良反应,严重者死亡。因此,本文收集了10种大毒中药对机体的不良反应和肝脏药物代谢酶调节的相关文献,进行归纳分析,为其在临床上发挥药效和用药安全提供参考依据。
1 不良反应
世界卫生组织(WHO)和中国药品管理法均对药物不良反应进行定义,为合格药品正常用法用量下出现的与用药目无关的反应[3]。由于多数大毒中药较为特殊,本身所含有效成分在治疗疾病时,同样也可能会引起不良反应等不良反应,对机体各个系统造成伤害。
1.1 神经系统 由于多数大毒中药含有生物碱,对神经末梢及中枢神经系统均有兴奋作用。使用不当时,易发生严重的不良反应,导致机体中毒。川乌和草乌常统称为乌头,但它们是同一种科下的2种不同的植物,川乌来源于毛茛科植物乌头Aconitum carmichaelii Debx.的干燥母根,而草乌来源于毛茛科植物北乌头Aconitum kusnezoffii Reichb.的干燥块根。乌头类含有双酯型二萜生物碱可对神经系统产生作用,具体表现如下:口舌和四肢麻木[4-6]、头晕头痛[7-9]、潮热出汗、面色苍白、四肢抽搐、强直、嗜睡谵妄,甚至神志不清。个别可出现四肢瘫痪、失明、双侧性面颊僵硬[10]。服用阿托品后,可缓解以上中毒症状。马钱子对神经系统也会产生一定的不良反应,表现为口舌和四肢麻木、疲倦[11]、癫痫[12]、惊厥[13]等。而且摄入大剂量的马钱子引起的不良反应多为急性,在服药10 min后,即可出现局部的麻木,25~30 min后发作为癫痫、惊厥。巴豆会导致头晕昏迷,而巴豆霜表现为癫痫[14]。红粉含有99%以上氧化汞,故其外用易发生中毒,主要表现为神经异常、面部器官的微小震颤,严重者为意向性震颤、全身震颤。服用汞解毒剂二巯基丙磺酸钠,可对以上不良反应进行治疗[15]。服用闹羊花水泡液,可导致头晕、精神欠佳、视物不清、发冷、瞳孔等大等圆等[1]。
1.2 循环系统 乌头对循环系统具有一定的影响,导致各种心律失常[16],常表现为心慌心悸、胸闷气短、血压下降、心动过速,严重者休克甚至死亡。有报道表明服用超出正常剂量的马钱子时,可使人体心律失常、窦性心动过速等[17],相关的具体临床表现与乌头类一致[13],马钱子还会导致人体肌肉疼痛[11]。巴豆则表现为胸闷和心悸,巴豆霜会导致低血压甚至休克[14]。闹羊花同样会引起血压下降、心率缓慢、心肌收缩力下降、休克、呼吸困难、心律失常等[18]。
1.3 消化系统 乌头对消化系统引起的不良反应,常表现为流涎、吞咽困难、恶心呕吐、腹痛腹泻等[11]。马钱子的中毒反应表现与乌头类似,如恶心呕吐、腹痛腹泻、黑便等[13]。巴豆油在巴豆中含量较高,约为30%~45%。由于巴豆油的毒性较大,服用1/4滴即可致猛泻,故巴豆和巴豆霜易发生呕吐、腹痛、腹泻等不良反应[14]。闹羊花中毒会导致人体发生恶心、呕吐[1,19]、腹胀等。
1.4 其他 乌头类外用会发生脏器衰竭,如肾、心、脑等。服用巴豆时,巴豆油会损坏肾脏,导致尿血。斑蝥素的致死量大约为30 mg,斑蝥中含有0.35%以上斑蝥素,故斑蝥用药时,易使机体脏器受到伤害,且肾脏的损害较为常见和严重。不同剂量的斑蝥可损害肾脏的不同结构,低剂量可使肾小球受到损害,中等量及高剂量则会损害肾小管[18],出现腰痛、尿频、尿少、血尿,严重者产生肾衰等不良反应。巴豆和巴豆霜均对人体肌肤具有强烈的刺激作用,主要表现为皮肤瘙痒、疼痛、丘疹、疱疹、皮炎等。巴豆霜和红粉对鼻黏膜系统可产生一定影响,引起鼻炎[18]。巴豆和斑蝥对皮肤刺激性会使局部出现水疱[1]。
2 肝脏药物代谢酶
2.1 细胞色素P450 细胞色素P450酶(CYP450)主要位于肝细胞的内质网和线粒体内膜中,介导了90%以上药物代谢[20],是机体内最重要的Ⅰ相代谢酶。大量的同工酶共同组成了CYP450这个超基因大家族,目前已确定了CYP450包含了18个家族[21]。其中,主要的药物代谢酶为CYP1、CYP2和CYP3家族[22]。在这3个家族中,CYP1A2(参与代谢药物约4%)、CYP2B6(参与代谢药物约8%)、CYP2C8(参与代谢药物约5%)、CYP2C9(参与代谢药物约15%~20%)、CYP2C19(参与代谢药物约5%~10%)、CYP2D6(参与代谢药物约30%)、CYP3A4(参与代谢药物约50%)为重要亚型。药物中某些成分通过对CYP450酶的激活或抑制作用,改变药物在机体内代谢过程,发生药物与药物之间相互作用,导致药物增效、减效或失效,从而可导致机体产生不良反应或毒性反应。同样,CYP450酶也会介导药物与食物的相互作用。因为多数大毒中药均含有毒性成分,故了解CYP450对大毒中药的药物代谢及药物与药物相互作用对于临床安全具有重大意义。
乌头类主要的药效和毒性活性成分为乌头碱、新乌头碱(中乌头碱)和次乌头碱,这3种成分均是双酯型二萜类生物碱[2]。已有研究表明CYP450酶介入双酯型二萜生物碱在体内药物代谢后,将大毒性的双酯型生物转化成小毒性的单酯型,单酯型二萜生物碱还具有较好的抗炎活性,故可达到减毒增效的效果;但双酯型二萜生物碱能够抑制CYP酶的活性,减轻代谢作用,从而产生毒性[23]。已研究发现不同浓度的乌头碱、新乌头碱和次乌头碱,均对CYP3A4基因质粒转染人肝癌细胞(HepG2)和人结直肠腺癌细胞(LS174T)中CYP3A4活性以及mRNA和蛋白的表达具有抑制作用[24]。生川乌和制川乌(炮制后的川乌)均能显著降低大鼠体内CYP3A的活性、CYP3A蛋白和CYP3A1、CYP3A2 mRNA表达水平[25]。川乌-白芍是臨床上治疗风湿关节炎等风湿痹证的常用药对,两味中药不同配比均能降低川乌对CYP3A、CYP2D、CYP2C及CYP1A2的抑制作用,而对CYP2E1基本无影响[26]。制川乌与白芍配伍后,对大鼠肝微粒体中CYP3A4、CYP1A2、CYP2D6、CYP2E1具有激活作用[27],表明川乌(生/制)与白芍配伍后和单用川乌比较,配伍后可使CYP450酶活性明显增强,加快川乌中双酯型二萜生物碱降解,促进抗炎活性较好和毒性较小的单酯型生物碱生成,从而起到增效减毒的作用。陈红等[28]研究发现配生/法/姜半夏后均可逆转生/制川乌对大鼠CYP3A的抑制作用,可加快川乌中双酯型二萜生物碱的代谢,起到降毒作用。孙晨等[29]研究发现草乌对小鼠肝脏和肠道中的CYP3A及肝脏中的CYP2E1均有明显的抑制作用。
马钱子粉为制马钱子的细粉,主要药效和毒性成分与马钱子一致,分别是马钱子碱和士的宁(番木鳖碱)。Li等[30]研究表明,马钱子碱能抑制CYP3A4的活性,对CYP1A2、CYP2C9、CYP2D6以及CYP2E1也有较弱的抑制作用。当浓度小于10 μmol/L时,马钱子碱能显著抑制CYP3A4介导的咪达唑仑1′-羟基化反应,Ki值为2.14 μmol/L。Xing等[31]研究结果显示,高剂量的马钱子碱使CYP3A介导的睾酮6β-羟基化反应和CYP2C介导的甲苯磺酰胺羟化反应活性分别降低24.5%和34.6%,使CYP2E1介导的对硝基苯酚羟化反应活性升高146.1%。而马钱子碱与甘草中的甘草次酸联用时,二者可使CYP2E1介导的对硝基苯酚羟化反应和CYP1A2介导的乙氧基间苯二酚-O-去乙基化反应活性分别降低51.4%和33.5%。
而对于马钱子中的另一种重要活性成分士的宁而言,Mao等[32]通过LC-MS/MS法对士的宁在人肝微粒体和重组CYP亚型中的生物激活潜力进行分析,发现CYP3A4具有最高的催化士的宁的生物活性的作用。Li等[33]的研究结果同样表明,CYP3A4也是士的宁在人体内的主要药物代谢酶,而CYP2C9和CYP2C19在其代谢中起到的辅助作用。同时,浓度为50 μmol/L的士的宁能抑制CYP3A4介导的睾酮6β-羟基化反应、CYP1A2介导的非那西丁O-脱乙基化反应以及CYP2E1介导的氯唑沙宗6-羟基化反应,抑制能力高达85%。士的宁对CYP3A4介导的睾酮6β-羟基化反应的抑制能力最强,IC50值为5.9 μmol/L。而甘草次酸能竞争性抑制士的宁的代谢,Ki值为17.7 μmol/L。因此,马钱子在与甘草联合使用时可能会发生代谢相互作用。
天仙子中含有影响神经系统的托烷类生物碱,如东莨宕碱、山莨宕碱、阿托品[34]。有报道提出这3种托烷生物碱的大鼠药物代谢动力学(PK)特性极为相似,给药后吸收迅速但消除缓慢,Zhang等[35]的实验也证明了这一点。Renner U D等[36]证明东莨菪碱在与CYP3A孵育期间会发生氧化脱甲基,而葡萄柚汁中某些成分可抑制CYP3A活性。当东莨菪碱与150 mL葡萄柚汁一起给药时,东莨菪碱的浓度持续增加,导致tmax明显延长,AUC0-24 h值升高,进而使东莨菪碱的生物利用度显著提高。因此,在服用天仙子时,应注意饮食方面,对葡萄柚汁的摄入合理,避免发生药物相互作用。
在大毒中药斑蝥中,斑蝥素和斑蝥酸钠为主要药效和毒性活性成分。由于斑蝥酸钠与斑蝥素比较,其毒性更低,且分子量更小,更容易进入细胞中发挥作用,因此,斑蝥酸钠的抗肿瘤作用更好。已有研究发现,斑蝥素对大鼠代谢酶CYP2D6和CYP3A4具有抑制作用,对CYP1A2和CYP2C19活性无明显作用,而对CYP2C9具有激活作用[37]。马燕等[38]将斑蝥素对粘虫的代谢酶系进行研究,结果表明斑蝥素对粘虫体内的CYP450Ο-脱甲基酶(PPO)表现为先抑制后激活的趋势;但离体活体条件下,则显著抑制PPO活性。郑晓康等[39]研究发现依鲁替尼经CYP2D6和CYP3A4代谢,斑蝥酸钠也可抑制肝脏药物代谢酶CYP2D6和CYP3A4活性。故当斑蝥药用时,可使依鲁替尼的暴露量增加,升高血药浓度,从而可能会增加其药效。因为依鲁替尼和斑蝥酸钠对晚期癌症有良好的疗效,在临床上可选用斑蝥酸钠和依鲁替尼联合用于恶性肿瘤的治疗,但应适当调整2种药物的使用剂量,避免发生药物相互作用。
2.2 尿苷二磷酸-葡萄糖醛酸转移酶 尿苷二磷酸-葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT)主要在位于肝细胞内质网中,参与了约35%的药物代谢,是最重要的Ⅱ相代谢酶之一。UGT也是一个同工酶组成的超家族,根据其核苷酸序列将人类的UGT超家族分为4个家族:UGT1、UGT2、UGT3和UGT8[40-41];其中,UGT1A1、1A3、1A4、1A6、1A9、2B7和2B15对药物和异源生物代谢最为重要。在药物代谢中,UGT催化葡萄糖醛酸从UDP-葡萄糖醛酸(UDP-glucuronic Acid,UDPGA)转移到其他分子(通常是疏水分子)上,生成亲水性代谢物由肾脏及胆汁排泄,其余的疏水性代谢物则由肠道及转运蛋白运输[42-43]。与CYP450比较,UGT与大毒中药相关的研究较少,但UGT对其药物代谢发挥极其重要的作用。
李阿荣等[44]研究表明UGT1A4能够催化士的宁和马钱子碱发生葡萄糖醛酸化反应,证明人肝微粒体中UGT1A4是士的宁和马钱子碱葡萄糖醛酸化活性的主要亚酶。由于肝脏药物代谢酶的浓度会影响药物在体内的浓度水平,因此马钱子与UGT1A4抑制剂类药物联合应用时,能降低药物的代谢速率,引起毒性反应[45]。
2.3 其他酶 Umamaheswari等[46]关于印度药用植物对黄嘌呤氧化酶(Xanthine Oxidase,XO)的抑制活性研究结果显示,当浓度为100 μg/mL时,马钱子的水提取物和甲醇提取物对黄嘌呤氧化酶的抑制作用均大于50%,IC50值分别为7.75 μg/mL和6.80 μg/mL。与IC50值为6.75 μg/mL的标准药物别嘌醇比较,100 μg/mL马钱子对黄嘌呤氧化酶的抑制作用为93.21%。Li等[47]研究马钱子碱神经毒性的结果表明,与对照组比较,马钱子碱组小鼠脑部的单胺氧化酶(MAO)活性显著降低了52.5%。马钱子中含有抗炎和抗凋亡的活性成分为马钱苷,Yang等[48]研究表明,马钱苷能通过调节PI3K/AKT信号通路,降低金属蛋白酶MMP-3、MMP-13、ADAMTS-4和ADAMTS-5的释放。而Shi等[49]通过明胶酶谱分析得到结论,浓度为5 μmol/L和10 μmol/L的马钱子碱均表现出对金属蛋白酶MMP-2和MMP-9明显的抑制作用。
马钱子碱能显著降低HePG2细胞中环氧合酶-2(COX-2)的表达,诱导细胞收缩,促进囊泡和凋亡小体的形成从而抑制HePG2细胞的增殖[50]。故马钱子碱可应用于治疗肝细胞性肝癌。Zhao等[51]在以斑马鱼为研究对象,采用western blot研究发现暴露于马钱子的斑马鱼的半胱氨酸蛋白酶-3(CasPase-3)、半胱氨酸蛋白酶-8(CasPse-8)和半胱氨酸蛋白酶-9(CasPase-9)的表达有着明显的提升。赵霞等[52]研究马钱子对斑马鱼幼鱼肝脏毒性的结果显示,与对照组比较,中、高剂量马钱子组的过氧化氢酶(CAT)活性下降,低剂量马钱子组的过氧化氢酶活性有显著差异;与对照组比较,马钱子暴露组的超氧化物歧化酶(SOD)活性下降且差異显著。并且,马钱子暴露组能引起醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶P2(GSTP2)的基因表达水平降低。Zhang等[53]也得到相似的结论,马钱子暴露组的肾脏SOD活性和谷胱甘肽(GSH)水平显著降低。
已有研究表明斑蝥素可显著激活羧酸酯酶,处理后48 h酶比活力最大;能明显抑制碱性磷酸酯酶的活性,处理时间越长,则抑制效果越强;对谷胱甘肽S-转移酶(GST)表现出先激活后抑制的影响[38]。因此,斑蝥素对黏虫的毒杀作用,可能与其对代谢酶系中碱性磷酸酯酶的抑制作用有关。徐启华等[54]在报道中提出,将含有红粉的生肌散红粉涂抹破损背部皮肤的大鼠,大鼠体内N-乙酰氨基糖苷酶(NAG)有升高的趋势;SOD、Cu-SOD、谷胱甘肽过氧化物酶(GSH-PX)活性显著增强;GSH、金属硫蛋白(MT)含量显著升高,丙二醛(MDA)有升高的趋势。
闹羊花的主要有效成分为闹羊花素III(R-III),Zhang等[55]研究表明,R-III口服或静脉注射后,能快速的吸收,其半衰期分别为0.76 h和0.19 h。R-III对5龄菜青虫幼虫的乙酰胆碱酯酶(AChE)活体和离体活性均无显著影响,但可使ACh含量显著降低。R-III对试虫的Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶比活力具有可逆性激活作用,不同剂量对其可逆程度的影响不同,小剂量使机体达到正常水平,大剂量则产生抑制酶活力的作用。Na+-K+-ATP酶与Ca2+-Mg2+-ATP酶被激活或被抑制及ACh含量下降,均会影响神经冲动传导,从而达到杀虫作用。
LeeJ等[56]采用单核细胞/巨噬细胞集落刺激因子(M-CSF)和RANKL(核因子-κB(NF-κB)配体的受体激活剂)培养小鼠骨髓来源的巨噬细胞(BMM),经巴豆甲醇提取物处理后,能降低耐酒石酸酸性磷酸酶(TRAP)阳性多核细胞的生成与核因子κB(NF-κB)信号通路的激活,抑制丝裂原对蛋白激酶(MAPK)的激活作用,抑制NF-κB配体的受体激活剂(RANKL)对c-Fos、核因子激活的T细胞c1(NFATc1)和树突状细胞特异性跨膜蛋白(DC-STAMP)表达的诱导作用。
巴豆中巴豆油含有一种活性成分,为12-O-十四烷酰-P horbol-13-乙酸酯(TPA)。在TPA施用后2~8 h,对剃毛小鼠皮肤表皮的葡萄糖-6-磷酸葡萄糖脱氢酶、己糖激酶、磷酸果糖激酶和丙酮酸激酶等葡萄糖代谢关键酶具有激活作用。由于这些酶含量的净增加,对糖酵解酶活性产生增加的影响[57]。由于TPA可诱导RNA和DNA合成及细胞增殖的增加,可能会诱发癌症,故推测糖酵解途径的激活与肿瘤启动子的致癌作用有关。
3 结语与展望
随着时代的发展,中药在国内外的临床应用越来越广泛,但治疗时出现的不良反应日益增加,尤其大毒中药这一类特殊药物,虽然它们对疑难病症具有较强疗效,但其所含有效和毒性成分一致,与其他中药比较,其相关的不良反应出现频率更高,范围更广。由于大毒中药在体内经肝脏代谢酶代谢后,其生物转化产物或外源性物质可能会对肝脏药物代谢酶产生激活或抑制作用,从而影响药物在体内的含量,引起药物与药物之间相互作用,导致机体发生不良反应。因此,明确大毒中药对肝脏药物代谢酶的调节作用十分重要。但目前关于大毒中药的不良反应与肝脏药物代谢酶的直接相关研究较少,本文将近几年不良反应与药物代谢酶相关文献进行汇总,为大毒中药的进一步科学研究提供理论基础,为合理的临床治疗提供科学依据。
参考文献
[1]中国中医药信息学会外治分会.大毒中药临床外用技术规范(草案)[J].中国现代应用药学,2019,36(24):3112-3115.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:40,52-53,56,82,161,236,247,345.
[3]边原,冯佳佳,林麗开,等.药品不良反应的监测方法[J].中国研究型医院,2019,6(3):46-49.
[4]宋大龙.浅析中药乌头不良反应原因以及控制对策[J].临床医药文献(连续型电子期刊),2019,6(8):169.
[5]王丹,贾德贤,李真真,等.草乌的安全性评价与风险控制措施的探讨[J].中国中药杂志,2018,43(15):3093-3100.
[6]张晓朦,李凡,张冰,等.数据挖掘乌头类中成药不良反应特点与合理用药警戒[J].中国中药杂志,2018,43(2):216-221.
[7]杨翠荣.乌头类中药37例临床中毒反应及治疗分析[J].实用中西医结合临床,2017,17(3):161-162.
[8]王丹.基于文献研究的中药草乌安全性综合评价[D].北京:北京中医药大学,2019.
[9]罗国蓉.有毒中药与中药不良反应的分析[J].中西医结合心血管病(连续型电子期刊),2019,7(19):13,15.
[10]李剑江.乌头类中药临床不良反应及影响因素分析[J].中外医疗,2019,38(16):123-125.
[11]Chan TY.Herbal medicine causing likely strychnine poisoning[J].Hum Exp Toxicol,2002,21(8):467-468.
[12]吴玉,陈军,方芸,等.马钱子碱传递体的体外透皮与促渗性质研究[J].中国中药杂志,2016,41(16):3009-3015.
[13]韩菁婕.临床中药学服务模式探讨及中日医院马钱子应用情况分析[D].北京:北京中医药大学,2017.
[14]秦林飞.泻下类中药饮片安全问题分析与用药警戒思考[J].当代临床医刊,2017,30(4):3290,3272.
[15]徐淑岗,杨海东.闹羊花中毒存在明显个体差异[J].罕少疾病杂志,2019,26(3):109-110.
[16]施玉琴.中药乌头发生不良反应的原因和对策探讨[J].中国医药指南,2018,16(9):171.
[17]王琦玮,刘良,黄光照.马钱子的毒理学研究进展[J].法医学杂志,2004,20(3):183-184.
[18]董思麟,张会宗,李国信.药典收载有毒中药早期预警研究[J].中华中医药学刊,2014,32(10):2372-2375.
[19]刘艾林,张莉,杜冠华.闹羊花毒之历史认识与评价[J].中药药理与临床,2018,34(5):161-163.
[20]崔冰冰,刘天珍,尹榕,等.人CYP450酶基因多态性与药物代谢研究进展[J].甘肃医药,2018,37(12):1062-1065.
[21]宋复兴,王蓉,原永芳.药物代谢细胞色素P450酶学与研究方法应用进展[J].医学综述,2017,23(4):665-669.
[22]李思聪,李金良,李旭廷.肝脏CYP450酶系与中药相互作用的研究进展[J].四川畜牧兽医,2017,44(6):29-31.
[23]孙燕,王雨,刘京华,等.附子双酯型二萜生物碱对代谢酶的影响及心肌毒性研究进展[J].天津中医药大学学报,2018,37(4):274-279.
[24]李晗,王宇光,马增春,等.乌头碱、新乌头碱和次乌头碱对CYP3A4抑制作用研究[J].中国新药杂志,2017,26(9):999-1004.
[25]Yang M,Ji X,Zuo Z.Relationships between the Toxicities of Radix Aconiti Lateralis Preparata(Fuzi)and the Toxicokinetics of Its Main Diester-Diterpenoid Alkaloids[J].Toxins(Basel),2018,10(10):391.
[26]董輝,李太平,孙晖.川乌配伍白芍减毒增效作用研究进展[J].中国医药导报,2020,17(4):32-35.
[27]杨华生,闻丽珍,黎晓丽,等.基于经皮给药研究制川乌与白芍配伍对大鼠皮肤及肝微粒体中CYP450活性的影响[J].中国医院药学杂志,2018,38(1):5-9,13.
[28]陈红,程再兴,吴锦俊,等.川乌配伍半夏对大鼠CYP3A的影响[J].中国实验方剂学杂志,2017,23(2):75-80.
[29]孙晨.十八种中药对小鼠肾脏三种主要有机阴离子转运体及部分Cyps的影响[D].广州:广州中医药大学,2014.
[30]Li X,Wang K,Wei W,et al.In vitro metabolism of brucine by human liver microsomes and its interactions with CYP substrates[J].Chem Biol Interact,2013,204(3):140-143.
[31]Xing PP,Wu WH,Du P,et al.Effects of brucine combined with glycyrrhetinic acid or liquiritin on rat hepatic cytochrome P450 activities in vivo[J].Yao Xue Xue Bao,2011,46(5):573-580.
[32]YX Mao,ZZ Fang,GB Ge,et al.Metabolic activation of strychnine to reactive intermediates by human liver microsomes and CYP3A4 [J].Drug metabolism reviews,2010,42(8):229-230.
[33]L Liu,J Xiao,ZH Peng,et al.In vitro metabolism of strychnine by human cytochrome p450 and its interaction with glycyrrhetic acid [J].Chinese herbal medicines,2012,4(2):118-125.
[34]王金华,李莉,杜冠华.中药天仙子的历史认识与评价[J].中药药理与临床,2018,34(5):163-165.
[35]Zhang P,Li Y,Liu G,et al.Simultaneous determination of atropine,scopolamine,and anisodamine from Hyoscyamus niger L.in rat plasma by high-performance liquid chromatography with tandem mass spectrometry and its application to a pharmacokinetics study[J].J Sep Sci,2014,37(19):2664-2674.
[36]Renner UD,Oertel R,Kirch W.Pharmacokinetics and pharmacodynamics in clinical use of scopolamine[J].Ther Drug Monit,2005,27(5):655-665.
[37]Zhou CJ,Qiao LM,Zhao LH,et al.Evaluation of the impact of cantharidin on rat CYP enzymes by using a cocktail of probe drugs[J].Fitoterapia,2015,107:49-53.
[38]马燕,刘瑞瑞,马志卿,等.斑蝥素对粘虫几种代谢酶及多酚氧化酶的影响[J].昆虫学报,2010,53(8):870-875.
[39]郑晓康.斑蝥酸钠对依鲁替尼在大鼠体内外代谢的影响[D].郑州:河南科技大学,2018.
[40]Tourancheau A,Rouleau M,Guauque-Olarte S,et al.Quantitative profiling of the UGT transcriptome in human drug-metabolizing tissues[J].Pharmacogenomics J,2018,18(2):251-261.
[41]王哲,姜丽丽,夏杨柳,等.尿苷二磷酸-葡萄糖醛酸转移酶介导的中药-药物相互作用[J].世界科学技术-中医药现代化,2019,21(2):210-214.
[42]Miners JO,Chau N,Rowland A,et al.Inhibition of human UDP-glucuronosyltransferase enzymes by lapatinib,pazopanib,regorafenib and sorafenib:Implications for hyperbilirubinemia[J].Biochem Pharmacol,2017,129:85-95.
[43]张喆,蔡卫民.UGT1A1基因多态性对药物代谢和临床作用影响的进展[J].药学实践杂志,2018,36(6):488-492.
[44]李阿榮,刘若轩,邓志军,等.人尿苷二磷酸葡糖醛酸转移酶参与马钱子碱和士的宁体外代谢研究[J].中药新药与临床药理,2018,29(6):780-784.
[45]李阿荣,李丽明,邓志军,等.马钱子碱和士的宁在人肝微粒体和UGT1A4重组酶中的体外酶动力学研究[J].广东药科大学学报,2018,34(5):541-546.
[46]Umamaheswari M,AsokKumar K,Somasundaram A,et al.Xanthine oxidase inhibitory activity of some Indian medical plants[J].J Ethnopharmacol,2007,109(3):547-551.
[47]Li S,Chu Y,Zhang R,et al.Prophylactic Neuroprotection of Total Glucosides of Paeoniae Radix Alba against Semen Strychni-Induced Neurotoxicity in Rats:Suppressing Oxidative Stress and Reducing the Absorption of Toxic Components[J].Nutrients,2018,10(4):514.
[48]Yang Y,Gu Y,Zhao H,et al.Loganin Attenuates Osteoarthritis in Rats by Inhibiting IL-1β-Induced Catabolism and Apoptosis in Chondrocytes Via Regulation of Phosphatidylinositol 3-Kinases(PI3K)/Akt[J].Med Sci Monit,2019,25:4159-4168.
[49]Shi X,Zhu M,Kang Y,et al.Wnt/β-catenin signaling pathway is involved in regulating the migration by an effective natural compound brucine in LoVo cells[J].Phytomedicine,2018,46:85-92.
[50]Lu L,Huang R,Wu Y,et al.Brucine:A Review of Phytochemistry,Pharmacology,and Toxicology[J].Front Pharmacol,2020,11:377.
[51]Zhao C,Li E,Wang Z,et al.Nux Vomica Exposure Triggered Liver Injury and Metabolic Disturbance in Zebrafish Larvae[J].Zebrafish,2018,15(6):610-628.
[52]赵霞,赵崇军,魏紫樱,等.马钱子对斑马鱼幼鱼肝脏毒性的初步研究[J].环球中医药,2020,13(4):546-554.
[53]Zhang M,Wang C,Cai HL,et al.Licorice Extracts Attenuate Nephrotoxicity Induced by Brucine Through Suppression of Mitochondria Apoptotic Pathway and STAT3 Activation[J].Curr Med Sci,2019,39(6):890-898.
[54]徐启华,彭博,贺蓉,等.中国毒理学会中药与天然药物毒理专业委员会第一次(2016年)学术交流大会论文集[C].天津:中国毒理学会中药与天然药物毒理专业委员会,2016.
[55]Zhang JQ,Zhao CC,Yang QY,et al.Pharmacokinetics,bioavailability and tissue distribution studies of rhodojaponin III in mice using QTRAP LC-MS/MS[J].Biomed Chromatogr,2019,33(11):e4649.
[56]Lee J,Kim HH.Methanol Extract of Croton Pycnanthus Benth.Inhibits Osteoclast Differentiation by Suppressing the MAPK and NF-κB Signaling Pathways[J].J Bone Metab,2014,21(4):269-275.
[57]Tejwani GA,Chauhan S,Duruibe V,et al.Enhancement in the activities of mouse epidermal glucose-6-phosphate dehydrogenase,hexokinase,phosphofructokinase,and pyruvate kinase by 12-O-tetradecanoyl-phorbol-13-acetate[J].Arch Biochem Biophys,1985,239(2):462-466.
(2020-11-19收稿 责任编辑:王明)
