蛋白酶体抑制剂Oprozomib对顺铂耐药卵巢癌细胞的作用及机制研究
2020-06-24任方芳赵太强
任方芳,赵太强
四川省医学科学院/四川省人民医院/电子科技大学附属医院检验科,成都 610072
顺铂(cisplatin,DDP)是广泛应用于多种实体肿瘤的有效抗癌药物,其作用机制为诱发DNA双链间或链内相邻两个鸟嘌呤之间产生交联,引起DNA损伤[1-3]。DDP的临床应用主要受到其耐药性的限制[4-5]。对耐药细胞株的研究发现,DDP耐药是由多种因素导致的,包括细胞内药物运输系统功能异常导致胞内有效药物浓度不足[6],强化的DNA修复系统导致细胞能够耐受药物引起的DNA损伤[7],抗凋亡信号通路异常活化等[8]。最近研究发现,谷胱甘肽(GSH)作为胞内重要的解毒剂,可能参与铂类耐药。DDP作用产生的活性氧簇(reactive oxygen species,ROS)具有细胞毒作用,而GSH依赖还原性巯基与过氧化物结合,可促进ROS及时清除,具有细胞保护作用[9-11]。卵巢癌是妇科常见的恶性肿瘤,病死率居妇科肿瘤性疾病之首[12],耐药是其预后较差的关键因素,寻找潜在的药物耐受靶点对提供可行的用药选择具有指导意义。本研究以二代蛋白酶体抑制剂Oprozomib (OZ)[13]作为增敏剂,研究其对DDP耐药卵巢癌细胞SKOV3/DDP和A2780/DDP的作用及机制,以期为改善耐药卵巢癌患者的预后提供理论依据。
1 材料与方法
1.1主要试剂及仪器 SKOV3/DDP、A2780/DDP细胞株(上海酶研生物科技有限公司);CCK-8检测试剂盒(上海七海复泰生物科技有限公司);GSH、ROS检测试剂盒(上海碧云天生物技术有限公司);蛋白酶体活性检测试剂盒(美国A bcam公司);DDP、OZ、四甲基哌啶(Tempol)(美国Selleck公司);兔抗人谷胱甘肽合成酶(GSS) IgG单克隆抗体(美国Cell Signaling Technology公司);辣根过氧化物标记的山羊抗兔IgG(美国Santa Cruz公司);GSH分子(美国Sigma-Aldrich公司)。FLx800TM荧光/发光酶标仪(美国Biotek公司);Cytomics FC 500流式细胞仪(美国Beckman公司);ChemiDoc化学发光成像系统(美国Bio-Rad公司)。
1.2细胞培养 用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2孵育箱中培养SKOV3/DDP、A2780/DDP细胞株,每24 h换液一次,待融合至90%时传代,选取对数生长期细胞进行实验。
1.3CCK-8法检测细胞活力 将SKOV3/DDP、A2780/DDP细胞分别以1×104个细胞/孔接种于96孔板,待细胞贴壁后,加入药物进行处理。研究OZ对细胞活力的影响时,将OZ设为9个浓度梯度(0、3、9、27、81、243、729、2187、6561 nmol/L), 与细胞共培养24 h。研究DDP对细胞活力的影响时,根据处理因素不同分为DPP组和DDP+OZ组:DDP+OZ组加入500 nmol/L OZ 50 ml,其工作浓度为125 nmol/L,DDP组加入相应体积的溶剂。3 h后,两组均加入相应浓度DDP(0、3、9、27、81、243、729、2181、6561 nmol/L)至终体积200 μl,24 h时每孔加入20 μl CCK-8溶液,37 ℃避光孵育30~60 min,采用FLx800TM荧光/发光酶标仪检测450 nm波长处的吸光度(OD)值,计算IC50。IC50=最小值+(最大值-最小值)/[1+10(logEC50-X)×最大斜率的绝对值]。
1.4流式细胞术检测细胞凋亡情况 将SKOV3/DDP、A2780/DDP细胞分别以5×105/孔密度接种于6孔板,待细胞贴壁后,根据处理因素不同分为对照组、DDP组(各细胞在OZ作用下的IC50浓度)、OZ组(各细胞的IC50浓度)和DDP+OZ组。采用0.5%胰酶消化收集处理细胞,500 r/min离心5min,弃上清,用预冷的PBS洗3次,离心后用结合缓冲液重悬细胞,调整浓度为1×106个/ml,混匀后取100 μl,加入钙磷脂结合蛋白-Ⅴ(Annexin-Ⅴ)和溴化丙锭(PI)各5 μl,室温避光染色20 min,采用Cytomics FC 500流式细胞仪检测细胞凋亡情况。
1.5蛋白酶体糜蛋白酶(CT-L)活性检测 实验分为对照组和OZ组。研究不同浓度OZ对蛋白酶体CT-L活性的影响时,OZ组采用0~512 nmol/L(覆盖IC50值)浓度梯度处理细胞。研究OZ处理时间对蛋白酶体CT-L活性的影响时,将固定浓度(IC50)OZ与细胞共培养12、24 h。收集细胞,4 ℃下PBS洗3次,0.5% NP-40重悬裂解,4 ℃下12 000 g离心15 min,取上清20 μl,稀释至100 μl,加入1 μl底物,37 ℃避光孵育30 min,采用FLx800TM荧光/发光酶标仪进行检测(激发光波长为350 nm,发射光波长为440 nm),计算相对荧光单位(RFU)。
1.6Western blotting检测GSS蛋白表达水平 实验分为对照组和OZ组[固定浓度(IC50)OZ与细胞共培养]。24 h后收集细胞,用RIPA裂解液4 ℃裂解30 min,12 000 g离心15 min,取上清,采用BCA法进行蛋白定量,加入相应体积5×上样缓冲液,SDS-PAGE电泳分离蛋白(浓缩胶、分离胶聚丙烯酰胺浓度分别为8%、10%),每组上样20 μg,采用两步法(S1:80 V,15 min;S2:100 V,1.5 h)电泳,250 mA横流转膜1 h,5%脱脂奶粉4 ℃封闭过夜。GSS一抗(1:1000)4 ℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG二抗(1:2000)室温孵育1 h。采用ChemiDoc化学发光成像系统进行检测,Image J软件计算各条带灰度值,半定量分析GSS蛋白表达 水平。
1.7GSH水平检测 实验分为对照组和OZ组[固定浓度(IC50)OZ与细胞共培养]。收集细胞,参照GSH检测试剂盒说明书步骤,采用FLx800TM荧光/发光酶标仪检测412 nm波长处的OD值,根据标准曲线计算GSH浓度。
1.8R O S 水平检测 实验分为对照组、D D P组、OZ组、DDP+OZ组、DPP+OZ+GSH组和D P P+O Z+Te m p o l 组。D D P、O Z 浓 度 如 上 所述,DPP+OZ+GSH组另加入50 μmol/L GSH,DPP+OZ+Tempol组另加入1 μmol/L Tempol。24 h后收集细胞,参照ROS检测试剂盒说明书步骤,采用FLx800TM荧光/发光酶标仪(激发光为488 nm,发射光为525 nm)检测ROS水平。
1.9统计学处理 采用SPSS 19.0软件进行统计分析。计量资料用±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1O Z 和D D P 对耐药卵巢癌细胞活性的影响 C C K-8 法检测结果显示,O Z 浓度范围为3~6500 nmol/L时,SKOV3/DDP、A2780/DDP细胞的IC50分别为140、350 nmol/L,选取该浓度进行后续实验(图1A)。无OZ作用时,DDP在两株细胞中的IC50分别为10 120、6040 nmol/L;与OZ联用时,DDP在两株细胞中的IC50分别降至154、232 nmol/L, 选取该浓度进行后续实验(图1B)。

图1 OZ和DDP对耐药卵巢癌细胞活性的影响(n=4)Fig.1 Effects of OZ and DDP on the activities of SKOV3/DDP and A2780/DDP cells (n=4)
2.2OZ增强耐药卵巢癌细胞对DDP的敏感性 流式细胞术检测结果显示,与各自对照组比较,使用DDP处理SKOV3/DDP、A2780/DDP细胞时,两株细胞的凋亡率(SKOV3/DDP为4.94%±4.29%,A2780/DDP为3.93%±2.89%)差异均无统计学意义(P>0.05);与各自DDP组比较,DDP与OZ联用时,两株细胞的凋亡率均明显增高(SKOV3/DDP为30.88%±4.84%,A2780/DDP为40.94%±11.40%,P<0.01,图2)。
2.3OZ抑制耐药卵巢癌细胞蛋白酶体CT-L活性
蛋白酶体CT-L活性检测结果显示,OZ抑制CT-L活性的作用随浓度增加而增强,并呈剂量依赖性(图3A)。OZ处理12 h时,与对照组比较,OZ组SKOV3/DDP、A2780/DDP细胞CT-L活性均明显降低[分别为(174.43±67.34) U vs. (562.30±33.94) U、(281.23±55.93) U vs. (682.03±139.32) U,P<0.01];OZ处理24 h时,与对照组比较,OZ组SKOV3/DDP、A2780/DDP细胞CT-L活性均明显降低[(404.32±39.91) U vs. (610.23±81.94) U、(394.55±29.93) U vs. (893.90±39.50) U,P<0.01]。与OZ处理12 h时比较,OZ处理24 h时两株细胞CT-L活性差异无统计学意义(P>0.05,图3)。
2.4OZ抑制耐药卵巢癌细胞内GSH合成 GSH水平检测结果显示,OZ可明显抑制SKOV3/DDP、A2780/DDP胞内GSH生成(P<0.01,图4A)。OZ处理12h时,与对照组比较,OZ组两株细胞内GSH水平均明显降低[(4.85±2.33) μmol/L vs. (15.45±3.84) μmol/L、(5.34±1.39) μmol/L vs. (27.43±4.90) μmol/L,P<0.01]。Western blotting检测结果显示,与各自对照组比较,两株细胞GSS蛋白表达水平均明显降低(P<0.01,图4B)。
2.5OZ抑制耐药卵巢癌细胞内ROS清除 ROS水平检测结果显示,与对照组比较,DDP组SKOV3/DDP、A2780/DDP胞内ROS水平无明显变化,OZ组、DDP+OZ组两株细胞内ROS水平均升高(P<0.05或P<0.01)。与DDP+OZ组比较,DDP+OZ+GHS组两株细胞内ROS水平均明显降低(P<0.05,图5)。
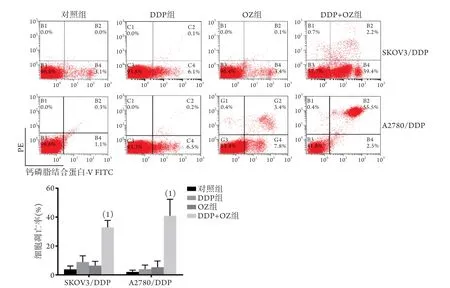
图2 OZ对耐药卵巢癌细胞顺铂敏感性的影响(n=3)Fig.2 Effect of OZ on DDP sensitivity of SKOV3/DDP and A2780/DDP cells (n=3)

图3 OZ对耐药卵巢癌细胞蛋白酶体糜蛋白酶活性的影响(n=4)Fig.3 Effect of OZ on the activity of proteasome chymotrypsin in SKOV3/DDP and A2780/DDP cells (n=4)
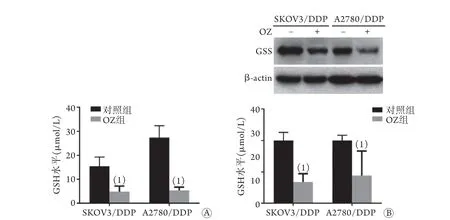
图4 OZ对耐药卵巢癌细胞内GSH合成、GSS蛋白表达的影响Fig.4 Effect of OZ on GSH synthesis and GSS expression in SKOV3/DDP and A2780/DDP cells
2.6ROS清除剂Tempol逆转OZ对DDP的增敏作用 ROS水平检测结果显示,在两株细胞中,Tempol导致DDP+OZ联用提高的ROS水平降低(P<0.05,P<0.01,图6A)。细胞凋亡检测结果显示,与DDP+OZ组相比,DDP+OZ+Tempol组SKOV3/DDP、A2780/DDP细胞凋亡率均明显降低(12.43%±3.10% vs. 37.59%±4.33%、22.49%±5.66% vs. 58.39%±10.86%,P<0.01,图6B、C)。
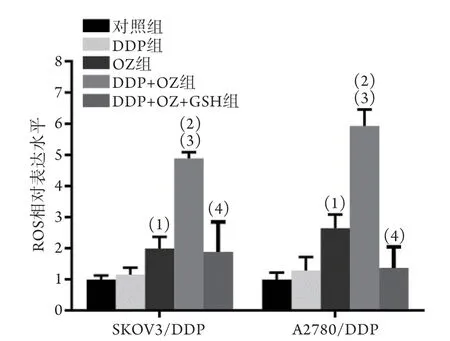
图5 OZ抑制耐药卵巢癌细胞内ROS清除(n=4)Fig.5 OZ inhibits the ROS clearance in SKOV3/DDP and A2780/DDP cells (n=4)
3 讨 论
OZ作为第二代具有口服生物活性的蛋白酶体抑制剂,可与蛋白酶体N端苏氨酸共价结合抑制20S亚基的CT-L活性[14]。蛋白酶体抑制剂可有效抑制20S蛋白酶体活性,诱发氧化应激而发挥杀伤肿瘤细胞的作用[15]。GST是胞内至关重要的抗氧化酶,可调节多种ROS毒性,发挥细胞保护作用,其含量或活性异常与肿瘤的发生发展有关。卵巢癌细胞内GST水平显著高于正常细胞,GST及其同工酶的表达和活性与卵巢癌的预后呈负相关[16]。GST参与肿瘤细胞对化疗药物的耐药。在DDP耐药卵巢癌细胞中,GST活性明显高于敏感株[17];在乳腺癌细胞中,抑制GST活性可明显逆转细胞对多柔比星的耐药[18]。GST参与细胞耐药并催化机体内亲电性化合物与GSH结合,后者作为胞内重要的还原剂,在细胞对抗氧化应激、中和ROS毒性过程中起至关重要的作用。GSH可促使有毒化合物增加水溶性、减少毒性,最终排出胞外[19]。GST作为下游重要的效应分子,可干扰GSH的清道夫作用,可能具有潜在的逆转肿瘤耐药作用。本研究以耐药卵巢癌细胞应对氧化应激的能力为切入点寻找潜在的耐药靶点。
本研究发现,在效应层面,OZ可有效协助DDP诱导耐药卵巢癌细胞凋亡,而DDP或OZ单独作用均不能有效诱导细胞凋亡;OZ单独作用可提高ROS水平,但与DDP+OZ联用相比,提高幅度有限,推测大幅度提高的ROS是诱导细胞凋亡的主要原因。GSH广泛存在于正常细胞内。药物处理可诱导细胞产生大量ROS,导致抗氧化系统能力相对降低,使细胞质膜发生脂质过氧化,引发持续的细胞损伤甚至凋亡。GSH依赖其活性巯基(-SH)等功能基团与ROS结合,保护细胞重要蛋白巯基不被后者氧化[17]。本研究为证实GSH与ROS之间的关系,在DDP+OZ联用时加入外源GSH,有效降低了ROS水平,提示GSH合成受阻与ROS水平升高有直接关系。本研究为证明ROS过剩是提高DDP敏感性的关键,在DDP+OZ联用时加入ROS清除剂Tempol,明显降低了ROS水平,细胞凋亡率亦明显下降,表明降低ROS水平对细胞具有保护作用。此外,本研究结果显示,OZ可下调GSS表达,进而减少GSH合成,GSH合成抑制后,ROS水平明显升高。
综上,笔者推测强化的ROS清除能力参与了DDP耐药,GSH可通过清除ROS发挥细胞保护作用。在耐药卵巢癌细胞中,DDP未能有效提高ROS水平可能是细胞耐药的关键,而OZ存在时,GSH减少导致ROS清除能力受阻,依赖后者的细胞毒作用诱导细胞凋亡。
