新型冠状病毒肺炎相关心搏骤停患者心肺复苏专家共识
2020-06-24中国研究型医院学会心肺复苏学专业委员会
中国研究型医院学会心肺复苏学专业委员会
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是一种由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的急性传染病[1]。SARS-CoV-2属于冠状病毒科β属冠状病毒,基因特征与蝙蝠SARS样冠状病毒有85%以上的同源性[2],主要通过呼吸道飞沫和接触传播,也可能通过气溶胶和粪-口等途径传播[3],人群普遍易感,呈聚集性发病。COVID-19传染性强,临床表现复杂多样[4-6],部分患者发展成重症和危重症。重症患者多在发病1周后出现呼吸困难和(或)低氧血症,严重者快速进展为急性呼吸窘迫综合征(ARDS)、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍等,最终因多器官衰竭(MOF)死亡。从全球范围来看,COVID-19病死率约为3.4%,国内病死率约为2.3%[7]。结合COVID-19的流行病学和临床特点[8],如何因人而异地制定COVID-19相关心搏骤停(cardiac arrest,CA)患者心肺复苏(cardiopulmonary resuscitation,CPR)方案,以指导临床救治,提高COVID-19相关CA患者的抢救成功率,是中国心肺复苏工作者的使命。由中国研究型医院学会心肺复苏学专业委员会、中国老年保健协会心肺复苏专业委员会、中国健康管理协会健康文化委员会、中华医学会科学普及分会等会同中华预防医学会灾难预防分会、中华医学会感染病学分会、中国研究型医院学会卫生应急学专业委员会、中国老年保健协会第一目击现场救护专业委员会、北京医学会灾难医学与心肺复苏分会、湖北省心脏猝死防治救中心、全军重症医学专业委员会心肺复苏学组、武警部队危重病专业委员会、《医学参考报心肺复苏学频道》编辑委员会、国家军地援鄂抗疫医疗队组成《新型冠状病毒肺炎相关心搏骤停患者心肺复苏专家共识》编写委员会,依照国家卫生健康委员会新冠肺炎诊疗方案的指导原则,遵照《2016中国心肺复苏专家共识》,汇集国内外新冠肺炎研究的最新成果,以COVID-19患者生命需求为导向,从临床解决CA这一急危重症问题出发,力求探索COVID-19相关CA发生发展的变化规律,改进美国心脏协会“从救到救”的生存链模式,让CPR贯穿于整个全CA周期生存环理念。从全CA周期考量,将COVID-19相关CA划分为前期、中期、后期,分别赋予预防原发高危因素、预防继发高危因素、预防诱发高危因素等“三预”方针,标准化、多元化、个体化等“三化”方法,复生、超生、延生等“三生”方略,并以此制定本共识[9-13]。
1 “三预”方针
COVID-19相关CA前期是指COVID-19患者未发生心搏、呼吸骤停前的时段。狭义上指发生CA前极短暂的先兆症状时间,往往只有数分钟至数小时。此处定义的COVID-19相关CA前期涵盖COVID-19患者真正出现CA前的整个时间过程,主要针对CA原发、继发及诱发高危因素采取的预防方针。临床上部分COVID-19死亡患者,若可早期识别和积极干预,常常可避免死亡,通常被称之为可预防性死亡[11,14]。目前COVID-19的治疗主要是支持、对症、抗病毒、氧疗和保护重要脏器等,在此基础上,强化“三预”方针是降低病死率的重要环节。
1.1COVID-19原发CA的预防 COVID-19原发CA是指SARS-CoV-2感染心血管组织器官,引起局限性或弥漫性的急性或慢性病变而直接出现的CA,多见于暴发性心肌炎(fulminant myocarditis,FM)、血栓、心肌梗死等,部分患者在急性期因严重心律失常、急性心力衰竭和心源性休克死亡。故积极干预COVID-19原发CA的高危因素,采取预识、预警、预防的防阻策略,有利于降低病死率。
1.1.1FM 主要特点为起病急骤、病情进展极其迅速,患者很快出现血流动力学异常(泵衰竭和循环衰竭)以及严重心律失常,并可伴有呼吸衰竭和肝、肾等多脏器衰竭,早期病死率极高[15]。既往研究发现,冠状病毒可诱发暴发性重症心肌炎[16]。与SARS-CoV一致,SARS-CoV-2的靶细胞受体亦为血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)[17]。除肺泡上皮细胞和小肠上皮细胞外,ACE2广泛表达于冠状动脉内皮细胞、成纤维细胞和心肌细胞等[18],与目前COVID-19患者存在呼吸道、消化道及心肌损伤症状的表现相吻合。COVID-19患者心脏和血管的病理学改变表现为心肌细胞变性、坏死,间质内可见少数单核淋巴细胞和(或)中性粒细胞浸润[19],提示心脏可能是SARS-CoV-2攻击的潜在靶器官之一。此外,病理学改变与心肌炎的临床表现严重程度并不呈对应关系,少数临床呈暴发性进程的心肌炎表现为心慌、胸痛、心功能不全等[20]。部分COVID-19重症患者经历细胞因子风暴,导致重症FM,造成患者短时间内死亡[21]。坚持“早发现、早报告、早诊断、早隔离、早治疗”的“五早”原则,尽快将COVID-19患者收治,及早氧疗,积极抗病毒、免疫调节治疗,防止患者向重症和危重症转化是根本,密切监测病情,以及对症、抗心律失常治疗等是早期发现急性事件并有效处理的关键[7,22]。
1.1.2血栓 SARS-CoV-2感染人体后引发免疫失衡导致细胞因子风暴综合征(CSS),进而出现凝血功能异常,表现为多器官和部位的血栓形成[23-24]。研究发现,除可能出现的静脉血栓栓塞症(vein thromboembolism,VTE)和肺血栓栓塞症(pulmonary thromboembolism,PTE)外,约50%的COVID-19患者疾病进展过程中伴随D-二聚体水平升高,在死亡患者中占比则高达100%[24]。重症患者D-二聚体水平明显高于轻症患者,且部分患者在治疗过程中病情突然恶化,甚至发生猝死,提示COVID-19患者尤其是重症患者血栓形成风险较高。《新型冠状病毒肺炎诊疗方案(试行第七版)》指出,新冠肺炎病理改变主要集中在肺部,肺泡隔血管充血、水肿,可见血管内透明血栓形成。此外,弥漫性微血管损害引起的MOF是导致危重患者死亡的重要原因。危重患者普遍存在凝血功能紊乱,超过80%的患者达到弥散性血管内凝血(disseminated intravascular coagulation,DIC)的标准,且多处于DIC高凝期。COVID-19合并的DIC属于脓毒症DIC(又称高凝型DIC),因微血管内广泛微血栓形成而导致微血管栓塞、休克、器官衰竭等,临床表现多样,容易误诊、漏诊。有研究发现,71.4%的死亡患者合并显性DIC,从入院到发现合并DIC的中位时间为4 d,而生存患者DIC发生率仅为0.6%[4]。可见,凝血紊乱甚至DIC是导致COVID-19重症患者死亡的重要原因,临床亟须重视,要做到早防、早治。此外,各种有创性治疗措施[如呼吸机、深静脉穿刺术、体外膜肺氧合(ECMO)等]本身容易诱发各种类型的血栓形成,提示重症和危重患者的早期抗凝治疗十分关键[25]。
1.1.3心肌梗死 COVID-19重症患者主要表现为低氧血症,危重患者多有凝血功能障碍,促进了血栓形成和急性心肌梗死(acute myocardial infarction,AMI)的发生。有研究发现,呼吸衰竭是COVID-19患者死亡的主要原因,AMI是次要原因[18]。肺炎合并心血管疾病可使病死率增高约60%。COVID-19患者中,部分出现血肌钙蛋白水平升高现象,提示存在心脏损伤,大部分(尤其是老年患者)合并基础心血管疾病,病毒性肺炎患者合并多种心血管并发症,如AMI、心律失常、心力衰竭等,均可能导致意外猝死。
肺部感染可增加冠状动脉斑块的不稳定性,炎症和发热增加外周组织和器官的氧需求,发热和炎症导致心率加快,使心室舒张期相对缩短,冠状动脉血流量减少,肺部炎症导致换气不足和肺通气灌注血流比值失调,氧饱和度下降,诱发急性冠脉事件。故COVID-19患者如存在心血管疾病,猝死的可能性明显增加[26],提示应监测COVID-19患者的心血管疾病及并发症,防止意外猝死。另有研究表明,约1/3的COVID-19患者可出现一过性左心功能下降,超过1/3的中老年COVID-19患者表现为外周阻力升高[7]。COVID-19导致的水钠平衡紊乱不仅影响肾脏功能,更重要的是影响心脏功能,故液体管理很重要,过快的不适当的补液会诱发急性左心衰竭,尤其是老年患者,易造成猝死发生。此外,灾难后各类次生事件可导致区域心肌梗死患者增多甚至死亡[4]。疫情期间,封闭式管理、医疗资源(医疗复诊和药物供给)相对不足,以及负面情绪和心理[3]可能导致基础心血管疾病病情加重,或突发急性心肌梗死,应当引起重视。
1.2COVID-19继发CA的预防 COVID-19继发CA是指SARS-CoV-2感染心血管组织器官,引发局限性或弥漫性的急性或慢性病变而间接出现的CA,多见于低氧血症、休克、肺栓塞、脑卒中等,部分患者在急性期因严重心律失常、急性心力衰竭和心源性休克而死亡。故积极干预COVID-19继发CA的高危因素,采取预识、预警、预防的防阻策略,有利于降低病死率。
1.2.1低氧血症 COVID-19主要引起肺损伤,发病初期所有患者均存在肺炎,约50%的患者会出现呼吸困难[7]。61.1%的ICU危重患者诊断为ARDS[3]。重症患者肺部影像学显示严重的肺部改变,双肺多发,后期实变。目前有限的尸体解剖和穿刺组织病理学观察结果显示,COVID-19患者肺脏呈不同程度的实变[19],肺组织内有大量浆液,气道内有大量黏液。肺部病变严重后,气道内大量痰栓形成。由于肺泡病理变化引起的气体交换功能受损,患者血氧饱和度(SaO2)急剧下降,因此危重患者的典型表现为低氧血症引起的气促、呼吸氧合不足及缺氧。缺氧进一步诱发炎性因子释放,加重细胞因子风暴。疫情初期大部分患者由于氧疗不及时或缺乏必要的呼吸支持,出现严重的低氧血症而死亡[27]。因此,充分氧疗和呼吸支持是重症患者抢救的核心,其次应该积极抗病毒和免疫调节治疗,防止向危重症进展,一旦肺部严重损害且并发多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),患者预后欠佳。此外,保持患者气道通畅,加强排痰和气道管理[28],避免呼吸支持治疗过程中各种意外事件(脱管、痰堵、呼吸机故障等)造成的低氧事件,是防止突发低氧血症所致CA的重要保证。
1.2.2休克 有资料显示,ICU危重患者休克占比高达30.6%[26]。危重患者无法进食导致的容量不足,感染引发的脓毒症和病毒性心肌损害,以及中晚期产生的DIC,均可能导致休克。因此,对危重患者必须积极扩容,并考虑综合措施稳定血流动力学。
1.2.3肺栓塞 COVID-19危重患者卧床时间较长,且合并凝血功能异常,须高度警惕VTE的风险[29]。临床发现,近20%的COVID-19患者出现凝血功能异常,几乎所有的重症和危重患者均存在凝血功能紊乱,部分患者在疾病进展过程中病情突然恶化,D-二聚体水平显著升高,甚至发生猝死,这可能与深静脉血栓脱落后发生PTE有关[30]。因此,对COVID-19危重患者应高度警惕PTE,对突然出现氧合恶化、呼吸窘迫、血压下降等临床表现者应及时确诊并给予相应治疗[31]。此外,D-二聚体是VTE监测最常用的指标。前期研究发现,COVID-19重症患者D-二聚体水平较轻症患者明显增高,提示D-二聚体可作为病情危重程度的重要参考指标[24-25]。
1.2.4脑卒中 COVID-19患者中,中老年人占多数,其中危重患者D-二聚体水平异常增高,较易发生栓塞性血管事件[28],且常同时合并脑血管病危险因素,部分患者可能会出现急性缺血性卒中[32]。COVID-19重症患者脑梗死发病率为4.5%,可能与重症患者合并基础疾病有关[33]。接诊表现为急性缺血性卒中的COVID-19患者后,应由神经科专科医师和感染科医师共同参与急诊救治,对于合并D-二聚体水平异常增高的脑血管疾病患者,卒中二级预防建议给予抗凝治疗[14]。因SARS-CoV-2与ACE2受体结合,部分合并高血压的COVID-19患者可能会出现血压异常升高,增加脑出血的发生风险。COVID-19危重患者常合并血小板重度减少,可能是易出现急性脑血管事件的高危因素[34]。
1.3COVID-19诱发CA的预防 COVID-19诱发CA是指SARS-CoV-2感染后,由于人体内外环境变化引发心血管内外组织器官出现局限性或弥漫性的急性或慢性病变而诱发的CA,多见于水电解质酸碱平衡紊乱、张力性气胸、药物毒性、心理应激等,部分患者在急性期因严重心律失常、急性心力衰竭和心源性休克而死亡。故积极干预COVID-19诱发CA的高危因素,采取预识、预警、预防的防阻策略,有利于降低病死率。
1.3.1水电解质酸碱平衡紊乱 部分COVID-19患者存在腹泻症状[4],使用抗病毒药物洛匹那韦/利托那韦后可出现腹泻,在疾病过程中出现的肠道微生态失调也会导致腹泻,此外,肾功能异常、大剂量糖皮质激素的使用,以及患者食欲不振、摄取减少,均会造成水电解质酸碱平衡紊乱。有研究表明,肺部感染是抗利尿激素分泌不当综合征、亚临床型肾上腺皮质功能不全的重要病因,可表现为水钠潴留或低钠血症,故部分COVID-19患者可出现低钾血症和低钠血症等电解质紊乱,严重时可造成脑水肿、心律失常及猝死,密切监测可避免这类并发症。患者长期进食不足加之呕吐、腹泻等消化道症状容易导致低钾血症,而缺氧、休克导致酸中毒又容易产生高血钾,特别是一旦肾功能损害,容易引起高钾血症。对危重患者应该密切监测血钾水平,及早纠正异常。COVID-19患者长期缺氧伴乏力导致严重的组织缺氧和二氧化碳潴留,可导致同时存在代谢性和呼吸性酸中毒,患者血气表现为pH值下降。危重患者并发休克和DIC会进一步加重组织缺氧及酸中毒[7]。积极改善通气氧合以及稳定患者血流动力学的同时,应密切监测患者血气分析结果,及时纠正酸中毒。
1.3.2张力性气胸 机械通气是COVID-19危重患者的主要治疗措施,虽然强调保护性通气策略,但ARDS本身和呼吸机气压伤容易导致气胸的发生,尤其合并慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的患者,应该高度警惕该并发症的可能[35]。呼吸机上机患者突然出现胸痛、病情加重、SaO2显著降低等应高度警惕张力性气胸的可能,可行床旁X线或超声确诊,及时处理。
1.3.3药物毒性 目前尚无治疗SARS-CoV-2感染的特效药物。当前推荐的抗病毒药物本身存在一定的毒副作用,联合应用可发生相互作用,引发严重的不良反应或事件。如氯喹是治疗疟疾的一线药物,可有效抑制SARS-CoV-2[36],其安全性高,但治疗窗较窄,容易引发心血管系统不良反应。使用氯喹治疗COVID-19患者时禁止使用喹诺酮类、大环内酯类等抗生素,以免QT间期延长,导致尖端扭转型室速。同时应确保患者体内电解质(钾、钠、氯)水平和血糖、肝肾功能正常。因此,联合应用抗新型冠状病毒治疗时应该密切监测患者的不良反应,尤其应定期复查心电图,监测QT间期,注意发现潜在的心律失常并及时处理,避免急性心血管事件突发[37]。药物过敏也是意外心搏骤停的原因之一。COVID-19的重要疗法——输注治愈患者恢复期血清可能会引起过敏,严重者出现CA;部分中药静脉注射液成分复杂,患者在输注过程中或输注后可出现CA;使用抗病毒药物,如抗艾滋病药物蛋白酶抑制剂瑞德西韦等,可造成CA;莫西沙星等喹喏类药物和大环内酯类药物可造成QT间期延长及尖端扭转型室速,使用前应查患者心电图,监测QT间期。其次,血液净化时滤器过敏可导致患者意外猝死[38]。有研究表明,在治疗过程中,约34%的COVID-19患者可能出现急性肾损伤,临床上应根据情况给予血液净化治疗;合并肝功能损害者,给予人工肝治疗;严重脓毒症患者,给予血液净化治疗以清除体内炎性因子,降低炎性因子水平,阻断细胞因子风暴,恢复炎性因子平衡,重建免疫平衡,加速患者康复,故血液净化疗法在COVID-19患者的治疗中应用较广泛[39]。目前市场上灌流器的吸附材料主要有三类:活性炭、树脂和树脂碳,可引起过敏,但容易被忽略,甚至造成意外猝死。因此对临床上进行血液净化的患者,若出现顽固性低血压,且用去甲肾上腺素效果不佳时,应考虑滤器过敏的可能,迅速改用肾上腺素输注,后者是唯一有特效的、静脉注射用的急性抗过敏药物,能迅速抑制肥大细胞释放过敏物质(如组胺等)。
1.3.4心理应激 现代医学已由生物医学模式向生物-心理-社会医学模式转换,人类的社会属性和社会角色决定了思想和心理的复杂性,语言、文字、社会环境、家庭以及附带的各种条件刺激的情绪均能对人体心脏、呼吸产生影响,乃至引发CA。随着COVID-19病死率逐渐增高,尤其部分患者的病情急转直下出现CA,应该警醒由心理失衡与情绪应激等精神性因素引发CA的可能。如情绪应激加重了原有的心肌结构异常、心电生理异常、血管形态异常改变,从而引起心碎综合征(broken heart syndrome)。针对本次疫情,应该防范COVID-19患者出现精神性CA,采取立体防治救策略,从而降低CA导致的病死率。部分COVID-19患者本身存在心理问题,隔离病房特殊的环境,缺乏交流的独居状态,以及疫情发展的有关信息,均会造成不同程度的心理应激[40]。心理应激不但可造成患者焦虑、抑郁情绪及自杀倾向,还可造成躯体性疾病,如应激性心肌病(章鱼壶心肌病)而导致死亡。部分合并心脏先天异常如早复极综合征、Brugada综合征等离子通道疾病的患者,以及合并胸腺淋巴体质、青壮年猝死综合征的患者,在心理应激作用下易发生猝死。在心理应激治疗过程中,使用抗抑郁药物(如百忧解等5羟色胺再摄取抑制剂)可导致患者出现自杀倾向,需引起注意。
2 “三化”方法
COVID-19相关CA中期是指对COVID-19患者心搏、呼吸骤停期间进行初级或高级生命支持的时段。根据COVID-19相关CA的规律及特点,因地制宜、因人而异地采用标准化、多元化和个体化并重的“三化”CPR方法[9],既要注意CPR实施者的个人防护,也要保证CPR的质量和效果,以最大限度提高抢救成功率和生存率。
2.1标准化方法
2.1.1标准防护与复苏实施原则 目前仍无研究报道为COVID-19患者实施CPR团队的风险,在SARS期间产生的一系列关于实施CPR团队的保护措施和流程值得借鉴[41]。患者隔离后,应该采取一系列措施确保复苏团队的安全,包括:CPR应在负压病房的隔离抢救单元实施,以防各种医疗操作产生气溶胶,若负压不足,需要保证通风顺畅。所有复苏团队成员必须穿戴适当的个人防护装备。由于心肺复苏时各种操作可能引起的高感染风险,有条件时,经过特殊训练的复苏团队应考虑使用正压医用防护头罩。在进入抢救区域前,复苏团队应实施标准的个人三级防护,且由感控监督员确认防护装备穿戴符合防护标准。在实施CPR的过程中,置入口咽通气道、胸外按压、电除颤、建立输液通路[静脉通路(IV)或骨通路(IO)]以及静脉给药不易产生气溶胶,均为低危操作;高流量鼻导管吸氧、球囊面罩通气、无创通气、气管插管或气管切开、气管镜以及胃肠内镜检查属于高危操作,应加强防护[42]。
为降低潜在的感染风险,复苏团队成员应尽量精简压缩,建议采取4人的复苏团队模式。将复苏抢救车带入抢救区域会给后续的装备、抢救车和物品消毒带来极大挑战,建议房间内准备可提供模块化物资空间的抢救车,复苏团队携带必要的除颤仪和抢救模块物资进入。复苏团队可在复苏后适当的时间撤离,但应在感控监督员的指导下顺序脱除个人防护装备,避免接触感染。
2.1.2气道管理与呼吸支持
2.1.2.1球囊面罩通气 气管插管前实施球囊面罩通气会产生气溶胶,插入喉镜后患者咳嗽会产生气溶胶和飞沫[43]。因此,在使用复苏囊时,必须在患者的面罩或气管插管与球囊间加装滤器。患者镇静不足或烦躁可能会导致抢救人员的个人防护装备移位或损坏,导致医护人员暴露。
2.1.2.2气管插管 为危重患者实施气管插管是造成医护人员感染的重要原因,患者病重本身传染性强,复苏和插管操作易产生气溶胶,医护人员的个人防护装备易被污染,三者相加极易造成潜在传染。因此,在实施插管和复苏操作时,应尽量在负压隔离环境下进行。必须确保个人防护装备适合防护空气或飞沫传播,达到个人卫生三级防护标准[44]。实施插管的人员必须技术熟练且采用快速诱导顺序气管插管技术,确保一次插管成功。有条件时,应使用可视喉镜协助插管,遇到困难插管建议使用可视纤维气管镜插管[45-46]。 插管完毕后,应用便捷、可靠的装备如呼气末二氧化碳监护仪确定气管插管位置正确,使用床旁X线或超声确定气管插管的位置和深度。人员和设备反复进出抢救房会增加传染风险,应确保所有装备在抢救房齐备可用,尽量只保留必要的抢救人员。
COVID-19患者在出现呼吸恶化时,应及早主动气管插管,尽量避免紧急插管。有条件时,重症和危重患者应当安置于有呼吸道传染病隔离条件和连续生命监测设备的重症监护单元内,便于及时发现患者病情变化,减少普通病房条件下医护人员进行患者评估的频次[47]。
2.1.2.3机械通气 插管成功后,应立即实施肺保护性通气策略(小潮气量6 ml/kg,平台压≤30 cmH2O,目标SaO288%~95%,pH≥7.25),所有呼出气体必须过滤。使用封闭式吸痰装置,患者插管与Y型管之间、Y型管与呼气支分别连接疏水性复合型热湿交换过滤器(HMEF),不建议常规更换呼吸机管路与HMEF[42]。对机械通气的COVID-19患者,应高度重视张力性气胸的可能,如上机患者突然出现通气恶化,考虑张力性气胸可能,应尽快行床旁X线或超声明确。
2.1.3胸外按压与电除颤
2.1.3.1胸外按压质量 在进行胸外按压时,各项技术指标仍按照当前标准执行[10]。但考虑到厚重的个人防护装备可能对复苏质量产生影响,建议使用带有心肺复苏质量反馈的装置指导胸外按压[48]。
2.1.3.2电除颤策略与安全 COVID-19危重患者多伴有缺氧、酸中毒、电解质紊乱等合并症,应注意纠正相关可逆因素,确保电除颤的成功率。注意患者抢救环境往往含有高浓度氧。部分患者使用氢氧混合气体治疗,应特别注意电除颤的安全。综合团队规模、操作风险、使用安全及器械消毒等因素,强烈推荐使用黏贴式电极片用于COVID-19患者CPR时的电除颤操作[49]。
2.1.4复苏药物 呼吸衰竭在COVID-19重症和危重患者中常见,因缺氧导致的CA,初始心律多为心室静止、电机械分离等不可电击心律,尽早应用肾上腺素等复苏药物对于恢复自主循环具有重要作用。目前推荐标准剂量肾上腺素1 mg,每3~5 min给药一次。对于COVID-19患者的复苏,应特别注意相关合并症,及时针对性地合理使用复苏药物。如氧合不足造成的严重酸中毒,注意合理使用碳酸氢钠,及时纠正电解质紊乱[50]。
2.2多元化方法 实施徒手CPR时,复苏团队需要付出足够的运动量和一定频次的位置交换以保证胸外按压质量[51]。大幅度的复苏动作可能会导致密封性破坏,大量运动以及防护服的高度气密性会导致施救者产生大量汗水,若湿透个人防护装备(口罩、帽子、眼罩、防护服等),会导致防护效能下降,增加施救者感染的风险[41,52]。尽管采用了足够级别的个人防护措施,目前尚无研究评价和证实其是否能够在CPR时为复苏团队成员提供可靠的安全性。因此,采用多元化方法实施CPR有助于解决心肺复苏质量与个人防护的矛盾问题。
2.2.1机械复苏(M-CPR) 自动化机械复苏装置能够提供持续的高质量按压,避免大幅度运动和频繁的位置交换,适合于在狭小和移动空间的CA患者复苏[53-54]。虽无充分证据支持,但专家仍建议在有条件时应将其作为COVID-19相关CA患者胸外按压的首选策略。尤其在同步实施体外心肺复苏(E-CPR)前期管路建立过程中,机械按压能够维持足够有效的复苏质量,为后续抢救赢得时间。应确保复苏团队正确使用复苏装置,尽量缩短按压中断时间。此外,选用的机械复苏装置应综合考虑使用的便捷性、后续的清洗消毒等问题。
2.2.2腹部提压心肺复苏(AACD-CPR) COVID-19相关CA患者多为有基础疾病的中老年人,传统的胸外按压方法易导致胸肋骨骨折(男、女性发生率分别为86%和91%),降低了CPR的成功率,此时应用AACDCPR[14,55],既可避免胸肋骨骨折以保证高质量人工循环的建立,又延伸了接触患者的距离以降低被感染率,且同时具有腹式呼吸的功能,可达到建立人工循环与呼吸并举的目的。
2.2.2.1开放气道(airway) 使用AACD-CPR为患者开放气道时,按压腹部使腹腔内压力上升致膈肌上移,在增大胸腔内压力的同时,使气道压力瞬间增大,迅速产生较高的呼出流速以排出气道和肺内潴留异物,产生海姆立克效应,帮助患者开通下呼吸道,配合清除口腔异物,畅通上下呼吸道[56]。
2.2.2.2人工呼吸(breathing) 使用AACD-CPR进行人工呼吸时,提拉与按压腹部促使膈肌上下移动,通过改变腹、胸腔内压力,促使肺部完成吸气与呼气动作,达到体外腹式呼吸效应,有利于协助患者建立人工呼吸支持,充分提供氧合。同时,AACD-CPR规避了过度通气,可为继发性CA患者(呼吸肌麻痹)提供体外腹式呼吸支持[57]。
2.2.2.3人工循环(circulation) 使用AACD-CPR进行人工循环时,胸腹联合提压进行复苏,提拉与按压腹部可驱使动静脉血液回流增加,尤其是增加腹主动脉压的同时,提高了冠脉灌注压约60%,增加了心排血量,可建立更有效的人工循环,配合胸外按压心肺复苏中的人工循环支持[58]。腹部操作对上身的穿刺、气管插管等其他相关操作影响较小,可充分提供血容量并提高协同配合的效率[59]。
2.2.2.4体外除颤(defibrillation) 使用AACD-CPR进行体外电除颤前不需停止按压,缩短了体外除颤时中断按压的时间,为复苏赢得了宝贵时间[60-62]。
鉴于COVID-19相关CA感染风险的特殊性,特制定COVID-19初级生命支持心肺复苏流程(图1)。
2.2.3E-CPR 相较传统的呼吸支持方式,应用ECMO救治的重症禽流感和MERS患者的生存率更高[63]。根据ARDS指南,建议对COVID-19患者及时行挽救性治疗[64]。因此,对于COVID-19危重患者,ECMO的介入时机应该更早,并非至CA时才考虑应用[65]。ECMO使用的时机主要包括两个方面[66]:(1)COVID-19合并严重心血管疾病,如心肌梗死、恶性心律失常、急性心力衰竭(心衰)及其他任何原因导致的心排量降低及氧合障碍的血流动力学支持,建议在做好自我防护的前提下,充分预案,一旦出现其他措施(如血管活性药物、主动脉球囊反搏等)不能缓解的心源性休克或者突发CA时,立即启动ECMO。(2)危重型 COVID-19出现严重呼吸衰竭或多器官受损阶段特别是合并重症心肌炎导致心肺功能衰竭需要呼吸及循环支持,具体指征包括:①氧合指数(PaO2/FiO2)<100 mmHg,或肺泡动脉氧分压差[P(A-a)O2]>600 mmHg;②通气频率>35次/min,血pH<7.2且平台压>30 cmH2O;③PaO2/FiO2<50 mmHg,超过3 h;④PaO2/FiO2<80 mmHg,且超过6 h;⑤pH<7.25,且PaCO2>60 mmHg,超过6 h;⑥严重漏气综合征;⑦合并心源性休克或CA[67]。研究发现,早期即PaO2/FiO2为100~150 mmHg时,应用ECMO治疗ARDS患者效果更好,可降低气道驱动压,减轻肺部及全身炎症,减轻肺及肺外器官损伤。ECMO实施的基本原则同前,具体操作要求、规范等可参考相关指南[65-67]。建议使用床旁超声、床旁检测(POCT)设备等加强对患者的血管评估、出凝血功能监测,加强患者管理。建议首选VV-ECMO模式,但与H1N1和MERS相同,存在引起病毒性心肌炎的可能;提供循环支持的VA-ECMO模式可用于心脏损伤患者[67]。
2.3个体化方法
2.3.1老年患者 老年患者身体基础条件相对较弱,免疫力低下,常伴有多种慢性疾病,是COVID-19预后不良的主要群体[68]。据统计,COVID-19粗病死率为2.3%,而老年患者病死率较高,>70岁者超过8%,>80岁者为14.8%。有基础疾病的患者死亡风险显著增加,死亡病例中合并心血管疾病者占10.5%,糖尿病占7.3%,慢性呼吸系统疾病占6.3%,高血压占6.0%,肿瘤占5.6%。危重病例的粗病死率为49%[7]。不同慢性疾病患者到达进入ICU、需要有创通气和死亡等复合终点的风险不一致,相较于正常人群,肿瘤患者风险最高,风险比(HR)为3.5,COPD为2.68,糖尿病为1.59,高血压为1.58;患有一种慢性病为1.79,两种或以上为2.59。因此,合并基础疾病如心血管疾病、糖尿病、慢性呼吸道疾病、高血压和肿瘤等的高龄患者出现重症和死亡的风险较高。目前最有效的救治方式为对老年患者及早诊断,积极治疗,防止患者从轻症向重症或危重症转化。对老年患者实施胸外按压时更容易出现胸肋骨骨折等并发症,为保证高质量,可选择AACD-CPR。
2.3.2急进患者 部分COVID-19急进患者病情恶化迅速,极易出现CA,病死率较高[4]。急进患者发病至诊断时间较长(平均为9 d),从发病至死亡的平均时间为9.5 d[26]。最新研究发现,COVID-19患者部分实验室检查结果与预后发展具有相关性,是判断成人患者为重型、危重型的临床预警指标,具体包括:外周淋巴细胞进行性下降;外周血炎性因子如IL-6、C反应蛋白(CRP)进行性上升;乳酸进行性升高;肺内病变短期内迅速进展[7]。因此,对于入院时即为重症或危重症且实验室多项检测指标异常的患者,应考虑为急进患者,需要加强监护治疗,随时做好复苏准备。
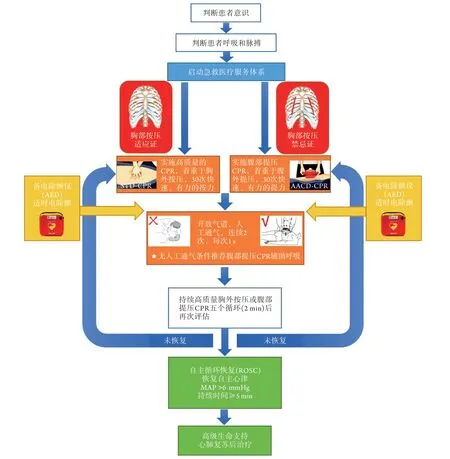
图1 COVID-19初级生命支持心肺复苏流程Fig.1 COVID-19 primary life support cardiopulmonary resuscitation process
2.3.3医务人员 截至目前,全国有超过3000名医务人员被确诊为COVID-19,虽然病死率不高,仅占死亡病例的0.3%[7],但同样应引起高度重视。确诊的医务人员中,部分为疫情早期防护不及时以及大量患者集中医院造成的院内感染,部分为家庭聚集性感染。因此,医疗机构和医务人员应该高度重视职业防护,并采取措施避免家庭聚集性感染。疫情期间应严密监测医务人员的体温和临床症状,及早诊断并隔离治疗[26]。 在战“疫”一线的工作人员,因时刻处于高度应激状态,加之高强度的工作,极易产生心源性CA。近来有报道医务人员由于长时间穿戴个人防护装备进行高强度工作,产生低血钾及休克,诱发CA,应引起医疗机构和医务人员自身的高度重视。在加强防护物资供应保障的基础上,严格限制一线医务人员的工作强度和时间,保证医务人员充分的休息、营养和心理健康,加强保护性措施和制度的建立刻不容缓。
2.3.4疫情防控人员 新冠肺炎疫情期间,为做好相关防控工作,广大公安干警、公务员、社区工作人员、志愿者等群体加班加点,冒着被感染的风险义无反顾地投身战“疫”一线。在高度应激状态下,高强度工作加之疑似感染,导致部分人员发生猝死,虽无明确的流行病学证据,但值得关注和警惕。应该指导相关工作人员注意个人预防措施,合理安排工作和休息,避免不良事件的发生。
3 “三生”方略
COVID-19相关CA后期是指COVID-19患者经过初级或高级生命支持及自主循环恢复(return of spontaneous circulation,ROSC)或复苏终止后的时段。从COVID-19相关CA患者病理、心理、伦理的全生命周期考量,实施复生、超生及延生的“三生”方略,可以使其获得最佳转归。
3.1复生方略 ROSC后的首要目标为稳定血流动力学、优化生命参数及解除CA病因和诱因,称之为“复生”[9]。由于复苏后综合征(PRS)和原发病诊治困难等因素,中国院外心脏骤停(out-of-hospital cardiac arrest,OHCA)患者的出院存活率约为1%。CA复苏后治疗涉及重症医学、神经科学、心血管医学和康复医学等多个专业,对CA患者的预后至关重要,因此CA患者ROSC后应尽快转入ICU进行综合治疗。复生阶段的评估和处理应围绕ABCDE原则进行。
3.1.1ROSC的判断 呼吸末二氧化碳浓度(CETCO2)或呼吸末二氧化碳分压(PETCO2)被认为是除体温、脉搏、呼吸、血压、血氧之外的第6个基本生命体征,可用于判断ROSC是否恢复。目前使用较多的是PETCO2,一般ROSC后的CA患者平均PETCO2>25 mmHg,PETCO2<14 mmHg的CA患者无存活;2013年美国心脏协会(American Heart Association,AHA)在提高CPR质量专家共识中建议,无过度通气下将PETCO2>20 mmHg作为CPR的目标;2015年建议将PETCO2<10 mmHg作为CPR 20 min插管患者终止CPR的指标之一。COVID-19逝者尸解证实损伤的主要是呼吸系统[7],导致CPR的基础以低氧血症为主。ROSC后需要依据ABCDE原则进行评估,包括气道(airway,A)、呼吸(breath,B)、循环(circulation,C)、诊断和鉴别诊断(differential diagnosis,D)及评估(evaluation,E),应重点评估患者在血流动力学不稳定甚至因CA出现一过性血供中断后重要器官的受损程度。
3.1.2气道管理(airway,A) 良好的气道治疗管理对提高呼吸支持效率,减轻多器官损伤、感染播散等并发症,促进康复具有重要意义[69]。建议使用密闭式吸痰管进行痰液引流。如需使用纤维支气管镜,可选用三通接头,以避免操作中断开呼吸机回路,并有利于检查、药物清洗、去除局部的炎性分泌物堵塞等;引流或吸引声门下气道内分泌物,应在持续负压状态下进行,维持气囊内压力25~30 cmH2O,避免频繁接触气囊上的分泌物等;如需雾化吸入治疗,可以选择一次性筛孔雾化器或单人用定量气雾吸入剂装置以保证稳定的氧气供应[70]。
3.1.3呼吸氧合(breathing,B) 复苏后常规机械通气无法维持有效氧合,应采用有创正压通气(IPPV),可应用以小潮气量通气+一定水平呼气末正压(PEEP)为标志的肺保护性通气策略[71]。不建议常规进行肺复张,若需要肺复张,建议进行跨肺压滴定动态监测或呼气末二氧化碳分压动态监测。如无食道压监测条件,可在动态评估平台压(Pplat)≤30 cmH2O和驱动压(Pplat-PEEP)<15 cmH2O时设置呼吸机参数,兼顾氧合和呼吸机相关肺损伤之间的平衡。如IPPV效果不佳,患者氧合指数<100且PEEP>10 cmH2O,可考虑进行俯卧位通气,建议每天俯卧位通气时间>12 h[72]。如能结合电阻抗(electrical impedance tomography,EIT)技术动态评估肺的实时通气情况,个体化呼吸支持会更为合理和有效。如上述呼吸支持策略仍无法有效提升动脉血氧分压,应考虑尽早实施ECMO治疗。
3.1.4循环支持(circulation,C) ROSC后应严密监测患者的生命体征和心电图等,优化患者的器官和组织灌注,尤其是维持血流动力学稳定。主要处理措施包括:①连续监测患者血压,建议维持复苏后收缩压≥90 mmHg,平均动脉压(MAP)≥65 mmHg。②对血压值低于上述目标值、存在休克表现的患者,应积极通过静脉或骨通路给予容量复苏,同时根据患者心功能情况确定补液量,及时纠正酸中毒。若容量复苏效果不佳,应考虑选择合适的血管活性药物,维持目标血压。③连续监测患者心率及心律,积极处理影响血流动力学稳定的心律失常。④出现严重泵功能衰竭无法维持有效灌注时,可考虑实施机械辅助循环支持,如主动脉球囊反搏(IABP)/经皮心肺辅助法(PCPS)等,或及早采用ECMO体外循环支持[67]。⑤不推荐床边复杂的有创血流动力学监测。有条件时,可采用超声多普勒监测等无创、便捷的手段,以正确处理不同类型的休克,利于合理选用血管收缩药物[30]。
3.1.5鉴别诊断(differential diagnosis,D) 复苏成功后,应尽快完善患者的临床资料,进行必要的实验室和辅助检查。有条件时,可尽快完成相关影像学检查和评价,尽快明确诊断,尤其注意鉴别是否存在诱发CA的5H和5T可逆病因,并对CA的病因和诱因进行积极治疗和处理。其中5H指低血容量(hypovolemia)、缺氧(hypoxia)、酸中毒(hydrogen ion)、低钾血症/高钾血症(hypokalemia/hyperkalemia)和低体温(hypothermia),5T指张力性气胸(tension pneumothorax)、心包填塞(tamponade,cardiac)、中毒(toxins)、肺栓塞(thrombosis,pulmonary)和冠状动脉血栓形成(thrombosis,coronary)。
3.2超生方略 从生命体征平稳的“复生”阶段到器官功能恢复的“超级生命支持”的“超生”阶段[9],CA患者复苏后脑损伤、心功能障碍、全身缺血/再灌注损伤(多器官功能损伤)及原发病的严重程度与其预后密切相关,积极处理复苏后器官功能障碍和原发病可提高CA患者的出院存活率以及减轻神经系统后遗症,因此超级生命支持对CA患者的最终预后至关重要。对于COVID-19相关CA复苏后患者,应注意以下内容。
3.2.1细胞因子风暴综合征(CSS)
3.2.1.1发病机制 CSS是指机体免疫系统被某些因素异常激活,产生大量炎性介质,致机体出现全身炎症反应综合征(SIRS)、MOF和高铁蛋白血症等[73]。SARS-CoV-2侵入机体时可异常激活多种免疫细胞,释放大量细胞因子,其中炎性细胞因子可趋化更多免疫细胞形成正反馈循环,当体内的细胞因子到达某一阈值即可引起细胞因子风暴[74],产生一系列器官功能损害,患者轻则表现为发热、头痛、乏力等,重则出现DIC、休克、MOF甚至死亡[75]。COVID-19患者病情由轻向重的转变可能由细胞因子风暴所致。T淋巴细胞及单核细胞释放IL-6和粒-巨噬系集落刺激因子(GM-CSF)可能是SARS-CoV-2诱发细胞因子风暴的关键环节[76], 而单核细胞是非特异性免疫细胞,提示SARS-CoV-2引发细胞因子风暴的机制可能与机体特异性和非特异性免疫平衡被破坏密切相关。在抵抗病毒感染的过程中,特异性和非特异性免疫反应相互影响、密切配合产生免疫保护作用。但特异性免疫反应是完成病毒清除的关键因素,COVID-19重症患者多为有基础疾病的高龄患者,因机体免疫功能退化,无法完成或需要长时间才能诱导出有效的特异性免疫反应。因此,感染后较长时间内只能依靠不断加强的非特异性炎症反应来抵抗病毒侵袭和扩散,导致引发细胞因子风暴的风险增加,重症出现早、病死率高[77]。COVID-19患者CA后的缺血再灌注损伤亦是CSS的重要诱发因素。因此,有效控制CSS是早期救治和复苏后超生治疗中的重要策略。
3.2.1.2免疫治疗 提高特异性免疫反应的主要方法是疫苗和回输治愈者血浆。由于研发周期限制,目前尚无批准用于SARS-CoV-2或任何冠状病毒的疫苗。直接输注含SARS-CoV-2特异性抗体的治愈者血浆可获得人工被动免疫。《新型冠状病毒肺炎诊疗方案》已将该疗法列入重症、危重患者诊疗方案,但因恢复期血浆的获取存在一定困难,且该方法疗效可能与提取的血清中中和抗体的滴度高低有关,临床应用受到一定限制[7]。此外,托珠单克隆抗体(Tocilizumab)是一种IL-6拮抗剂,可抑制免疫系统功能,主要用于自身免疫性疾病,已有研究证实其对感染引起的细胞因子风暴有治疗作用[78],目前正在积极探索将其应用于临床。糖皮质激素在SARS的临床救治中被证实有效[79]。有研究报道,中低剂量糖皮质激素治疗COVID-19重症和危重患者具有潜在益处[80],但临床应用仍存争议,推荐谨慎应用于重症和危重患者[81]。
3.2.2连续性肾脏替代治疗(continuous renal replacement theraphy,CRRT) 除肺之外,肾脏也是COVID-19患者常被累及的器官之一,尤其重症患者更易出现肾脏损伤。ICU重症及危重症COVID-19患者需行CRRT的比例为5.6%~23.0%。CRRT主要应用于合并符合KDIGO标准2级及以上的急性肾损伤(AKI)患者,模式以连续性静-静脉血液滤过(CVVH)或连续性静-静脉血液透析滤过(CVVHDF)为主[39]。但鉴于细胞因子风暴是引起COVID-19患者器官受损的主要因素,应强调全方位血液净化在COVID-19治疗中的作用。对于未合并AKI的COVID-19重症患者,当出现严重的细胞因子风暴及MODS时,应尽早行CRRT。当以清除炎性介质为目的时,建议优先选择具有吸附性能的滤器,如AN69ST膜、oXiris膜均对细胞因子具有吸附能力;亦可选择高截留分子量滤器(膜孔径达8~10 nm,约为普通高通量膜孔径的2~3倍),但需注意的是,高截留分子量滤器会增加白蛋白等大分子的清除,应注意监测,及时予以补充。对于合并脓毒症、ARDS的COVID-19重症患者,常规药物疗效不佳,应考虑新的体外脏器支持疗法,如血浆置换、血液/血浆灌流或吸附、ECMO等[82]。
3.2.3营养支持 营养治疗为基础治疗手段,是新冠肺炎患者综合治疗措施的核心内容之一。营养治疗应该基于营养诊断[83-84],按照五阶梯方法实施,即膳食+营养教育、口服营养补充(ONS)、管饲、补充性肠外营养(SPN)及全胃肠外营养(TPN)。根据疾病危重程度不同,推荐按84~126 J/(kg·d)供给(1 kcal=4.1868 J)。因患者蛋白质需求增加,推荐按1.0~2.0 g/(kg·d)供给,增加支链氨基酸(BCAA)供给量。优先使用中长链脂肪酸,提高N-3脂肪酸、N-9脂肪酸比例。糖/脂比为(50~70)/(50~30);非蛋白热卡/氮比为(100~150)/1。常规补充多种维生素、矿物质。
3.3延生方略 生命危急时,经过积极救治未成功,或经过一系列生命支持也无生还可能而注定即将死亡,在死亡之后适当时间内将尚有足够活力的器官(心脏)“嫁接到”其他人的身上,则死亡者的生命将会借助别人的身体得到不同程度的延续,即器官捐献与器官移植,亦可称之为生命接力,可谓CA后期“延生”的内涵[9]。对于COVID-19相关CA患者,通过自身血浆抗体捐献、干细胞移植,以及他人为其捐献的心肺器官,丰厚拓展了“延生”的内涵。
3.3.1恢复期血浆捐献 恢复期血浆治疗在重症禽流感患者中被证实是一种有效、及时和广泛可用的治疗方法[85]。研究表明,恢复期血浆治疗可降低患者呼吸道病毒载量,减轻细胞因子反应,降低病死率。2015年一篇纳入32个有关恢复期血浆治疗SARS或流感研究的Meta分析结果显示,恢复期血浆可能降低病死率并且是安全的[86]。但有研究发现,恢复期血浆治疗效果不佳,可能与免疫血浆内的抗体滴度有关[87]。尽管仍存在部分争议,但在目前尚无绝对安全的特效抗病毒药物的情况下,COVID-19治愈患者的恢复期血浆可作为危重患者抗病毒治疗安全、有效的策略[38],目前亦是我国危重患者救治的推荐方案[7]。因此,对于COVID-19相关CA后治愈患者,通过捐献血浆用于其他危重患者的救治,既是生命大爱的表现,也是“延生”的发展。
恢复期血浆供者需满足的条件:①患者已经彻底康复,经分子生物学技术检测证明无病毒残留;②康复者身体条件符合采浆标准,经严格检测后证实体内乙肝表面抗原、丙肝抗体、艾滋病抗体、梅毒螺旋体抗体阴性;③康复供者需签署知情同意书并自愿捐献血浆;④供者体内应该有足够高的抗体滴度,有条件的机构可以进行抗体效价测定或富集以制备出更加有效的免疫血清制品[88]。
3.3.2干细胞移植研发 研究表明,COVID-19重症患者外周血CD4+和CD8+T细胞的数量常显著减少。部分患者免疫异常激活,出现CSS,是导致肺脏等器官严重损害和死亡的重要原因之一。积极研发干细胞移植,适时抑制过激免疫反应,保护肺泡功能,减轻COVID-19患者肺脏和全身脏器损伤,是由器官移植向细胞移植的重大进步。干细胞可从骨髓、脐带和子宫内膜等组织分离或从人胚干细胞分化获得,能与靶细胞直接接触或通过分泌细胞因子发挥调控效应,抑制T细胞活化增殖、NK细胞杀伤功能及促进调节性T细胞增殖等,发挥免疫调节和抗炎功能。目前的临床研究初步显示,部分干细胞产品和技术在治疗COVID-19中表现出一定的疗效,可在一定程度上提升COVID-19重症救治水平,降低病死率。
3.3.3规范尸体解剖 尸体检验对于阐明COVID-19的病理变化、致病机制和死亡原因具有重要意义,可为更加科学精准地防控肺炎疫情提供理论依据[89]。COVID-19是新发急性传染性疾病,由于一直缺乏系统尸体解剖提供的完整病理学资料,对其发病机制、器官损害等无法进行确切判断,不利于临床开展针对性治疗和相关研究,也无法对一线法医开展相关尸体解剖工作提供有价值的指导[90]。因此,有条件和资质的医疗机构应该在相关指南的指导下开展COVID-19死亡病例的尸体解剖工作,为该病的研究提供科学的依据。医务人员应劝说患者家属同意开展相关工作,鼓励通过尸体解剖为医学科学发展做出贡献。省级以上卫生健康行政部门指定的检验机构在尸体检验前应按照国家相关法律法规进行委托和受理工作,包括与委托方签订委托协议,告知死者家属,由家属签署知情同意书等。尸体解剖应由具有相关资质的人员在充分防护的基础上,在符合生物安全规范的场地按照法医学尸体解剖的一般操作规程和相关行业检验规范、标准进行全面、系统的解剖检验,解剖完毕后应安全、规范地处理后续工作[91]。
在人类与传染病的斗争史中,COVID-19相关CA已成为威胁生命健康的元凶,在面临疫情全球暴发及新型冠状病毒变异的今天,与这一元凶博弈、与生命赛跑将是一场长期的持久战。在抗击肺炎疫情的决战时刻,中国心肺复苏专家集智攻关制定本共识,筑起防、治、救COVID-19相关CA“心”长城。本共识着重强调COVID-19相关CA前期预防原发、继发、诱发高危因素的“三预”方针,贯穿了COVID-19相关CA CPR系统观这一主线;着重把握COVID-19相关CA中期的标准化、多元化、个体化的“三化”方法,铸造了COVID-19相关CA CPR整体观这一主体;着重关注COVID-19相关CA后期的复生、超生、延生的“三生”方略(图2),凸显了COVID-19相关CA CPR发展观这一主题,全方位、全过程、立体地诠释了中国特色CPR方案的内涵与外延[92]。本共识代表了战“疫”前方、后方CPR学者及相关研究团队的学术观点,对于最大限度降低COVID-19病死率,乃至今后对传染性疾病相关CA的理论研究与临床实践具有现实与长远指导意义。
共同执笔:王立祥,孟庆义,余涛,方邦江,魏捷,路晓光,宋维,张思森,姜笃银,米玉红,张玉想,菅向东,周飞虎,刘亚华
共同主审:岳茂兴,刘中民,王贵强,吕传柱,祝益民,鲁翔,刘亮,李维勤,张文宏,宋青,黄子通,俞森洋,程显声,王一镗
专家组成员(按姓氏笔划排序):
王一镗,王立祥,王仲,王贵强,王洪武,王晓梅,王韬,韦思尊,毛富吉,公保才旦,方邦江,史继学,吕传柱,吕军,刘中民,刘亚华,刘亮,刘海波,闫丙川,米玉红,孙飞,孙延庆,孙国刚,孙勇,阳世雄,苏红,苏红,杜俊凯,李奇林,李欣,李桂花,李海山,李银平,李维勤,李雄文,李新宇,李静,李樱,李磊,杨秀林,杨思进,杨蓉佳,杨静,吴志强,吴利东,邱泽武,何小军,何忠杰,何春来,余涛,汪茜,沈密,宋青,宋祖军,宋维,张天一,张文宏,张文武,张玉想,张西京,张页,张红(山西),张红(北京),张志鸿,张利远,张玮,张国秀,张玲,张思森,张重阳,张瑛琪,张斌,张黎明,陈玉国,陈建荣,陈秋霞,范西真,范晨芳,季之欣,岳茂兴,周飞虎,周满红,郑江,郑晓峰,单志刚,宗建平,屈继富,孟庆义,赵龙现,郝义彬,俞森洋,姜笃银,姜素文,祝益民,姚尚龙,姚咏明,钱传云,徐自强,郭树彬,唐艳,黄子通,菅向东,崔明武,梁群,蒋龙元,韩小彤,韩文斌,程显声,鲁翔,曾红,曾富荣,路晓光,裴俏,暴继敏,薛平,魏捷
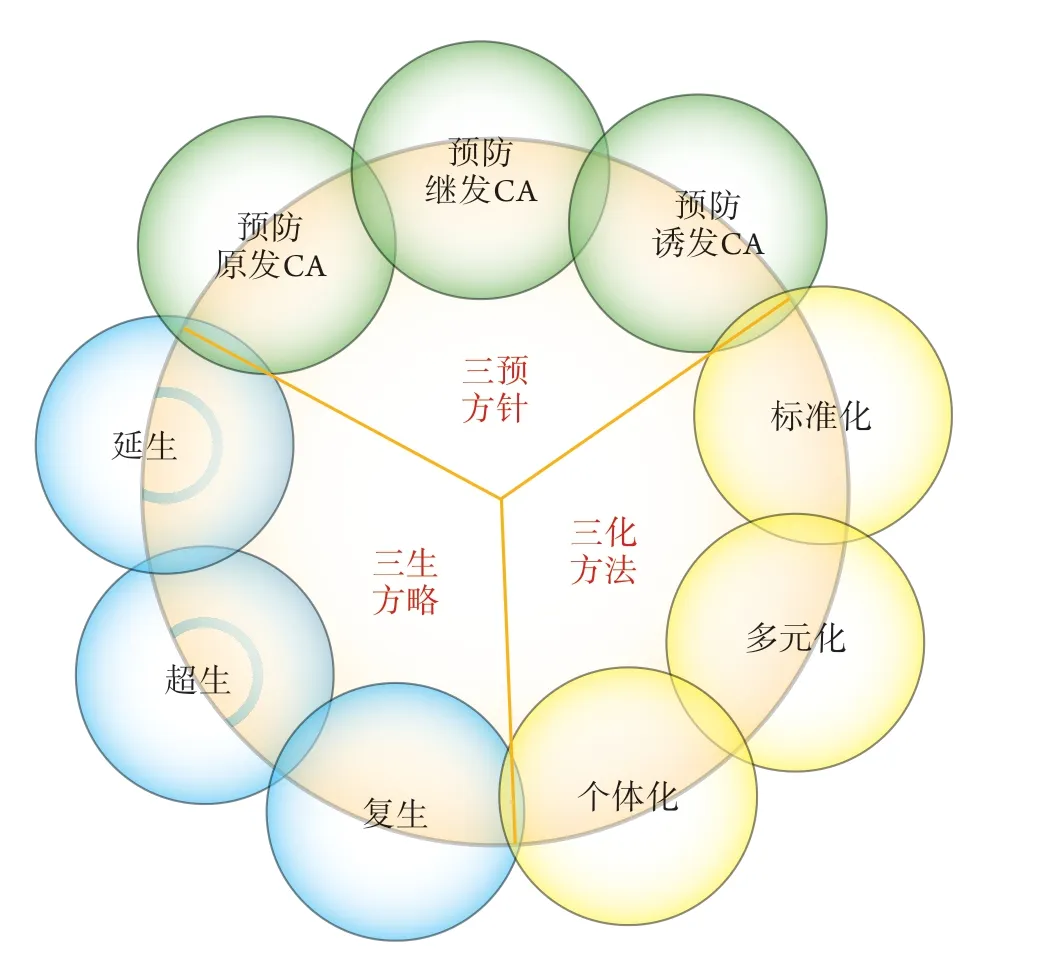
图2 COVID-19相关CA CPR生存环Fig.2 Survival of COVID-19 related CA cardiopulmonary resuscitation
