新型冠状病毒肺炎重症患者相关凝血功能障碍诊疗专家共识
2020-06-24宋景春王岗张伟张洋李维勤周洲全军重症医学专业委员会中国研究型医院学会血栓与止血专业委员会
宋景春,王岗,张伟,张洋,李维勤,周洲*,全军重症医学专业委员会,中国研究型医院学会血栓与止血专业委员会
1解放军联勤保障部队第908医院重症医学科,南昌 330002;2西安交通大学第二附属医院重症医学科,西安 710001;3解放军联勤保障部队第900医院急诊科,福州 350000;4北京协和医科大学中国医学科学院附属阜外医院检验科,北京 100037;5解放军东部战区总医院重症医学科,南京 210002
2019年12月,新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)在全球暴发流行[1]。2020年2月11日,国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)冠状病毒研究小组(Coronavirus Study Group,CSG)将引起COVID-19流行的新型冠状病毒正式命名为“SARS-CoV-2(severe acute respiratory syndrome coronavirus 2)”[2]。截至4月5日,全球累计确诊病例1 267 174例,累计死亡病例68 971例,病死率约为5.44%[3]。凝血功能障碍是重症COVID-19患者死亡的重要原因之一[4]。已有研究显示,71%的死亡患者达到国际血栓止血学会(International Society on Thrombosis and Haemostasis,ISTH)的弥散性血管内凝血(disseminated intravascular coagulation,DIC)诊断标准[5]。因此,全军重症医学专业委员会与中国研究型医院学会血栓与止血专业委员会组织在武汉抗疫一线的专家成立共识编写委员会,共同制定本共识。本共识包括COVID-19相关凝血功能障碍的概述、凝血功能评估、抗凝治疗、替代治疗、支持治疗和预防6个部分,共18条推荐意见,以便指导临床工作。
1 概 述
推荐意见1重症COVID-19相关凝血功能障碍的病理学依据。
SARS-CoV-2(属于β属的冠状病毒)和严重急性呼吸综合征冠状病毒(SARS-CoV)均通过S蛋白结合人体细胞表面的血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)蛋白侵入人体细胞[6]。但SARS-CoV-2的S蛋白三聚体更易与ACE2蛋白结合,亲和力是SARS病毒的10~20倍[7]。ACE2主要分布于心脏、肺、肾脏、睾丸和消化道[8]。病理学上,SARS-CoV分布在肺泡Ⅱ型上皮细胞、单核细胞、消化道上皮细胞、肾远曲小管上皮细胞、皮肤汗腺细胞、甲状旁腺及脑垂体嗜酸性细胞、肾上腺皮质细胞、胃壁细胞、胰腺腺泡细胞和气管浆液腺细胞。与SARS-CoV不同,SARS-CoV-2主要分布在肺部的肺泡Ⅱ型上皮细胞、巨噬细胞,还可在肺门淋巴结、脾脏和睾丸组织中分布[9]。SARS-CoV-2与SARS-CoV均可导致炎性因子大量释放,形成全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),引起肺、肝、心、肾、肾上腺等实质器官细胞坏死,最终导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[10]。 在全身器官发生炎症反应的同时,微血管系统受到损害,导致凝血系统异常活化,从而在病理学上表现为全身性小血管炎和广泛的微血栓形成[9,11]。既往研究显示,尿激酶通路异常可引起SARS-CoV诱发的肺损伤加重[12],提示SARS-CoV-2与凝血、纤溶系统的相互作用还存在更为复杂的分子机制,需要进一步深入研究。
2 凝血功能评估
推荐意见2应充分了解重症COVID-19患者的既往病史,准确评估患者的凝血功能。
中国疾控中心对我国内地报告的72 314例COVID-19病例进行流行病学分析发现,大多数COVID-19死亡患者≥60岁且合并基础疾病,如高血压、冠心病和糖尿病等[13]。因此,已有诊疗共识将年龄≥65岁或合并严重慢性基础疾病(如高血压、糖尿病、冠心病、恶性肿瘤、结构性肺病、肺心病及免疫抑制)的COVID-19患者纳入重症标准[14]。COVID-19患者合并基础疾病会诱发或加重凝血功能障碍,应充分了解重症COVID-19患者的既往病史(表1)。

表1 可能导致凝血功能紊乱的基础疾病Tab.1 Basic diseases that may cause coagulation disorders
推荐意见3推荐采用常规凝血指标对重症COVID-19患者的凝血功能进行筛查。
常规凝血功能筛查指标包括:①外源性凝血系统状态评估。常用指标为凝血酶原时间(prothrombin time,PT)或国际标准化比值(international standardized ratio,INR)。PT或INR延长提示外源性凝血系统的凝血因子存在数量或质量异常,或血中存在抗凝物质。②内源性凝血系统状态评估。常用指标为活化部分凝血活酶时间(activated partial thromboplastin time,APTT)。APTT延长提示内源性凝血系统的凝血因子存在数量或质量异常,或血中存在抗凝物质;APTT缩短提示血液呈高凝状态。APTT可用于肝素剂量的监测。③凝血共同途径状态评估。常用指标为凝血酶时间(thrombin time,TT)和纤维蛋白原(fibrinogen,FIB)。TT延长而FIB水平正常,提示血中存在抗凝物质;TT延长且FIB水平降低,提示低纤维蛋白原血症。④纤溶系统功能评估。常用指标为D-二聚体(D-dimer,DD)和纤维蛋白降解产物(fibrin degradation products,FDP)。DD、FDP水平均升高,提示存在纤溶系统活动。⑤血小板计数。血小板数量减少,提示患者出血风险增加;血小板数量增多,提示血小板易于发生黏附、聚集和释放反应,形成血小板血栓的风险增加。
武汉金银潭医院对99例COVID-19患者进行回顾性分析发现,DD水平升高者占36%,APTT缩短者占16%、延长者占6%,PT缩短者占30%、延长者占5%[15]。本编写组专家唐宁教授等[5]对183例COVID-19患者的常规凝血指标进行回顾性分析发现,死亡患者入院时的血浆FDP和DD水平均显著高于生存患者,PT和APTT均显著长于生存患者。中南医院彭志勇教授等[16]对138例COVID-19患者进行回顾性分析,同样证实死亡患者在入院时已出现DD水平增高。已有研究发现,DD水平升高是COVID-19患者发展成急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和进展到死亡的独立危险因素[4]。
推荐意见4推荐采用ISTH/CDCC DIC评分法诊断COVID-19相关凝血功能障碍。
DIC是不同病因导致局部损害而出现以血管内凝血为特征的一种继发性综合征,是凝血功能衰竭的表现,也是发展成为多器官衰竭(multiple organ failure,MOF)的中间环节。唐宁教授等[5]对183例COVID-19患者进行回顾性分析发现,高达74.1%的死亡患者和0.6%的生存患者发生了DIC。目前DIC的诊断主要依据2001年ISTH的科学标准委员会(the Scientific and Standardization Committee,SSC)诊断标准。该DIC诊断积分系统主要采用PT、血小板(platelet,PLT)、FIB和DD指标进行积分:积分≥5分即可诊断为显性DIC;<5分为非显性DIC,需要继续每日评估[17](表2)。2017年中华医学会血液学分会血栓与止血学组推荐中国DIC诊断积分系统(Chinese DIC scoring system,CDSS),主要将原发病纳入积分系统并修改相关指标诊断界值,同样对DIC具有较好的诊断和预后判断价值[18-19]。
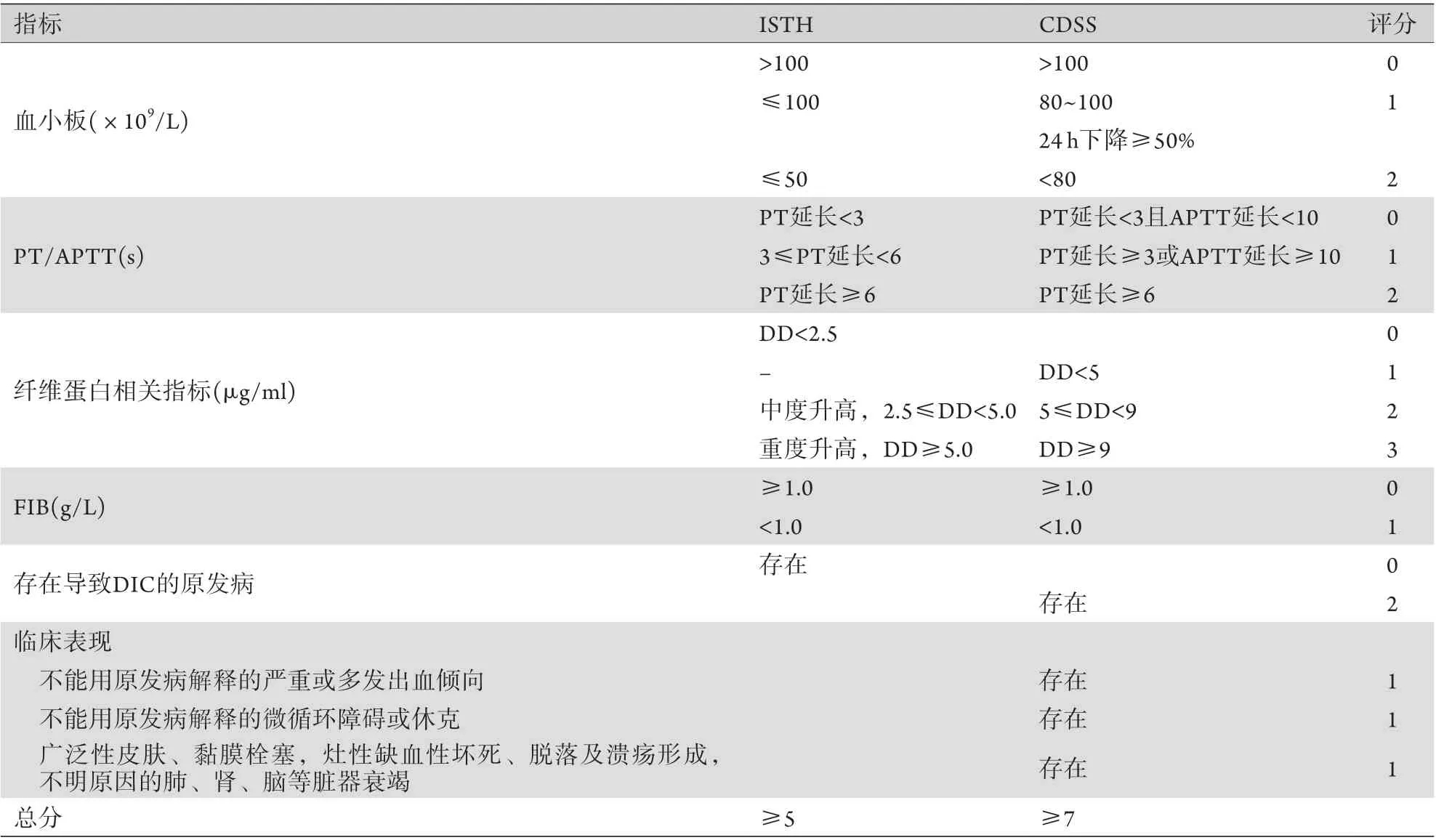
表2 DIC诊断标准Tab.2 Diagnostic criteria for DIC
推荐意见5已明确合并凝血功能障碍的重症COVID-19患者,推荐应用黏弹力凝血实验评估凝血功能。
黏弹力凝血实验以全血为检测标本,能够全面准确地反映凝血功能障碍患者的凝血状态[20]。因此,推荐应用其评估重症COVID-19患者的凝血功能。黏弹力凝血实验主要包括血栓弹力图(thromboelastograph,TEG)和凝血与血小板功能分析仪。TEG检测参数R时间代表凝血因子活性,α角、k时间代表FIB功能,MA代表血小板功能,LY30%代表纤溶功能。凝血与血小板功能分析仪检测参数ACT代表凝血因子功能,CR代表FIB功能,PF代表血小板功能。两者均能准确评估患者的整体凝血状态,对重症患者的凝血因子、FIB和血小板评估具有良好的相关性,其中TEG监测纤溶功能更有优势,凝血与血小板功能分析仪对凝血因子和血小板功能监测更敏感[21]。
3 抗凝治疗
推荐意见6重症COVID-19患者出现血栓事件/血栓前状态且无抗凝禁忌证时,可启动抗凝治疗。
重症COVID-19患者合并易栓症时更易表现为高凝状态,实验室检查直接证据可表现为PT或APヰ缩短[15], 黏弹力凝血实验可表现为凝血因子和血小板功能亢进[22]。DD水平显著升高亦提示血栓形成可能,临床上可出现深静脉血栓、肺栓塞、心肌梗死和脑梗死等血栓事件。在无抗凝禁忌证的前提下,推荐启动抗凝治疗。抗凝药物宜选择胃肠外抗凝药,药物选择与剂量根据栓塞部位和栓塞危重程度决定[23]。
推荐意见7重症COVID-19患者合并凝血功能障碍时,为减少凝血底物消耗可行抗凝治疗,抗凝药物推荐普通肝素/低分子肝素。
重症COVID-19患者由于细胞因子风暴可激活凝血途径,导致凝血因子、血小板过度消耗[16]。凝血底物过度消耗造成凝血功能障碍,形成恶性循环,导致重症COVID-19向DIC甚至MOF发展。为了减少凝血底物消耗,有专家共识提出对普通型COVID-19患者可给予低分子肝素1~2支/d抗凝,并持续至患者DD水平恢复正常。一旦FDP≥10 μg/ml和(或)DD≥5 μg/ml,则改用普通肝素[3~15 U/(kg·h)],且初次使用肝素后4 h必须复查凝血功能和血小板[24]。有学者对COVID-19患者进行回顾性分析发现,对DD水平升高>6倍的患者,行低分子肝素治疗者病死率明显低于未行低分子肝素治疗者(未发表)。但该方案目前尚缺乏有效的循证医学证据。
重症COVID-19合并凝血功能障碍患者进行抗凝治疗时,推荐应用普通肝素或低分子肝素[25]。前者具有半衰期短、监测方便,以及可用鱼精蛋白中和等优点,建议作为首选药物并静脉给药,药物剂量需根据凝血功能和器官功能状况选择,重度凝血功能障碍者可从小剂量[1 U/(kg.h)]开始,根据实验室指标进行滴定式治疗。后者半衰期长,不易调整和监测剂量,建议在轻中度凝血功能障碍时使用。起始剂量一般建议1 mg/kg每12 h静脉注射或皮下注射,并应用抗Ⅹa活性监测剂量,控制目标范围为0.6~1.0 U/ml。低分子肝素经肾脏代谢,肾功能不全者尤需监测。应用肝素类药物应尽量维持ATⅢ活性>80%,否则可能影响抗凝效果。若ATⅢ活性降低,可通过补充新鲜冰冻血浆提高ATⅢ活性。
推荐意见8推荐采用TEG肝素酶对比试验监测重症COVID-19合并凝血功能障碍患者的普通肝素抗凝剂量。
大多数重症COVID-19合并凝血功能障碍患者均接受肝素类药物治疗,常规凝血指标和黏弹力普通检测项目的检测结果包含了患者本身的凝血功能和肝素类药物的混合作用,导致临床上难以对患者的凝血功能做出准确评估。因此,推荐采用TEG肝素酶对比试验评估正在进行肝素抗凝治疗的重症COVID-19患者的凝血功能,并据此调整肝素剂量[26]。TEG肝素酶对比试验要求同时进行普通杯和肝素酶杯实验,普通杯代表患者本身凝血功能和肝素共同作用的凝血状态,肝素酶杯破坏了血液中的肝素,仅体现患者本身的凝血功能形成的凝血状态,两相对比可以准确评估患者的自身凝血状态,并用于指导调整肝素剂量。通常建议普通杯R时间与肝素酶杯R时间的比值为2较好[27]。
推荐意见9重症COVID-19合并凝血功能障碍患者如需行连续性血液净化治疗,推荐采用普通肝素/低分子肝素进行全身抗凝。
血液净化的抗凝方式可分为全身抗凝、局部抗凝和无抗凝。全身抗凝是通过静脉使用抗凝药物降低患者全身血液凝固性的抗凝方法,局部抗凝是仅降低处于体外循环管路中的血液凝固性但不影响患者体内血液凝固性的抗凝方法。当仅需对体外管路进行抗凝时,可根据患者凝血功能状态选择局部抗凝或全身抗凝。重症COVID-19合并凝血功能障碍患者须行连续性血液净化治疗(continuous renal replacement therapy,CRRT)时,由于患者本身疾病需要进行抗凝治疗,故推荐全身抗凝。全身抗凝治疗可改变患者体内血液的凝固性,为了避免增加出血风险甚至导致出血,抗凝药物的剂量需要根据患者的凝血功能状况进行个体化调整。普通肝素使用剂量推荐见表3。抗凝后6 h内需对患者的凝血状态进行监测,其后根据病情定时监测。普通肝素剂量建议根据APTT或TEG R时间或凝血与血小板功能分析仪ACT值较前基础值的改变程度来调整,有条件时推荐TEG肝素酶对比实验,以R/Rh比值为1.5~2.0为标准调整肝素剂量[27]。肝素严重过量可考虑使用鱼精蛋白拮抗。
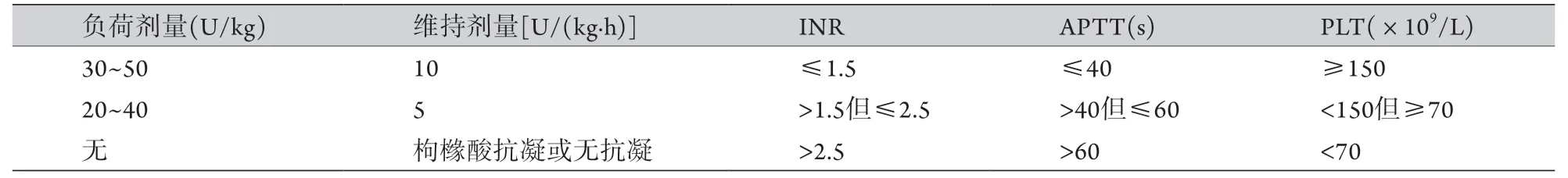
表3 根据出血风险分层采用不同肝素抗凝剂量*Tab.3 Different heparin anticoagulants were used according to the risk of bleeding*
低分子肝素的使用可采用反复推注或持续泵注两种方法。反复推注通常推荐首次剂量60~80 U/kg,在治疗前20~30 min静脉注射;追加剂量30~40 U/kg,每4~6 h静脉注射,随治疗时间延长,给予的追加剂量应逐渐减少。应监测血浆抗凝血因子Ⅹa活性,保持在0.3 U/ml,根据测定结果调整剂量。持续泵注时可将相应剂量低分子肝素用输液泵持续输注维持,输注速度需根据血浆抗凝血因子Ⅹa活性进行调整。
推荐意见10重症COVID-19合并活动性出血患者如需行CRRT,推荐局部枸橼酸抗凝。
重症COVID-19合并活动性出血患者如需行CRRT,应在尽快止血的前提下采用局部枸橼酸抗凝方案。采用4%枸橼酸三钠溶液以血流速度(ml/min)的1.2~1.5倍剂量滤器前持续给药,滤器前枸橼酸浓度应达到3~4 mmol/L,维持滤器后游离钙浓度为0.25~0.35 mmol/L,静脉血游离钙浓度为1.1~1.35 mmol/L。应根据滤器后的钙离子浓度调整枸橼酸剂量,根据体内血清钙离子浓度调整氯化钙或葡萄糖酸钙溶液剂量[28]。
推荐意见11重症COVID-19合并凝血功能障碍患者如需进行体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)治疗,抗凝药物首选普通肝素,并加强凝血功能监测。
重症COVI D-19患者以肺部损害为主要表现,ECMO是危重症COVI D-19患者的重要救治手段。肝素是ECMO辅助期间最常用的抗凝剂,但会增加出血风险[29]。重症COVID-19合并凝血功能障碍患者发生出血以手术切口或ECMO插管部位常见,亦可见鼻腔、气道、消化道出血,尤以颅内出血最为严重。因此,重症COVID-19合并凝血功能障碍患者进行ECMO辅助期间,需加强凝血功能监测常用指标为激活全血凝血时间(activated clotting time,ACT)和APTT,需维持ACT于180~220 s或维持ACT和APTT达到正常上限的1.5倍。TEG肝素酶对比试验亦适用于ECMO抗凝监 测[30],具体应用方法参考推荐意见8。如应用抗Ⅹa因子活性监测肝素剂量,建议Ⅹa活性保持为0.3 U/ml。ECMO联合CRRT治疗时,抗凝方式和监测方法类似。
推荐意见12如重症COVID-19患者发生肝素诱导的血小板减少症,须更换抗凝药物阿加曲班/比伐卢定。
肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT)是在应用肝素类药物过程中出现的、由血小板活化抗体诱发的疾病,以血小板计数降低为主要临床表现,可引发静、动脉血栓形成甚至死亡。有研究发现,HIT发病率为0.1%~5%,应用普通肝素后发生的HIT显著多于低分子肝素[31]。HIT的发病机制为肝素诱导免疫系统产生的抗血小板4因子(platelet factor 4,PF4)抗体(IgG)与肝素和PF4形成三联复合物,该复合物会激活血小板,刺激血小板分泌促凝物质,最终导致血小板破坏消耗,数量减少,血管内凝血激活,血栓形成。如重症COVID-19应用肝素类药物后出现血小板计数下降>基础值的50%和(或)动静脉血栓征象,可采用4T's评分或HIT抗体检测除外HIT。4T's评分由血小板减少的数量特征、时间特征、血栓形成类型以及是否存在其他导致血小板减少的原因4个要素构成,4项评分相加,根据得分多少确定HIT的可能性:≤3分为低度可能,4~5分为中度可能,6~8分为高度可能。如4T's评分≥4分且HIT的IgG特异性抗体呈阳性即可基本确诊[32]。
对于高度可疑或确诊的HIT患者,应停用肝素并改用非肝素类抗凝药物,如阿加曲班/比伐卢定[33]。 ①患者对肝素过敏或出现HIT时可选择阿加曲班抗凝。阿加曲班属于直接凝血酶抑制剂,主要在肝脏代谢,可导致TT显著延长。推荐起始剂量0.2~0.5 μg/(kg.min)静脉滴注,并根据APTT或TEG R时间或凝血与血小板功能分析仪ACT值动态调整。对中度肝功能不全、心力衰竭者,推荐起始剂量0.5~1.2 μg/(kg.min)静脉滴注;MOF时,推荐起始剂量0.2~0.5 μg/(kg.min)静脉滴注。②比伐卢定属于直接凝血酶抑制剂,其有效抗凝成分为水蛭素衍生物片段,通过直接并特异性抑制凝血酶活性而发挥抗凝作用,作用短暂(半衰期25~30 min)而可逆,可应用于HIT或怀疑HIT的患者。推荐起始剂量为0.05 mg/(kg.h), 并根据APTT或TEG R时间或凝血与血小板功能分析仪ACT值动态调整。
4 替代治疗
推荐意见13重症COVID-19合并凝血功能障碍患者推荐采用目标导向的替代治疗。
重症COVID-19合并凝血功能障碍患者推荐采用目标导向的替代治疗,即以常规凝血监测或TEG、凝血与血小板功能分析仪相关指标为目标指导替代治疗[34]。
PT或APTT延长>1.5倍,或TEG R>10 min,或凝血与血小板功能分析仪ACT>240 s(抗凝全血)时,应尽早静脉输注新鲜冰冻血浆15~30 ml/kg。输注后可动态监测凝血指标确定追加输注剂量。如患者液体负荷过多,可以结合浓缩凝血酶原复合物补充凝血因子[35]。FIB<1.5 g/L,或TEG功能纤维蛋白原检测指标FFMA<10 mm,或凝血与血小板功能分析仪CR<10时,可给予冷沉淀(10 ml/kg)或人纤维蛋白原(30~50 mg/kg) 静脉输注。输注后可动态监测凝血指标确定追加输注剂量,血浆FIB至少应维持在1.5 g/L[36]。
非出血的重症COVID-19患者,推荐PLT<20×109/L时进行输注;拟行腰椎穿刺和出现活动性出血的重症COVID-19患者,PLT<50×109/L时进行输注;正在进行ECMO治疗的重症COVID-19患者,建议PLT<80×109/L时开始输注[30,37]。已有研究发现,应用血小板计数作为血小板输注的启动指征并未显示能改善危重患者的预后[38],针对重症血小板减少患者应用血小板功能指标指导血小板输注对危重患者的结局可能有益[39]。若采用TEG指导血小板输注,现有研究推荐MA<43 mm时进行输注[40]。凝血与血小板功能分析仪PF<1时,可进行血小板输注[41]。接受抗血小板药物治疗的患者如果出现持续出血并发生血小板功能障碍甚至血小板减少,建议输注血小板[42]。血小板输注剂量应遵循个体化原则,根据患者体重、脾功能、其他消耗因素综合考虑,一般一次输注1个单采剂量或相当剂量的浓缩血小板,威胁生命的严重出血可输注≥2个单采剂量。输注后根据效果评估及时调整,以达到预期效果的最低剂量及维持效果为原则。输注1个单位血小板,理论上成人(70 kg)可升高(4~8)×109/L血小板。
推荐意见14重症COVID-19患者如经积极替代治疗仍无法有效止血,推荐使用重组凝血因子Ⅶ。
如经积极替代治疗仍无法有效止血,且经凝血监测仍提示低凝状态,可以使用重组凝血因子Ⅶ(rⅦ)。为了更好地止血,使用rⅦ时需满足以下条件:①酸中毒、低体温和低钙血症已经纠正;②血细胞比容>24%,血小板计数>50×109/L,FIB>1.5 g/L。rⅦ初始剂量为100~200 μg/kg,视出血情况可以2 h为间隔继续追加100 μg/kg。根据出血情况和凝血监测结果酌情停药[43]。
5 支持治疗
推荐意见15重症COVID-19合并凝血功能障碍患者诊断肝衰竭时,推荐进行血浆置换。
重症COVID-19患者如出现Ⅱ度及以上肝性脑病并有以下表现者,可诊断急性肝衰竭[44]:①极度乏力且有明显厌食、腹胀、恶心、呕吐等消化道症状;②短期内黄疸进行性加深,血清总胆红素≥10倍正常值上限或每日上升≥17 μmol/L;③凝血酶原活动度≤40%或INR≥1.5,且排除其他原因;④肝脏进行性缩小。
重症COVID-19合并凝血功能障碍患者诊断肝衰竭时,推荐进行人工肝治疗(artificial liver support system,ALSS)。血浆置换是人工肝技术中应用较为广泛且疗效确切的治疗方式。血浆置换是指将患者血液引至体外,经离心法或膜分离法分离血浆和细胞成分,弃去血浆,而将细胞成分以及所需补充的白蛋白、血浆及平衡液等回输体内,以清除体内致病物质,包括自身抗体、免疫复合物、胆固醇、胆红素、药物和毒物等[45]。对于有高炎症反应的危重患者,血浆置换既能清除大量的炎性介质,改善患者的高炎症反应状态,又能去除血浆中的胆红素等毒性物质,同时补充凝血因子以改善凝血状态,是危重患者有效的辅助治疗手段。已有研究证实,脓毒症休克尤其是需要使用大剂量血管活性药物维持血流动力学的患者早期进行血浆置换,可以减少血管活性药物使用剂量,清除炎性因子,减轻毛细血管渗漏和血小板消耗[46-47]。
血浆可获取时,建议进行血浆置换联合血浆吸附或双重血浆分子吸附、灌流及滤过,血浆置换量(L)=体重(kg)×(1/13)×(1-血细胞比容/100)。血浆紧缺时,建议血浆置换量>2000 ml;血浆不可获取或<2000 ml时,建议进行血浆吸附或双重血浆分子吸附、灌流和血液滤过联合治疗[48]。肝衰竭时的凝血功能评估和抗凝治疗监测推荐采用黏弹力检测设备[49]。
6 预 防
推荐意见16重症COVID-19合并凝血功能障碍患者如有动静脉置管时,应避免使用肝素冲管。
重症COVID-19患者因治疗需要会置入深静脉导管,如血流动力学不稳定时需要进行有创动脉血压监测。为了保持动静脉管路通畅,现有操作常规推荐定时用无菌肝素液冲洗,对动脉导管冲洗更加频繁,会导致额外的肝素进入患者体内[50]。已有研究证实,经常用肝素液冲管可能造成抗凝过度甚至发生出血[51],也会影响针对肝素用量的监测。为此,本共识建议尽量避免使用肝素封管液冲洗深静脉导管。
推荐意见17重症COVID-19合并凝血功能障碍患者应在保障组织灌注的前提下控制晶体液和人工胶体的输注剂量。
有研究用凝血与血小板分析仪检测健康人群输入1 L生理盐水或琥珀酰明胶后的凝血状态,结果显示生理盐水可导致CR平均升高6%,ACT平均缩短15%,整体表现为高凝倾向;琥珀酰明胶可导致CR平均下降12%,达峰时间平均延长96%,整体表现为低凝倾向[52]。随着输注液体量的增加,稀释效应会造成凝血功能障碍进一步加重[53]。此外,血液等容性稀释会导致血小板聚集功能显著下降[54]。因此,重症COVID-19合并凝血功能患者应严格控制过度输注液体,特别是人工胶体[55]。
推荐意见18重症COVID-19合并凝血功能障碍患者进行体外生命支持治疗时,需积极控制对凝血功能的影响。
体外生命支持(extracorporeal life support,ECLS)治疗是指体内脏器功能障碍危及生命时,在体外使用设备部分或完全替代脏器功能以维持患者生命。广义的ECLS包括支持心肺功能的ECMO、支持肾功能的CRRT和支持肝功能的ALSS等[56]。
在应用ECLS的过程中,由于血液与外源人工材料表面持续不断地接触,使得凝血系统被激活,正常的凝血与抗凝平衡被打破,从而转向高凝状态,造成血小板和凝血因子的额外损耗[57]。预防管路凝血的抗凝药物也会影响患者的凝血状态,增加出血导致血小板减少的风险或者诱发HIT[58]。Guru等[59]报道拟行CRRT治疗的危重患者有65%存在血小板减少,在CRRT治疗过程中又有20%发生血小板减少。使用肝素抗凝并行CRRT的患者比仅用肝素抗凝患者的血小板明显下降,多数应用4T's评分提示达到HIT的诊断标准,但实际上抗体明显阳性的比例不高[60]。Choi等[61]报道,接受ECMO治疗的患者发生血小板减少的比例高达83%,VA-ECMO比VV-ECMO更容易引起血小板减少,其原因与膜氧合器引起vWF聚集形成血栓导致血小板消耗有关[62]。ECMO治疗时HIT发生率可达20%。多数患者接受ECMO治疗时的PF4抗体显示阳性。当ECMO管路频繁出现异常、血小板进行性下降、PF4特异性IgG抗体呈现高水平时,需考虑HIT的可能[63]。因此,进行ECLS时需要全面评估患者的凝血功能,选择恰当的抗凝方案,尽量控制导致凝血功能障碍的影响因素,密切监测凝血指标。具体目标如下:血小板计数维持>100×109/L;PT较正常值延长≤5 s;FIB维持>2 g/L;ATⅢ维持>80%[30]。若无法对ATⅢ进行监测,且患者需要较大剂量普通肝素才能达到抗凝目标时,需考虑有无ATⅢ不足,可通过补充新鲜冰冻血浆来补充ATⅢ。如在ECLS治疗过程中出现显著的凝血功能障碍甚至活动性出血,必要时可停止抗凝治疗[64]。
执笔作者:宋景春,王岗,张伟,张洋,李维勤,周洲
顾问:丛玉隆(解放军总医院第一医学中心),宋青(解放军总医院第一医学中心),林洪远(解放军总医院第四医学中心)
编委会成员(按姓氏拼音排序):崔岩(解放军北部战区总医院,武汉火神山医院),崔云亮(解放军联勤保障部队第940医院,武汉火神山医院),福军亮(解放军总医院第五医学中心,武汉火神山医院),侯云生(解放军联勤保障部队第980医院,武汉火神山医院),李双磊(解放军总医院第一医学中心,武汉火神山医院),李维勤(解放军东部战区总医院,武汉火神山医院),刘宇鹏(解放军联勤保障部队第967医院,武汉火神山医院),宋景春(解放军联勤保障部队第908医院,武汉火神山医院),唐宁(华中科技大学附属同济医院),王岗(西安交通大学第二附属医院,华中科技大学附属同济医院中法新城院区),张伟(解放军联勤保障部队第900医院,武汉金银潭医院),张洋(中国医学科学院附属阜外医院),张真路(武汉亚洲心脏病医院),赵汉卫(解放军联勤保障部队第902医院,武汉火神山医院),周洲(中国医学科学院附属阜外医院),朱四海(解放军东部战区总医院,武汉火神山医院)
转载声明:此共识的英文版本首次发表于Military Medical Research, 2020, 7: 19。此版本为中文翻译版本。
