我国东南沿海野生坛紫菜遗传多样性的AFLP分析
2020-06-23刘颖张鹏王铁杆任鹏
刘颖,张鹏,王铁杆*,任鹏
(1.浙江省海洋水产养殖研究所,浙江 温州 325005; 2.浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
坛紫菜(Pyropiahaitanensis)属于红藻门(Rhodophyta),红藻纲(Rhodophyceae),红毛菜目(Bangiales),红毛菜科(Bangiaceae),法紫菜属(Pyropia)[1]。主要栖息在潮间带,是我国特有暖温带性种类,分布于浙江、福建和广东三省沿海[2]。坛紫菜是我国重要的经济栽培海藻,其年产量约占全国紫菜年产量的75%[3]。坛紫菜养殖品种的最初来源是岩礁上的野生坛紫菜,尽管自20世纪60年代坛紫菜已实现了全人工栽培,但野生坛紫菜仍然是进行优质、高产、抗逆等特性选育和优化的重要种质来源[3-4]。丰富的遗传多样性是物种适应复杂自然环境的内在基础,因此,研究野生坛紫菜的遗传多样性对坛紫菜的遗传育种和种质资源保护具有重要意义[4]。近年来,随着经济的迅速发展,污染、养殖、堤坝建设等人类活动对潮间带的生态和结构产生了重大影响[5]。坛紫菜作为生长于潮间带的主要大型海藻之一,其自然资源已面临严重衰退。而有关野生坛紫菜遗传多样性的报道却很少[4,6-10],尤其近4年已未见相关报道。因此,亟需对现存的坛紫菜野生群体进行资源调查和遗传多样性分析,旨在加强对自然资源的保护,以及为人工繁育选择原始种质资源提供参考。
扩增片段长度多态性(amplified fragment length polymorphism,AFLP)具有灵敏度高、效率高、稳定性好、重复性好等特点[11]。作为最有效的分子标记之一,AFLP已被广泛应用在藻类的种质鉴定[12-13]、遗传多样性分析[14-16]、连锁图谱构建等领域[17-18]。因此,本研究运用AFLP标记技术对采自浙江、福建和广东三省沿海的6个坛紫菜野生群体进行遗传多样性及遗传结构分析,实验结果从分子水平揭示了我国东南沿海坛紫菜野生群体的遗传多样性现状,对坛紫菜种质资源的评估和保护具有重要的参考价值。
1 材料与方法
1.1 材料
坛紫菜分别随机采集于浙江温州竹屿(ZY)、浙江台州大陈岛(DC)、福建平潭岛(PT)、福建莆田南日岛(NR)、福建宁德北礵岛(BS)和广东汕头平屿(PY)(表1),共83株叶状体样品,阴干后带回实验室,存放于-20 ℃冰箱备用。

表1 野生坛紫菜样品信息
1.2 基因组DNA的提取
用毛刷将保存的坛紫菜样品在超纯水中刷洗干净,按照“DN14-植物基因组DNA快速提取试剂盒”(北京艾德莱生物科技有限公司,DN1401)的操作说明提取坛紫菜基因组DNA,经1%琼脂糖凝胶电泳检测其完整性后,利用微量分光光度计(Nano-400)测定DNA的质量与浓度,将DNA浓度调至30 ng·μL-1,-20 ℃保存备用。
1.3 AFLP分析
AFLP分析流程参照Vos等[19]和王志勇等[20]的方法。实验所用的内切酶(EcoRⅠ和MseⅠ)和T4 DNA连接酶为Fermentas公司生产;接头和引物由英潍捷基(上海)公司合成,序列见表2。毛细管电泳检测由生工生物工程(上海)股份有限公司完成。

表2 AFLP引物与接头序列
酶切体系:模板DNA(30 ng·μL-1)5 μL,EcoRⅠ(10 U·μL-1)0.1 μL,MseⅠ(10 U·μL-1)0.1 μL,10×Tango Buffer 4 μL,灭菌纯净水补齐至20 μL。反应条件:37 ℃酶切4 h,接着65 ℃酶切4 h,80 ℃灭活20 min。
连接体系:酶切产物5 μL,T4连接酶0.5 μL,10×T4 Buffer 1 μL,50% PEG4000 1 μL,EcoRⅠ接头(5 μmol·L-1)0.5 μL,MseⅠ接头(50 μmol·L-1)0.5 μL,灭菌纯净水补齐至10 μL,22 ℃连接1 h,70 ℃灭活5 min。
预扩增:连接产物1 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ预扩增引物(10 μmol·L-1)0.5 μL,MseⅠ预扩增引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,灭菌双蒸水补齐至20 μL。反应程序:94 ℃预变性2 min;进行20个循环(94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。
选择扩增:预扩增产物稀释10倍作为选择性扩增模板。预扩增产物稀释液2 μL,Taq酶(5 U·μL-1)0.2 μL,10×PCR Buffer(Mg2+)2 μL,EcoRⅠ引物(10 μmol·L-1)0.5 μL,MseⅠ引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)0.4 μL,灭菌双蒸水补齐至20 μL。反应程序:94 ℃预变性2 min;以每个循环降1 ℃的梯度从65 ℃退火到56 ℃退火(94 ℃变性30 s,65 ℃~56 ℃退火30 s,72 ℃延伸30 s);然后进行27个循环(94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸10 min。从64对选择性引物组合中筛选出样品可以全部扩出、多态性高的8对引物组合进行群体选择性扩增。
电泳检测:选择性扩增产物送至生工生物工程(上海)股份有限公司进行毛细管电泳。用ABI 3730XL自动测序仪(Applied Biosystems, USA)对PCR产物进行基因分型,用GeneMapper Software 5 进行等位基因大小分析。
1.4 数据分析
根据毛细管电泳结果选取片段大小在0~500 bp的片段进行统计,构建“0 1”矩阵,运用GenAIEx 6.51b2[21-22]计算种群内有效等位基因数(Ne)、Nei’s多样性指数(H)、Shannon’s信息指数(I)、Nei’s遗传距离和遗传相似系数,以及进行ANOVA分析和二维主坐标分析(Principal coordinates analysis,PCoA)。根据Nei’s遗传距离,使用软件MEGA 7.0构建UPGMA聚类图。观测等位基因数(Na)、种群间遗传分化系数(Gst)、种群间基因流动系数(Nm)由PopGen 3.2软件计算完成。
2 结果与分析
2.1 AFLP扩增多态性
用筛选出的8对选择性引物对6个坛紫菜群体的83个样品进行AFLP分析,共得到1 261个有效位点,其中多态位点1 260个。不同引物扩增位点数为141~188个,平均每对引物扩增出157.63个AFLP位点。扩增位点最多的引物对是E-AGG/M-CAA。每对引物扩增的多态位点比例均大于99%(表3)。

表3 AFLP选择性引物的扩增结果
2.2 遗传多样性分析
遗传多样性是生物对复杂环境适应能力的一种反应,是评价生物资源状况的重要依据。由表4可知,6个坛紫菜群体的多态位点比例(PPL)为91.18%~98.89%,平均96.63%;Na为1.410 0~1.637 6,平均1.504 5;有效等位基因数(Ne)为1.189 0~1.243 0,平均1.225 4;I为0.186 3~0.244 4,平均0.222 8;H为0.118 9~0.152 9,平均0.141 7;无偏多样性(uh)为0.129 7~0.166 8,平均0.153 4。其中DC群体的多样性最丰富,NR群体的多样性水平最低。

表4 6个坛紫菜群体的遗传多样性参数(平均值±标准误)
2.3 遗传结构分析
6个坛紫菜群体间Gst为0.248 0,表明遗传变异主要来自群体内,Nm为1.519 6,表明不同地理群体的坛紫菜间存在一定的基因交流。ANOVA分析显示(表5),21.77%的变异来自群体间,78.23%的变异来自群体内,6个群体间的差异显著。这与Gst=0.248 0的结果基本一致。

表5 基于坛紫菜AFLP数据的分子方差分析(ANOVA)
2.4 遗传距离与聚类分析
6个坛紫菜群体间的遗传相似性系数为0.898 8~0.970 6,遗传距离为0.029 9~0.106 7,DC与ZY群体的遗传相似系数最大(0.970 6),遗传距离最小(0.029 9),说明这2个群体间的亲缘关系最近,遗传差异性最小。PY与NR群体的遗传相似系数最小(0.898 8),遗传距离最大(0.106 7),说明这2个群体的亲缘关系最远,差异性最大(表6)。
根据遗传距离构建UPGMA聚类树并进行个体主坐标分析(principal coordinates analysis,PCoA)。群体聚类显示:6个群体聚为2大类,ZY和DC群体、PY和PT群体先分别聚为两小支,再汇合为一大支,然后与BS群体聚在一起,而NR群体则单独为一大支(图1)。这一结果在PCoA数据中也得到了展示,从图2中可以看出DC和ZY群体之间,PY、PT和BS群体之间存在一定程度的基因混杂,而NR群体与其他群体间则出现明显分离。

表6 坛紫菜野生群体间Nei’s遗传距离(左下角和遗传相似性系数(右上角)
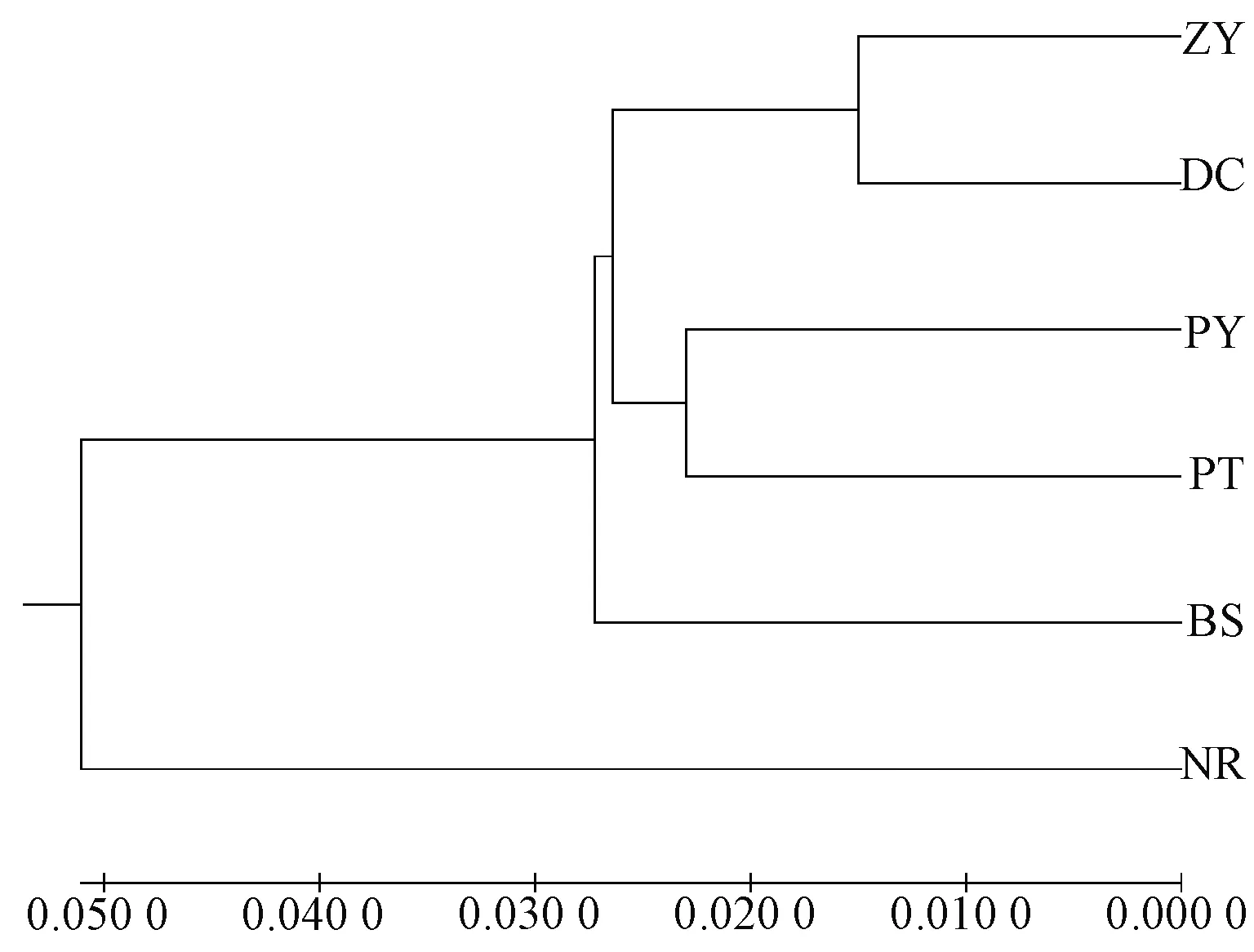
图1 坛紫菜6个群体的UPGMA聚类分析
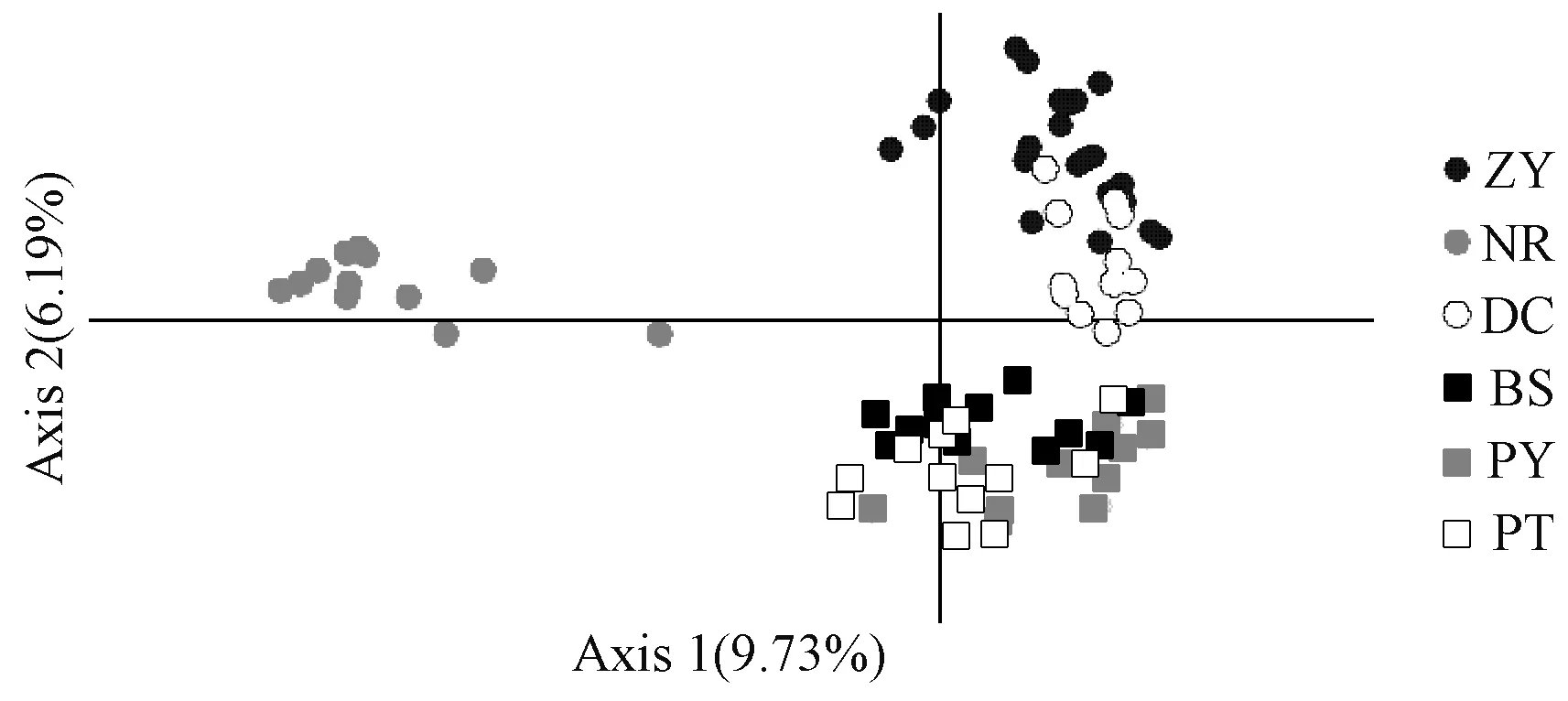
图2 83个坛紫菜样品的主坐标分析
3 讨论
3.1 AFLP标记检测效果评价
AFLP标记是多态条带比例高、实验结果稳定,不受基因组来源和复杂程度影响的标记,可以用于检测亲缘关系非常近的材料之间的差异[23-24]。Hu等[25]利用AFLP和SSR分析比较莲(NelumbonuciferaGaertn)的遗传多样性时发现,AFLP标记在评估遗传分化及亲缘关系时比SSR更为准确,Liu等[11]利用AFLP技术揭示了中国沿海鼠尾藻的南北遗传断裂,表明AFLP技术用于群体遗传多样性和遗传结构分析是可靠的。本研究利用AFLP技术对东南沿海坛紫菜野生群体进行分析,结果显示,每对引物扩增的多态位点比例都大于99%,可见运用AFLP技术对坛紫菜进行遗传多样性研究十分有效。
3.2 野生坛紫菜的遗传多样性
遗传多样性是物种或群体经过长期进化所积累的遗传变异的总和[26],能够在一定程度上反映生物对复杂环境的适应能力[27],对该生物的可持续发展、保护和利用有着重要意义[28]。近年来,受人类活动影响,富营养化、污染、水动力条件紊乱等对潮间带的生态和结构产生了诸多影响[29]。坛紫菜是生长于潮间带的主要大型海藻之一,生境的变化势必会对其自然资源造成严重影响,近几年我们在海区采样时发现竹屿(ZY)的野生坛紫菜已没有每年都长出,所以亟需重新评估坛紫菜野生群体的遗传多样性现状。由于野生坛紫菜主要附着于岩礁上采样难度较高,有关野生坛紫菜种群遗传多样性的研究近几年已未见报道,以往的研究采样范围较小,仅局限于某个省内[4,6-10]。本研究采用8对AFLP选择性引物对采自浙江、福建和广东三省沿海的6个坛紫菜野生群体共83个样本进行了分析,结果显示6个群体的多态位点百分率为91.18%~98.89%,平均96.63%,虽然6个群体的遗传多样性不同,但多态位点百分率都在90%以上,这一结果与杨锐等[6]、陈奕欣等[30]和王鑫等[31]用AFLP技术对紫菜进行遗传多样性分析得出的多态位点百分率相似。本研究得到的I为0.222 8,H为0.141 7,均低于陈昌生等[7]、纪德华[8]和Bi等[4]对福建野生坛紫菜和王金丹等[10]对浙南野生坛紫菜进行遗传多样性分析得到的结果,虽未达到显著差异,但仍表明目前野生坛紫菜的遗传多样性已经有所下降。6个坛紫菜野生群体的uh为0.129 7~0.166 8,按无偏多样性来排序,6个群体的遗传多样性顺序为:DC群体>PT群体>BS群体>ZY群体>PY群体>NR群体,各个群体间的遗传多样性差异不显著,并未表现出与地理位置的关联。
3.3 坛紫菜野生群体间的基因交流
基因流动程度会对群体的遗传结构产生重要影响,当种群基因流Nm大于1时,说明群体间有一定程度的基因流动,若Nm小于1,则说明群体间分化明显[26]。本研究坛紫菜群体间的Nm为1.5196,说明这6个群体间存在一定的基因交流,由于大部分坛紫菜为雌雄同体,生殖方式主要是有性生殖,在其生活史中果孢子和壳孢子可以随海流运动进行传播,这给不同地理群体间的坛紫菜发生基因交流提供了条件[7]。另外,中国沿海同时存在南向和北向2种主要的洋流模式,使坛紫菜果孢子和壳孢子大范围的漂移成为可能,而东南沿海江河众多,大量淡水冲入大海势必对盐度、泥沙含量、浑浊度、营养盐等与坛紫菜生长相关的因素造成影响,进而影响野生坛紫菜的自然分布。陈昌生等[7]利用ISSR对福建野生坛紫菜进行分析得出Nm为7.193 0,纪德华[8]利用SRAP对福建野生坛紫菜进行分析得出Nm为3.612 4,王金丹等[10]对浙南野生坛紫菜进行分析得到Nm为2.359 1,Bi等[4]利用SSR分析福建的野生坛紫菜得出Nm为2.542。与之前的数据相比目前坛紫菜野生群体间的基因交流减少,分化程度逐渐加大。推测这可能是造成野生坛紫菜遗传多样性降低的原因之一。ANOVA分析得出坛紫菜有21.77%的变异来自群体间,78.23%的变异来自群体内,来自群体间的变异大于陈昌生等[7]、纪德华[8]和Bi等[4]得到的结果,也表明野生群体间的分化正在加大。在UPGMA聚类图中NR群体单独聚为一类,而PCoA结果更清楚地显示出NR群体已与其他地理群体明显分开,分化明显。目前,尚不清楚出现这一现象的原因,南日岛周围众多的小岛屿可能成为了阻碍坛紫菜果孢子和壳孢子随洋流运动的地理障碍,造成南日群体与其他群体的分化逐渐加大。
4 小结
综上所述,我们利用AFLP分子标记技术检测出我国东南沿海野生坛紫菜的遗传多样性呈下降趋势,个别岛屿的种群已有衰退迹象,因此,需要加大对坛紫菜野生资源的保护,抢救式采集野生坛紫菜进行保种。另外,不同地理位置的坛紫菜野生群体间的基因交流减少,分化情况较之前更为明显。本研究的数据有力补充了东南沿海地区野生坛紫菜的遗传多样性和遗传结构信息,为及时了解野生坛紫菜资源现状,制定资源保护及开发利用方案提供了理论支持。
