颅脑损伤患者脑脊液神经元特异性烯醇化酶、星形胶质源性蛋白水平变化及其临床意义
2020-06-23吕庆平金许洪魏雨雨庞晓骏张子彬
吕庆平 金许洪 陈 怀 魏雨雨 庞晓骏 张子彬
颅脑损伤是一种由外力引起的大脑功能改变,在车祸、跌倒或其他事故后发生。中国颅脑损伤年发生率为(55~64)/10 万,导致每年近10 万人死亡,数十万人伤残,是严重的公共安全问题[1]。由于颅脑损伤经常部位多发,而且存在个体差异,导致其病理生理机制复杂,因此对伤情严重程度的判断存在较大难度。以往临床评估颅脑损伤严重程度的指标主要包括颅内压(ICP)监测、美国国立卫生研究院卒中量表(NIHSS)以及格拉斯哥昏迷评分(GCS)等,但此类指标无法呈现患者颅内分子水平的变化情况,对患者病情反馈不甚全面[2-3]。有研究显示,神经元特异性烯醇化酶(NSE)和星形胶质源性蛋白(S100β)具有作为中枢神经系统损伤标志物的潜力[4-5]。因此,分析颅脑损伤后患者的脑脊液NSE 和S100β 水平变化,有助于更好地评估患者疾病严重程度,现报道如下。
1 临床资料
1.1 一般资料 选择2017 年6 月—2019 年6 月在浙江省中西医结合医院接受治疗的颅脑损伤患者45例为观察组,选择同期住院经头颅CT/MRI 证实无中枢神经系统疾病(脑血管、感染、脱髓鞘、变性疾病),且脑脊液常规检查均在正常参考范围内的30 名志愿者为对照组。本研究通过医院伦理委员会审核。
1.2 纳入标准 观察组患者均符合《王忠诚神经外科学》(2015 年第2 版)关于颅脑损伤的诊断标准[6]:(1)头颅CT 等影像学结果存在颅内损伤;(2)患者GCS 评分为4~8 分;(3)年龄>20 岁;(4)初次颅脑损伤疾病就诊;(5)患者或其家属对本次研究已知情同意,并签署同意书。
1.3 排除标准 (1)发生休克与合并其他脏器损伤;(2)合并脑缺血、脊髓病变、颅内感染等疾病;(3)合并恶性肿瘤、自身免疫性疾病、造血系统疾病;(4)经期女性以及在入院后的3 天内即已死亡者;(5)病历资料数据缺失者。
2 方 法
2.1 治疗方法 观察组入院后均予以止血、护胃、营养神经及能量支持等药物治疗,保持呼吸道通畅,防止各种颅脑损伤并发症。对于颅内血肿量大或脑挫裂伤范围广泛达到开颅手术指征[7]的患者,行急诊手术解除颅内压迫,同时根据ICP 水平酌情给予脑脊液外引流、甘露醇、速尿等降颅压治疗,并监测生命体征及血常规、血生化、出凝血功能等指标,维持患者收缩压在90mmHg(1mmHg=0.133kPa)以上,脑灌注压在60mmHg 以上。对照组不进行任何针对中枢神经系统疾病的相关治疗,仅在第1、7 天采集2 次脑脊液标本。
2.2 观察指标
2.2.1 ICP 检测 两组患者在入院第1、7 天均给予腰椎穿刺测定ICP,观察组中需行手术治疗的患者在入院第1 天行腰椎穿刺测定ICP,手术治疗后持续行ICP 监测,同时记录入院后第7 天的ICP。其中ICP水平判断标准:(1)≤20mmHg 记为正常;(2)>20~30mmHg 记为轻度升高;(3)>30~40mmHg 记为中度升高;(4)>40mmHg 记为重度升高。
2.2.2 脑脊液NSE 及S100β 水平检测 观察组在入院第1、7 天,对照组在入院第1、7 天复查时通过腰穿或是引流管分别采集其脑脊液2mL 作为检测标本,实施15min 2500r/min 离心后提取上清液,放置在-20℃冰箱内保存待测。通过电化学发光法测定脑脊液内NSE 的水平,通过酶联免疫吸附法检测脑脊液内S100β 的水平,试剂盒由北京北方生物技术研究所生产(批号20181220),操作时均严格根据试剂盒内的说明书步骤逐步进行。ICP 监测设备为德国Spiegelberg GmbH&Co.KG 生产的HDM29.1 型颅内压监测仪及颅内监测压探头。
2.2.3 NIHSS 评分检测 对两组患者入组时NIHSS评分实施检测,量表共包含13 个条目,总分42 分,分值越高,表示患者神经功能缺损情况越严重[8]。
2.3 统计学方法 应用SPSS 21.0 统计软件对数据实施统一分析,计量数据运用均数±标准差() 表示,组间均数比较采用单因素方差分析,两两比较的P 值采用Bonferroni 法矫正。指标间的相关性分析应用Spearman 法检验,P<0.05 为差异有统计学意义。
3 结果
3.1 两组患者一般资料比较 观察组患者45 例,其中男25 例(55.56%),女20 例(44.44%),年龄21~68(45.34±2.44)岁;发病至入院时间1~6(3.22±0.41)h;致伤原因:交通事故19 例,高处坠落15 例,跌倒伤11 例;CT 显示:硬膜下出血19 例,硬膜外血肿13例,脑挫裂伤或脑内血肿13 例。对照组患者30 例,其中男16 例(53.33%),女14 例(46.67%),年龄22~65(41.57±1.34)岁。观察组和对照组的性别以及年龄等一般资料比较,差异均无统计学意义(P>0.05)。
3.2 两组患者脑脊液NSE、S100β 及ICP 水平比较观察组入院第7 天脑脊液NSE、S100β 及ICP 水平明显低于治疗前,差异有统计学意义(P 均<0.05),对照组入院第1、7 天差异无统计学意义(P>0.05)。观察组入院第1、7 天脑脊液NSE、S100β 及ICP 水平明显高于对照组(P 均<0.05),见表1。
表1 颅脑损伤患者与非颅脑损伤患者入院第1、7 天脑脊液NSE、S100β 及ICP 水平比较()
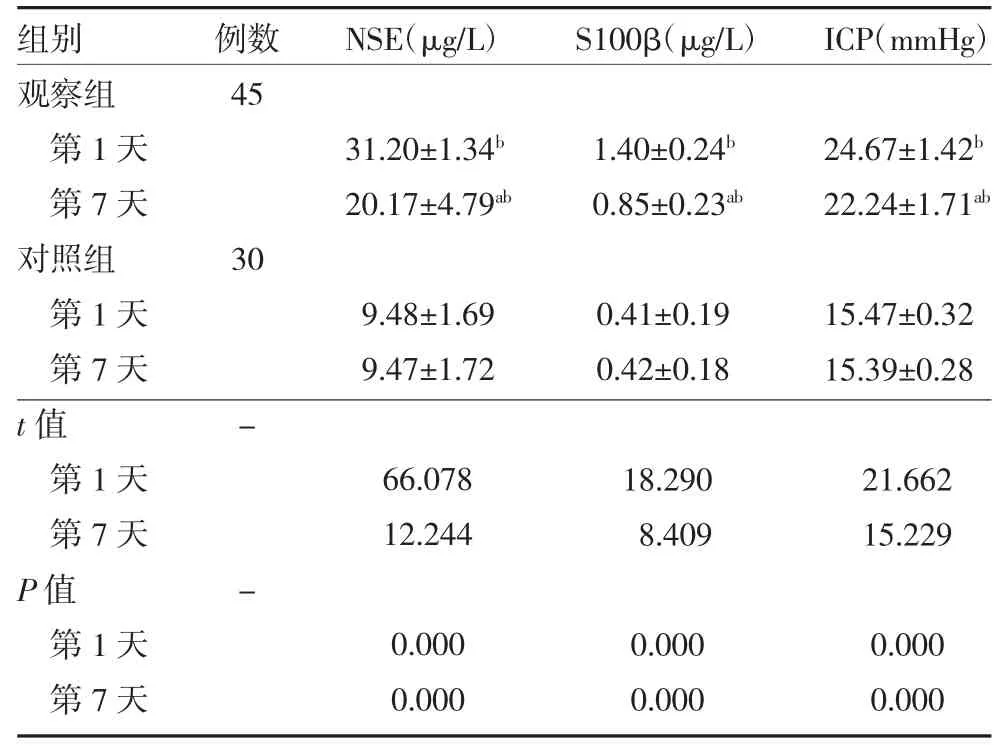
表1 颅脑损伤患者与非颅脑损伤患者入院第1、7 天脑脊液NSE、S100β 及ICP 水平比较()
注:观察组为颅脑损伤患者,脑脊液NSE、S100β 存在异常;对照组为同期住院的非颅脑损伤患者,脑脊液常规检查均在正常参考范围;NES 为神经元特异性烯醇化酶;S100β 为星形胶质源性蛋白;ICP 为颅内压;1mmHg=0.133kPa;与本组治疗第1 天比较,aP<0.05;与对照组同期比较,bP<0.05
3.3 不同ICP 程度颅脑损伤患者脑脊液NSE 及S100β 水平比较 ICP 中、重度升高组患者的脑脊液NSE 及S100β 水平均分别明显高于ICP 轻度升高组,ICP 重度升高组又明显高于ICP 中度升高组,差异有统计学意义(P 均<0.05),见表2。
表2 不同ICP 程度颅脑损伤患者脑脊液NSE及S100β 水平比较(μg/L,)
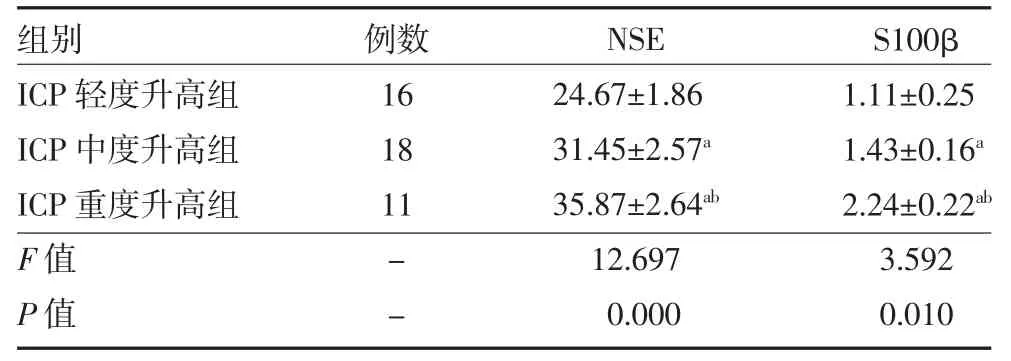
表2 不同ICP 程度颅脑损伤患者脑脊液NSE及S100β 水平比较(μg/L,)
注:NES 为神经元特异性烯醇化酶;S100β 为星形胶质源性蛋白;ICP为颅内压;与ICP 轻度升高组比较,aP<0.05;与ICP 中度升高组比较,bP<0.05
3.4 不同NIHSS 评分颅脑损伤患者脑脊液NSE 及S100β 水平比较 NIHSS 评分10~19 分、>19 分患者脑脊液NSE 及S100β 水平均明显高于NIHSS 评分<10 分患者,>19 分患者脑脊液NSE 及S100β 水平明显高于10~19 分患者,差异有统计学意义(P 均<0.05),见表3。
表3 不同NIHSS 评分颅脑损伤患者脑脊液NSE 及S100β水平比较(μg/L,)
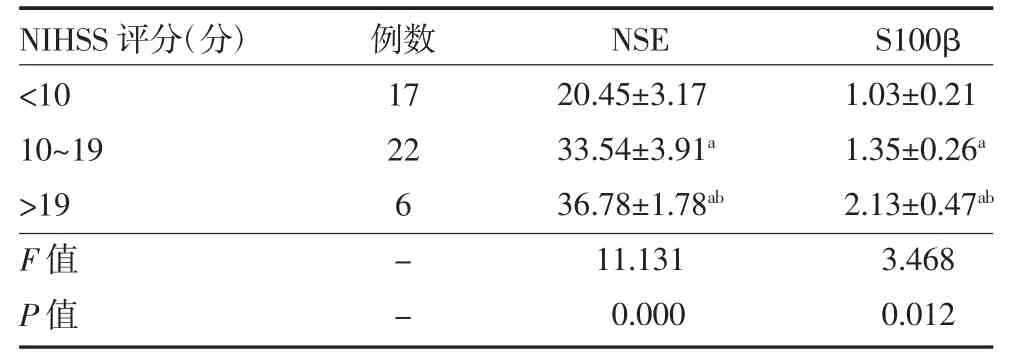
表3 不同NIHSS 评分颅脑损伤患者脑脊液NSE 及S100β水平比较(μg/L,)
注:NES 为神经元特异性烯醇化酶;S100β 为星形胶质源性蛋白;NIHSS 为美国国立卫生研究院卒中量表;与NIHSS<10 分比较,aP<0.05;与NIHSS10~19 分比较,bP<0.05
3.5 颅脑损伤患者ICP 及NIHSS 评分与脑脊液NSE 及S100β 水平相关性分析 根据Spearman 法对指标间的相关性分析后发现,颅脑损伤患者ICP与脑脊液NSE 及S100β 水平均呈正相关(r=0.664、0.679,P 均<0.05)。患者NIHSS 评分与脑脊液NSE及S100β 水平均呈正相关(r=0.699、0.711,P 均<0.05)。
4 讨论
颅脑损伤患者因脑组织的原发及继发性损伤可导致颅内高压,从而引起脑组织代谢、脑灌注的持续恶化,若不施加有效的治疗措施,往往预后不佳[9-10]。ICP 监测对颅脑损伤的疾病进展提供了客观依据,根据ICP 监测及时采取有效的治疗措施,对于预防颅内微环境持续恶化具有积极意义[11]。目前对颅脑损伤患者实施ICP 监测在临床中已广泛应用,但ICP 监测需要术者具备严格的无菌观念及操作规范,否则会导致穿刺部位出血、颅神经损伤、脑脊液漏等并发症,因此临床上需要寻求对颅脑损伤严重程度判断更简捷、更全面、更安全的监测指标。
本文结果显示,组内比较,治疗7 天后观察组的脑脊液NSE、S100β 及ICP 水平均明显低于干预前(P 均<0.05),而对照组第1 天和第7 天的差异无统计学意义(P>0.05)。组间比较,观察组治疗第1 天与治疗7 天后的脑脊液NSE、S100β 及ICP 水平均明显高于对照组(P 均<0.05)。上述结果提示了颅脑损伤患者脑脊液NSE、S100β 及ICP 水平在入院时均明显上升,治疗后虽然三者的水平均有明显的下降趋势,但仍保持在较高的水平。分析原因,可能与三种指标在机体的作用机制有关。NSE 是独属于神经内分泌细胞和神经元的一种蛋白酶,当患者神经细胞受损之后,从损伤的神经元细胞内释放出呈游离状态的NSE,首先进入脑脊液中,并且能跨越血脑屏障进入外周血循环,从而导致其在脑脊液及血液中的水平明显上升[12],因此NSE 作为神经元细胞损害的标志酶,具有高度的敏感性和特异性[13]。S100β是一种主要位于中央(主要是星形胶质细胞)和周围神经系统的神经胶质细胞中的酸性糖蛋白,在细胞损伤或应激活化时释放,经由血脑屏障而进入到外周血内,能反映神经元细胞、胶质细胞损伤情况[14]。通过在脑室放置ICP 监测探头提示严重的颅脑损伤后ICP 水平可明显上升,而患者在经过手术干预或药物治疗后,ICP 水平可明显下降,颅内损伤症状改善,因此NSE 和S100β 水平均明显下降。本研究还发现,ICP 中、重度升高组患者的脑脊液NSE 及S100β 水平均分别明显高于ICP 轻度升高组,而ICP 重度升高组又明显高于ICP 中度升高组(P 均<0.05),NIHSS评分>19 分及NIHSS 评分10~19 分患者的脑脊液NSE 及S100β 水平均分别明显高于NIHSS 评分<10分患者,而>19 分患者的脑脊液NSE 及S100β 水平均明显高于10~19 分患者(均P<0.05),这充分提示了随着ICP 水平及NIHSS 评分的上升,颅脑损伤患者脑脊液NSE 及S100β 水平也明显上升。进一步根据Spearman 法对指标间的相关性分析后发现,患者ICP 及NIHSS 评分分别与脑脊液NSE 及S100β 水平均呈正相关(均P<0.05)。这也证实了颅脑损伤患者的脑脊液NSE 及S100β 水平变化与其ICP 及NIHSS 评分具有紧密联系。究其原因,主要可能是因为颅脑损伤的严重程度决定了有关神经细胞的损伤情况,脑组织损伤范围越广,神经细胞被破坏越多,则释放入脑脊液的NSE 及S100β 含量也更高。这与刘瑞峰等[15]的报道结果相似。
综上所述,颅脑损伤后患者的脑脊液NSE 及S100β 水平明显上升,且二者与患者的ICP 及NIHSS 评分均呈正相关,临床上可通过监测患者的脑脊液NSE 及S100β 水平来反映颅脑损伤的严重程度,值得给予关注。
