补肾抗衰片对动脉粥样硬化模型血管周围脂肪炎症的实验研究*
2020-06-23王铭扬仲爱芹许晓敏李艳阳谢盈彧王爱迪田立俊张军平王清泉
王铭扬,仲爱芹,熊 鑫,许晓敏,李艳阳,辛 颖,张 宁,谢盈彧,王爱迪,田立俊,张军平,王清泉
(1.天津中医药大学,天津 301617;2.天津中医药大学第一附属医院,天津 300193)
血管周围脂肪组织(PVAT)指仅附着于血管外膜层的脂肪组织,主要由脂肪细胞、成纤维细胞、肥大细胞以及神经细胞等构成,围绕着除脑血管外的全身各处血管(大到主动脉,小到真皮层微血管),尤其是冠状动脉和主动脉[1]。目前研究认为,PVAT是一种在形态和功能上均不同于皮下脂肪及内脏脂肪的新的脂肪组织,除了具有保护性生理功能外,也有病理性特性[2]。在病理状态下,通过改变自身的内分泌、旁分泌功能,改变血管壁的结构和功能,参与如动脉粥样硬化(AS)的发生[3-4]。在AS发生发展过程中,血管壁的炎症反应是主要机制之一[5],而PVAT与血管外膜之间不存在解剖学屏障,可以分泌多种介质(脂肪因子和细胞因子)参与血管壁的炎性反应。其中脂肪因子如瘦素、脂联素等,细胞因子如肿瘤坏死因子-α(TNF-α)、白介素(IL)-6、IL-10、基质金属蛋白酶(MMPS)、单核细胞趋化蛋白-1(MCP-1)、血浆纤溶酶原激活物抑制物(PAI-1)等[6],这些因子通过直接浸润的旁分泌途径,直接进入动脉内,或通过滋养血管分泌途径“由外到内”作用于动脉管壁的各层细胞(外膜成纤维细胞、中膜平滑肌细胞、内膜内皮细胞),调节他们的生长、凋亡、基质蛋白分泌、功能状态及其他表型,参与AS的发生发展[7-9]。对其深入研究,可能为AS相关性疾病的治疗提供新靶点。补肾抗衰片临床应用30余年来,治疗AS相关性疾病疗效确切[10-11],团队前期动物实验结果表明,其具有较好抗AS效果[12-14],但作用机制尚未完全明确。因此,本研究建立AS模型,以补肾抗衰片为干预药物,观察其对PVAT组织的影响,进而检测相关炎症因子的表达,探讨其是否对PVAT炎症的表达具有抑制作用。
1 材料与方法
1.1 药品 补肾抗衰片(组成:丹参、夏枯草、何首乌、茯苓、党参、菟丝子、桑寄生等),每片0.5 g,天津中医药大学第一附属医院院内制剂。阿托伐他汀钙片,每片10 mg,辉瑞制药有限公司生产,批号:国药准字H20051407。
1.2 试剂 Anti-TNF-α抗体(MR0604,UCallM 公司);Anti-Leptin抗体(ab16227,Abcam 公司);Anti-MMP-9抗体 (MAB3309,Merck公司);Goat anti Mouse IgG(H+L)-HRP(SA-2011H,UCallM 公司);Goat anti Rabbit IgG (H+L)-HRP(SA-2021H,UCallM公司);DAB显色试剂盒(AR1022,博士德生物工程有限公司)。
1.3 模型制备及分组给药 清洁级健康雄性新西兰兔 24 只,体质量(2.2±0.2)kg,购于北京维通利华实验动物技术有限公司(动物许可证号:SCXK京2010-0002)。将其随机分为对照组、模型组、补肾抗衰组、阿托伐他汀组。采用高脂饲养法复制AS模型,对照组给予普通饲料,其余各组持续予高脂饲料(1.5%胆固醇+5%猪油+9%蛋黄粉+0.2%胆酸+84.3%普通饲料,购于北京科奥协力饲料有限公司)喂养同时,两给药组于4周后分别给予补肾抗衰片1.0 g/(kg·d)(片剂质量)、阿托伐他汀钙片5 mg/(kg·d)(片剂质量)[15],连续干预8周。
1.4 取材及病理形态学检测 末次给药后,禁食12 h(正常饮水),各组动物麻醉、固定,心脏灌注后取附着PVAT的胸主动脉,石蜡包埋、切片后行苏木精-伊红(HE)染色,观察主动脉病理形态学变化,采用Image-pro plus图像分析软件分析,每个目标血管各取6张切片,每张切片取1个血管环均测量2次取平均值,最后计算6个血管环所得的数据均值作为该标本的最终数值。计算参数如下:1)内膜增生面积=内弹力层围绕面积(IELA)-血管环管腔横截面积(LA);2)中膜面积=外弹力层围绕面积(EELA)-IELA;3)内中膜比值(IMR)=内膜增生面积/中膜面积,反映内膜增生程度。
观察PVAT脂肪细胞的形态学变化,用Imagepro plus图像软件分析系统测量脂肪细胞的大小(直径)。每张切片在10×40倍镜下,随机取3个视野,测量该视野内全部完整脂肪细胞直径,计算平均值作为最终数值。
1.5 免疫组织化学染色法检测 主动脉及血管外周脂肪组织TNF-α、瘦素、基质金属蛋白酶-9(MMP-9)表达石蜡切片脱蜡至蒸馏水,灭活内源性过氧化物酶,抗原微波修复,5%BSA封闭液封闭30 min,不洗,滴加Ⅰ抗(抗体稀释比例分别为:TNF-α 1∶50、Leptin 1∶500、MMP-9 1∶500),4 ℃孵育过夜,复温,磷酸缓冲盐溶液(PBS)洗5次,每次5 min,滴加Ⅱ抗,孵育 30 min,孵育SABC30min,DAB 显色 5~10min,苏木精复染,脱水、透明后封片。光镜下观察,阳性表达为出现黄褐色颗粒,随机选取5个互不重叠的视野,用Image-Pro Plus软件,测量胸主动脉内膜阳性染色面积占内膜面积百分数及PVAT组织阳性染色面积。
1.6 统计学方法 采用SPSS 20.0软件进行分析,实验数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 观察各组动物的一般情况(皮毛、精神状态、反应、饮食、粪便等),称量体质量变化,剔除进食不佳、状态不好及血脂不稳定者。
2.2 补肾抗衰片对AS模型兔主动脉内膜病理学的影响 见图1。对照组主动脉内膜层薄、完整、连续,内皮细胞排列整齐,没有斑块。模型组内膜明显增厚,不连续甚至缺失,大量泡沫细胞堆积在整个管腔内部,向管腔内凸起,大量平滑肌细胞移行至内膜下或可见泡沫细胞及脂质沉积于内膜下形成脂质核心。与模型组比较,阿托伐他汀组和补肾抗衰片组中内膜增生程度均不同程度的下降,差异有统计学意义(P<0.01,P<0.05)。见表 1。

图1 AS模型主动脉病理形态学改变(HE染色×100)Fig.1 Pathological of aorta in AS model(HE staining×100)
表1 各组动物主动脉内/中膜面积比(±s)Tab.1 Ratio of aortic neointima to media area in each group(±s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 动物数 I M R对照组 6 0.0 7±0.0 2模型组 6 1.8 2±0.1 2*阿托伐他汀组 6 0.9 4±0.0 9##补肾抗衰片组 6 1.5 2±0.2 3#
2.3 补肾抗衰片对AS模型兔PVAT脂肪细胞病理形态学的影响 见图1。对照组PVAT由大量群集的单泡脂肪细胞构成,呈蜂窝状结构,空泡状排列规则,细胞质、细胞核位于细胞一侧。脂肪细胞直径从小到大依次是:对照组、阿托伐他汀组、补肾抗衰片组、模型组。与对照组比较,模型组脂肪细胞直径增大,差异有统计学意义(P<0.05);与模型组比较,两给药组细胞直径均有不同程度的减小,但差异无统计学意义(P>0.05)。见表 2。
2.4 补肾抗衰片对AS模型主动脉及血管外周脂肪组织炎症的影响
2.4.1 TNF-α免疫组化染色结果 对照组主动脉内未见黄褐色颗粒表达,模型组增生的内膜中可见大量深褐色颗粒表达;与模型组比较,两给药组阳性颗粒表达面积均不同程度的减小,差异有统计学意义(均为 P<0.05),见图 2、表 3。
表2 各组动物PVAT脂肪细胞直径(±s)Tab.2 PVAT fat cell diameter in each group(±s) μm

表2 各组动物PVAT脂肪细胞直径(±s)Tab.2 PVAT fat cell diameter in each group(±s) μm
注:与对照组比较,*P<0.05。
组别 动物数 直径对照组 6 258.75±86.28模型组 6 380.00±63.36*阿托伐他汀组 6 295.50±88.90补肾抗衰片组 6 311.25±62.11

图2 各组动物主动脉TNF-α免疫组化染色结果(×100)Fig.2 Immunohistochemical staining results of TNF-α in aorta of each group(×100)
表3 各组动物主动脉、血管周围脂肪组织TNF-α蛋白表达情况(±s)Tab.3 Expression of TNF-α protein in the aorta and PVAT of each group(±s)
表3 各组动物主动脉、血管周围脂肪组织TNF-α蛋白表达情况(±s)Tab.3 Expression of TNF-α protein in the aorta and PVAT of each group(±s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05。
组别 动物数对照组 6模型组 6阿托伐他汀组 6补肾抗衰片组 6面积比百分数(%)0.0 0±0.0 0 3 4.5 8±5.5 6 2 0.7 6±5.4 1#2 1.9 6±6.2 8#面积1 7 0 3 2± 6 5 8 9.4 8 4 8 4 3 5±1 0 2 7 3.3 2*2 7 3 2 2±1 0 3 5 5.8 7#3 0 9 7 0± 8 0 5 4.1 3#
对照组PVAT脂肪细胞膜可见少量黄褐色颗粒表达。与对照组比较,模型组可见大量深褐色颗粒表达,差异有统计学意义(P<0.01)。与模型组比较,两给药组阳性颗粒表达面积均有不同程度的减小,差异有统计学意义(均为 P<0.05),见图 3、表 3。

图3 各组动物血管周围脂肪组织TNF-α免疫组化染色结果(×100)Fig.3 Immunohistochemical staining results of TNF-α in PVAT tissues of each group(×100)
2.4.2 瘦素免疫组化染色结果 对照组主动脉内膜可见少量黄色颗粒表达。与对照组比较,模型组内膜可见大量深褐色颗粒表达,融合成片,差异有统计学意义(P<0.01)。与模型组比较,两给药组阳性颗粒表达面积均有不同程度的减小,差异有统计学意义(P<0.01,P<0.05),见图 4、表 4。
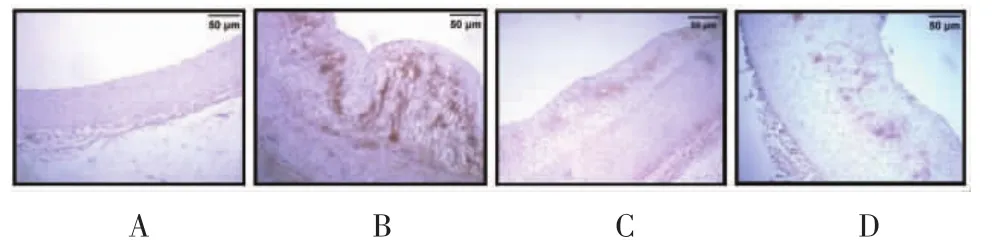
图4 各组动物主动脉瘦素免疫组化染色结果(×100)Fig.4 Immunohistochemical staining results of leptin in aorta of each group(×100)
表4 各组动物主动脉、血管周围脂肪组织瘦素蛋白表达情况(±s)Tab.4 Expression of aorticand PVAT leptin protein in each group(±s)
表4 各组动物主动脉、血管周围脂肪组织瘦素蛋白表达情况(±s)Tab.4 Expression of aorticand PVAT leptin protein in each group(±s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 动物数对照组 6模型组 6阿托伐他汀组 6补肾抗衰片组 6面积比百分数(%)8.1 4±1.5 4 5 4.7 9±2.3 5*1 7.7 5±2.1 5##3 7.5 0±1.0 2#面积2 5 7 4.0 0±1 5 1 1.3 0 4 9 5 4 2.3 3±2 0 3 7.4 7*2 1 5 7 4.3 3±4 2 6 0.9 5##2 4 9 5 9.3 3±2 3 8 6.9 2##
对照组PVAT脂肪细胞膜可见少量黄色颗粒表达。与对照组比较,模型组PVAT脂肪细胞膜可见大量深褐色颗粒,差异有统计学意义(P<0.01)。与模型组比较,两给药组阳性颗粒表达面积均有不同程度的减小,差异有统计学意义(均为P<0.01)。见图5、表 4。
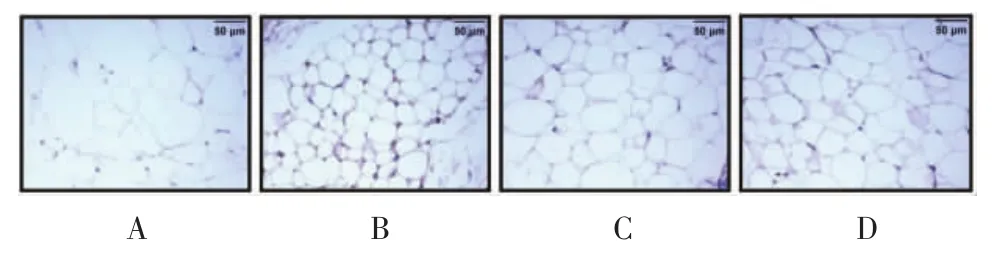
图5 各组动物血管周围脂肪组织瘦素免疫组化染色结果(×100)Fig.5 Immunohistochemical staining results of leptin in PVAT of each group(×100)
2.4.3 MMP-9免疫组化染色结果 对照组主动脉内膜未见明显褐色颗粒。与对照组比较,模型组增生的内膜中可见大量阳性表达,呈深褐色,差异有统计学意义(P<0.01)。与模型组比较,两给药阳性颗粒表达面积均有不同程度减小,差异有统计学意义(为 P<0.05),见图 6、表 5。
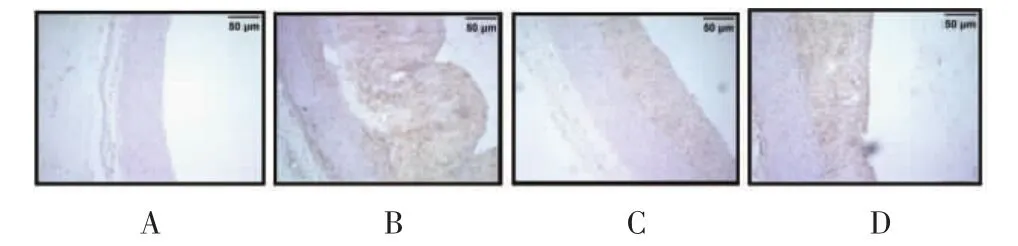
图6 各组动物主动脉MMP-9免疫组化染色结果(×100)Fig.6 Results of MMP-9 immunohistochemical staining of aorta in each group(×100)
表5 各组动物主动脉、血管周围脂肪组织MMP-9蛋白表达情况(±s)Tab.5 Expression of MMP-9 protextaand PVAT of each group(±s)
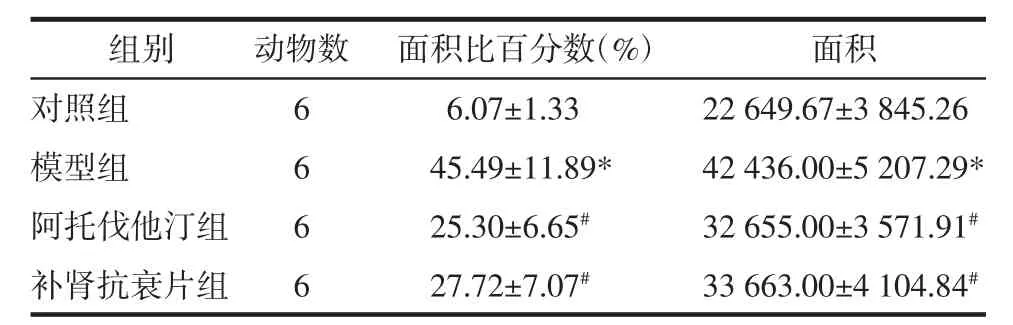
表5 各组动物主动脉、血管周围脂肪组织MMP-9蛋白表达情况(±s)Tab.5 Expression of MMP-9 protextaand PVAT of each group(±s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.05。
组别 动物数对照组 6模型组 6阿托伐他汀组 6补肾抗衰片组 6面积比百分数(%)6.0 7±1.3 3 4 5.4 9±1 1.8 9*2 5.3 0±6.6 5#2 7.7 2±7.0 7#面积2 2 6 4 9.6 7±3 8 4 5.2 6 4 2 4 3 6.0 0±5 2 0 7.2 9*3 2 6 5 5.0 0±3 5 7 1.9 1#3 3 6 6 3.0 0±4 1 0 4.8 4#
对照组PVAT脂肪细胞膜可见少量黄色颗粒表达。与对照组比较,模型组PVAT脂肪细胞膜可见大量深褐色颗粒表达,差异有统计学意义(P<0.01)。与模型组比较,两给药组阳性颗粒表达面积均有不同程度减小,差异有统计学意义(P<0.05),见图 7、表5。

图7 各组动物血管周围脂肪组织MMP-9蛋白免疫组化染色(×100)Fig.7 Immunohistochemical staining of MMP-9 protein in PVAT tissues of each group(×100)
3 讨论
血管周围脂肪组织一直被认为是保护和支撑血管的一类脂肪组织。近年来,越来越多的实验研究证实,PVAT是一层贴近血管外膜层的脂肪组织,对AS的形成起双向作用。在生理条件下,PVAT具有抗炎、维持血管稳态,抑制AS发生[16];病理状态下,PVAT功能障碍,脂肪细胞数量增多、体积增大,功能失调,细胞成分和分子特性改变,释放大量的促炎性因子(如抵抗素、瘦素)、细胞因子(如TNF-α、IL-6) 和 趋 化 因 子 (RANTES/CCL5、MCP-1/CCL2),而抗炎性脂肪因子(如脂联素)产生减少[17]。本研究观察了AS模型主动脉及PVAT脂肪细胞病理形态学的变化,结果表明,补肾抗衰片可以改善AS模型PVAT巨噬细胞浸润情况,并在一定程度上减少脂肪细胞直径,提示其具有抑制PVAT炎症状态的作用,故后续实验进一步研究其对相关炎症因子(TNF-α、瘦素、MMP-9)表达的影响。
TNF-α和瘦素是PVAT分泌的炎性脂肪因子。当炎症发生时,巨噬细胞和脂肪细胞分泌大量炎性脂肪因子,而炎性脂肪因子又能够反过来加剧PVAT组织和血管炎症,使得PVAT组织和血管炎症越来越严重[18]。MMP-9是一种主要表达于巨噬细胞的蛋白酶,正常情况下表达量极少。在AS中,主要通过降解细胞外基质(ECM),增加血管内皮通透性,使脂质、炎症细胞等更易进入血管壁,刺激平滑肌细胞(VSMC)增殖和迁移,VSMC产生和分泌大量ECM,形成纤维帽;随着AS发展,MMP-9的表达明显增加,降解大量ECM,并影响VSMC凋亡,使斑块不稳定及破裂[19]。本研究观察了AS模型主动脉及血管周围脂肪组织瘦素、TNF-α、MMP-9的表达,结果表明,补肾抗衰片可以通过抑制TNF-α、瘦素、MMP-9的表达,对AS模型血管周围脂肪炎症起到抑制作用。
