子宫内膜息肉摘除术后两种内膜准备方案临床结局的比较
2020-06-23徐嘉聆苏玮珏陈宇锋付养华习海涛赵军招
徐嘉聆,苏玮珏,陈宇锋,付养华,习海涛,赵军招
(温州医科大学附属第二医院育英儿童医院 生殖中心,浙江 温州 325027)
子宫内膜息肉是常见的子宫内膜良性病变之一,表现为子宫内膜的腺体以及血管周围基质的局部过度增生。子宫内膜息肉患者中,36.1%的育龄患者和44.4%的绝经后患者无明显症状[1]。有症状的患者常表现为子宫异常出血、腹痛,甚至不孕等。宫腔镜下子宫内膜息肉摘除术是其首选治疗方法。中国专家共识认为,实施辅助生殖技术(assisted reproductive technology,ART)前持续存在的子宫内膜息肉需及时行宫腔镜手术摘除,并在术后尽快接受ART治疗[2]。但对于息肉摘除术后,国内外尚未见对其不同内膜准备方案患者妊娠结局是否有影响的文献报道。本研究回顾性分析了子宫内膜息肉摘除术后3个月内,采用促性腺激素释放激素激动剂降调节激素替代治疗(gonadotropinreleasing hormone agonist+hormone replacement therapy,GnRH-a+HRT)方案或者激素替代治疗(hormone replacement therapy,HRT)方案行内膜准备的患者冻融胚胎移植后的妊娠结局,以比较2种内膜准备方案在子宫内膜息肉摘除患者中应用的临床结局。
1 对象和方法
1.1 对象 回顾性分析2018年7月至2019年7月于温州医科大学附属第二医院育英儿童医院生殖中心接受GnRH-a+HRT方案或者HRT方案进行子宫内膜准备的冻融囊胚移植患者共109例。HRT方案(HRT组)56例,GnRH-a+HRT方案(GnRH-a+HRT组)患者53例。纳入标准:①年龄≤40岁;②3个月内曾行宫腔镜下子宫内膜息肉摘除术;③移植1~2个冻融囊胚;④移植周期≤2个。排除标准:①宫腔粘连;②重度子宫腺肌症;③子宫黏膜下肌瘤或子宫肌瘤压迫宫腔;④子宫畸形;⑤其他不适宜胚胎移植的因素。所有患者均签署知情同意书,本研究经医院伦理委员会批准。
1.2 方法
1.2.1 子宫内膜准备:2组患者均于3个月内曾行宫腔镜下子宫内膜息肉摘除术,月经周期第3~第5天行经阴道超声检查,排除子宫内膜息肉后行内膜准备方案。
1.2.2 2组治疗方案:HRT组的方案:月经周期第3~第5天给予芬吗通(雌二醇片/雌二醇地屈孕酮片复合包装,红片含2 mg雌二醇,黄片含2 mg雌二醇和 10 mg地屈孕酮,荷兰雅培制药有限公司),即红片1片,2次/d,连续4 d;随后红片1片,3次/d,连续4 d。 在月经周期11~15 d监测子宫内膜情况与血清孕激素水平。当超声显示子宫内膜厚度≥7 mm且血清孕酮<1.1 ng/mL时开始内膜转化,采用芬吗通红片和黄片各1片,2次/d,同时给予安琪坦(黄体酮软胶囊,法国法杏制药厂)200 mg口服或阴道给药,2次/d;或雪诺酮(8%黄体酮阴道缓释凝胶,德国默克雪兰诺有限公司)阴道给药1支/d,5 d后行冻融胚胎移植。GnRH-a+HRT组的方案:月经周期第3~第5天皮下注射1支达必佳(长效醋酸曲普瑞林,德国辉凌制药有限公司),28~32 d后经阴道超声检查,若子宫内膜厚度<5 mm认为降调充分,采用激素替代方案和黄体支持及囊胚移植均同HRT组。
1.2.3 冻融胚胎移植:转化当日行阴道B超检查,记录子宫内膜厚度、类型、均质性以及宫腔积液情况。子宫内膜类型按Gonen阴道B超检查子宫内膜形态学分类法分类,记录为A型、B型、C型。C型或非均匀的子宫内膜为子宫内膜息肉复发可疑。根据患者冷冻胚胎以及既往情况解冻1~2个囊胚行冻融囊胚移植。优质囊胚[3]:Gardner评分标准中3期及3期以上且内细胞团和滋养层评分不含C级的囊胚。
1.2.4 妊娠结局:胚胎移植后14 d检测血清HCG水平以确定有无妊娠。临床妊娠:胚胎移植后4周经超声检查发现宫内有孕囊;血清HCG一过性升高以后迅速下降至正常水平,超声检查无孕囊为生化妊娠;经超声检查子宫体腔以外发现孕囊为异位妊娠;妊娠12周内自然流产为早期流产。
1.2.5 观察指标:比较2组间患者的基本情况,包括年龄、BMI、不孕年限、不孕原因、既往移植次数、基础血清性激素。不孕原因包括输卵管积水、子宫腺肌症、子宫内膜异位症、肌壁间子宫肌瘤、多囊卵巢综合征(polycystic ovarian syndrome,PCOS)。基础血清性激素包括血清基础促卵泡刺激素(basal follicle-stimulating hormone,bFSH)、基础黄体生成素(basal luteinizing hormone,bLH)、基础雌激素(basal estrogen,bE2)、基础孕激素(basal progesterone,bP)。比较2组患者的子宫内膜情况以及移植情况,记录转化当日子宫内膜厚度、类型、均质性以及宫腔积液;比较周期取消率、囊胚移植个数、移植优质囊胚个数;比较2组间患者妊娠结局[4],包括HCG阳性率、胚胎着床率、临床妊娠率、早期流产率、多胎妊娠率。周期取消率=取消周期数/总纳入周期数;HCG阳性率= HCG阳性周期数/总移植周期数;临床妊娠率=临床妊娠周期数/总移植周期数;胚胎着床率=孕囊数/总移植胚胎数;早期流产率=早期流产周期数/临床妊娠周期数;多胎妊娠率=多胎妊娠周期数/临床妊娠周期数。
1.3 统计学处理方法 采用SPSS20.0软件进行统计学分析。正态性分布的计量资料用 ±s 表示,2组间比较用两独立样本t 检验;非正态性分布的计量资料用M(P25,P75)表示,2组间比较用Mann-Whitney U检验;计数资料采用百分比表示,2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者一般情况比较 2 组患者的年龄、BMI、不孕年限、既往移植次数、基础血清性激素差异均无统计学意义(P>0.05)。2组间输卵管积水、子宫腺肌症、子宫内膜异位症、肌壁间子宫肌瘤、PCOS患者数量差异无统计学意义(P>0.05),见表1。
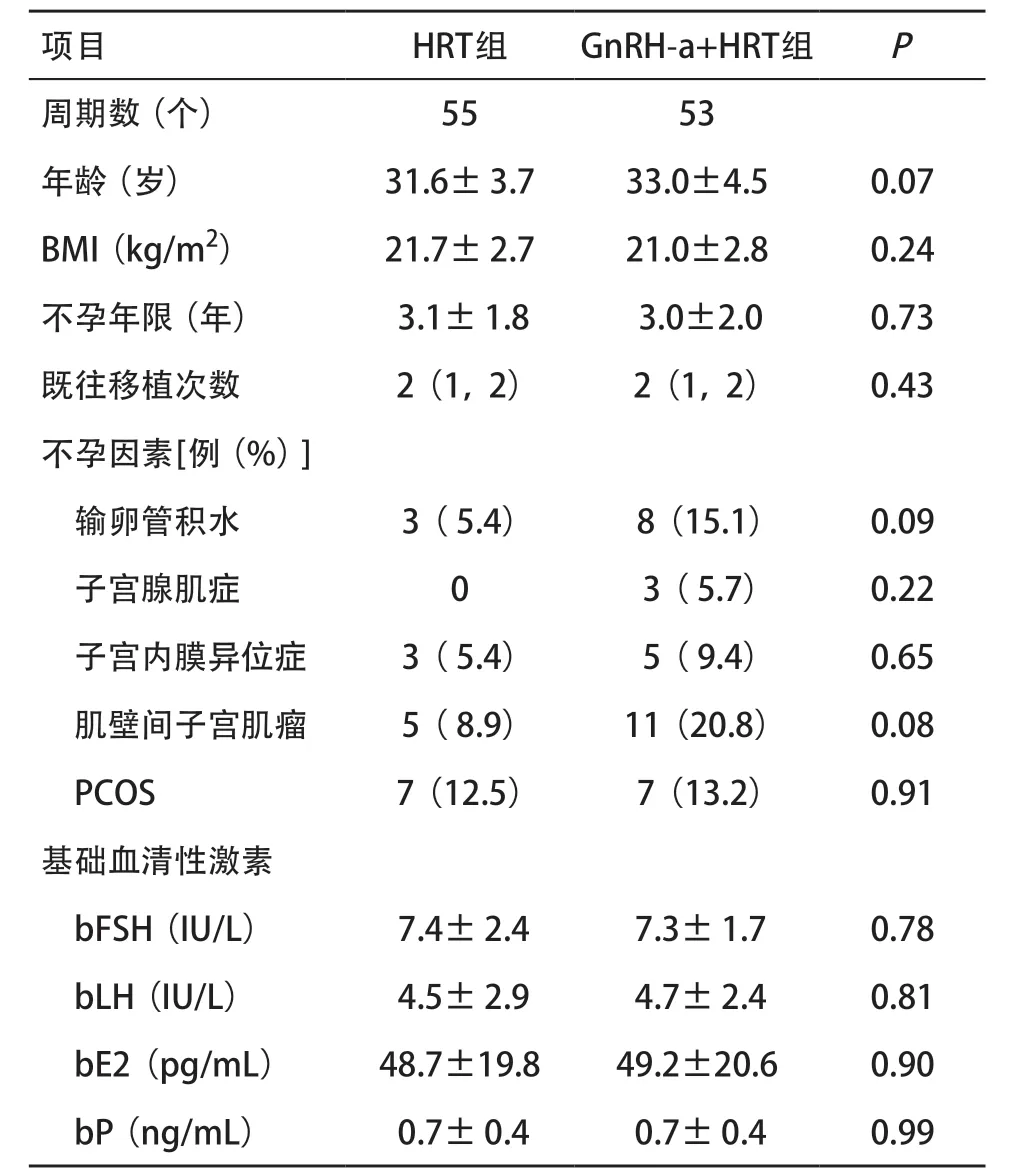
表1 2组患者一般情况比较
2.2 2 组患者移植情况比较 转化当日HRT组与GnRH-a组均有1例患者内膜呈C型,GnRH-a+HRT组有2例呈非均匀子宫内膜;HRT组1例患者移植前子宫内膜息肉复发,GnRH-a+HRT组3例患者子宫内膜息肉复发,2组差异无统计学意义(P>0.05)。2组患者子宫内膜厚度、类型、均质性以及宫腔积液差异均无统计学意义(P>0.05)。HRT组1例患者因妇科疾病原因取消移植,GnRH-a+HRT组无患者取消周期,2组差异无统计学意义(P>0.05)。2组囊胚移植个数以及优质囊胚移植个数差异均无统计学意义(P> 0.05),见表2。

表2 2组患者移植情况比较
2.3 2组患者妊娠结局比较 2组HCG阳性率、胚胎着床率、临床妊娠率、早期流产率、多胎妊娠率差异无统计学意义(P>0.05),见表3。HRT组有1例患者异位妊娠,GnRH-a+HRT组无患者异位妊娠。
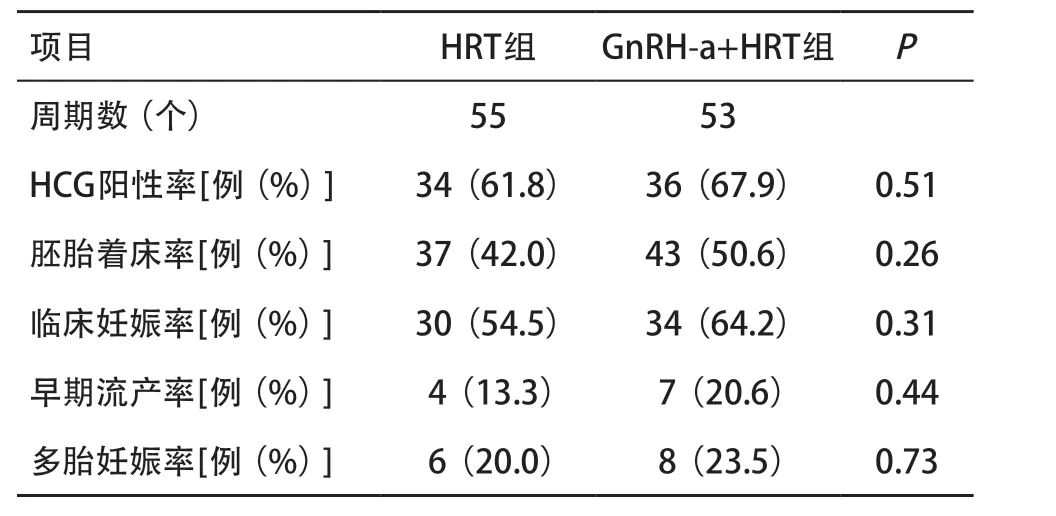
表3 2组患者妊娠结局比较
3 讨论
子宫内膜息肉可通过物理干扰、影响精子活动、影响与胚胎植入相关的分子释放等机制导致女性不孕[5]。宫腔镜子宫内膜息肉摘除术可以有效提高女性妊娠率。但是息肉摘除后可能很快复发,继续影响妊娠。因此,宫腔镜手术后尽早让女性成功妊娠尤为重要。国内外尚未见关于息肉摘除术后不同内膜准备方案对妊娠结局影响的相关报道。本研究首次比较了HRT方案与GnRH-a+HRT方案在子宫内膜息肉摘除术后患者内膜准备中的应用。HRT方案采用外源性雌孕激素序贯给药方法模拟了自然状态下内源性激素的周期变化,便于更准确地安排胚胎移植时间。但在卵泡早期,雌激素可能无法完全抑制垂体,导致内源性LH峰,造成提前排卵与黄素化,降低移植成功率。GnRH-a+HRT方案是在激素替代方案之前用GnRH-a充分抑制垂体功能,抑制自发排卵,使子宫内膜更易于接受外源性激素的调控,降低了周期取消率。但长效GnRH-a价格较高,且内膜准备时间较长,应用此方案前需要考虑这两点。
GnRH-a+HRT组中子宫内膜异位症、子宫腺肌症、肌壁间子宫肌瘤、PCOS或输卵管积水的患者更多,子宫内膜息肉复发的患者也较HRT组多。但GnRHa+HRT组HCG阳性率仍高于HRT组,胚胎着床率比HRT组高8.6%,临床妊娠率比HRT组高9.7%,虽然尚无统计学意义,但可为临床提供一定的参考意见。无统计学意义的原因可能与样本量较小有关。子宫内膜异位症[6-7]、子宫腺肌症[8]、肌壁间子宫肌瘤[8-9]、 PCOS[10]、输卵管积水[11]会通过各种途径影响子宫内膜环境,造成内膜与胚胎发育的失同步化,严重影响妊娠结局。GnRH-a可以促进子宫内膜胞饮突发育[12],恢复子宫内膜的生理分泌并改善内膜容受性。同时,GnRH-a通过磷酸化、细胞因子调节局部炎症反应,利于胚胎着床[13]。在我院新鲜胚胎移植周期中,将GnRH-a应用于子宫内膜异位症、输卵管积水、卵巢储备功能低下、PCOS的患者中得到了令人鼓舞的临床结局[14]。因此对于患有这些疾病的冷冻胚胎移植患者,GnRH-a+HRT同样可以作为首选的内膜准备方案。
HRT方案与GnRH-a+HRT方案在子宫内膜息肉摘除术后作为FET中的内膜准备方案均能获得较好的妊娠结局,临床使用应遵循个体化治疗方案。
