复合酶辅助高压法提取金针菇黄酮的纯化及活性测定
2020-06-23王广慧谭吉丽杜艳超杨静怡尚雅楠任丽娜
王广慧,谭吉丽,杜艳超,杨静怡,尚雅楠,任丽娜
(绥化学院食品与制药工程学院,黑龙江绥化 152061)
金针菇(FLammuLina veLutipes(Fr.)Sing)属于典型的木腐生菌类,口感香脆滑嫩、味道鲜美,而且含有多种生物活性物质如多糖、黄酮类化合物和其他免疫调节蛋白等,其中金针菇黄酮在抗氧化、抗肿瘤、抗诱变和改善记忆等方面具有明显功效(谭一罗等,2018),可开发为人及动物的保健食品。大孔吸附树脂因其具有理化性质稳定,不溶于强酸、强碱和有机溶剂中,对有机物选择性好,不受无机盐等离子和低分子化合物影响,节省费用等诸多优点,常被用于天然产物中有效成分的分离及纯化,但目前对大孔树脂纯化金针菇黄酮的研究报道较少。王广慧(2016)对复合酶辅助高压法提取金针菇黄酮的工艺条件进行了优化研究,本文将在此基础上继续探讨利用此法提取的金针菇黄酮经X-5型大孔树脂纯化后的抑菌性及抗氧化性问题,并对X-5型大孔树脂纯化金针菇黄酮的最佳工艺条件进行优化,以期能为金针菇黄酮的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂 金针菇、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌 (Staphylococcus aureus)、沙门氏菌(salmonella enteritidis),由绥化学院微生物实验室提供;X-5型大孔吸附树脂,购自郑州勤实科技有限公司;亚硝酸钠、硝酸铝、乙醇、氢氧化钠等化学试剂均为国产分析纯,购自天津市博迪化工有限公司;木瓜蛋白酶、纤维素酶,购自北京奥博星生物科技有限责任公司。
1.2 主要仪器 HL-2型恒流泵,上海青浦沪西仪器厂;752型紫外-可见分光光度计,上海菁华科技仪器有限公司;TGL-20bR型冷冻离心机,上海安亭科学仪器厂;PHS-25酸度计,上海伟业仪器厂;YXQ-LS-75SⅡ型立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;FW100型高速万能粉碎机,天津市泰斯特仪器有限公司;普通玻璃层析柱(16 mm×240 mm),上海青浦沪西仪器厂;牛津杯(内径6 mm),上海鲁硕实业有限公司;ZD-85型气浴恒温振荡器,江苏省金坛市荣华仪器制造有限公司。
1.3 试验方法
1.3.1 黄酮含量的测定 采用硝酸铝-亚硝酸钠法测定金针菇中黄酮的含量。标准曲线的绘制及线性回归方程的获得参见王广慧(2016)报道的方法。
1.3.2 复合酶辅助高压法提取金针菇黄酮 将金针菇干品用高速万能粉碎机粉碎,过80目筛。称取金针菇干粉,放入锥形瓶中,按照 1:35(g/mL)的料液比加入pH为6的磷酸氢二钠-柠檬酸缓冲液和样品量1.00%的复合酶 (木瓜蛋白酶和纤维素酶按质量比1:1混合)。将锥形瓶放入50℃恒温水浴锅中酶解80 min。然后在115℃下进行高压热水浸提40 min。提取后以3500 r/min离心处理10 min,将上清液蒸发浓缩后加入3倍体积浓度为95%的乙醇,于4℃下醇沉12 h,将多糖等杂质离心除去,留上清液备用(王广慧,2016)。
1.3.3 X-5型大孔吸附树脂的预处理 称取X-5型大孔树脂放于锥形瓶中,加入体积浓度为95%的乙醇浸泡24 h后,先用95%乙醇洗至流出液清亮、无浑浊,再用蒸馏水洗至无醇味。然后分别用酸碱处理,即以5%(g/g)的 HCl溶液浸泡 4 h,蒸馏水洗至中性,再用 4%(g/g)的NaOH溶液浸泡4 h,蒸馏水洗至中性,备用。按如下公式计算大孔树脂的吸附率和解析率:
式中:C1、C2、C3分别为上样液黄酮质量浓度、饱和时流出液黄酮质量浓度、洗脱液黄酮质量浓度,mg/mL;V1、V2、V3分别表示饱和时上样液消耗的体积、饱和时流出液体积、洗脱液体积,mL。
1.3.4 X-5型大孔吸附树脂纯化金针菇黄酮工艺的优化 将处理后的树脂装入层析柱中,装柱高度为12 cm。先以树脂对金针菇黄酮的饱和吸附率为评价指标,分别探讨样品液pH、样品液浓度、样品液流速对吸附率的影响,然后再以黄酮解吸率为评价指标,分别考察洗脱液浓度、洗脱速率、洗脱剂用量对解析率的影响(张星等,2017;吴海霞等,2013;王国军等,2013)。
1.3.5 纯化前后金针菇黄酮纯度的对比 在最佳条件下进行吸附和洗脱,对比吸附前的黄酮纯度和洗脱后的黄酮纯度,即通过计算黄酮在解析液及样品液烘干后物质中所占的比例,得到纯化倍数。做平行试验3次。
1.3.6 纯化后金针菇黄酮的抑菌能力检测 采用抑菌圈法测定纯化后金针菇黄酮对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、沙门氏菌4种常见菌种的抗菌活性(曹培杰等,2019;许伟等,2010)。
1.3.6.1 菌悬液的制备 将活化后的菌种放置在37℃恒温振荡器中,以转速120 r/min连续振荡培养约24 h。当菌悬液在波长600 nm处OD值为0.1时取出备用。此时菌体浓度约为106~107菌落形成单位(cfu/mL)。
1.3.6.2 抑菌试验 在LB培养基平板上加入各菌悬液0.1 mL,用涂布棒涂布均匀,插入牛津杯。将0.1 mL不同质量浓度(mg/mL)经生理盐水稀释的金针菇黄酮溶液加入杯中,以生理盐水作为对照,置于37℃的培养箱中培养24 h后观察统计抑菌圈大小,并评价其抑菌效果。所有试验均设3组平行。
1.3.7 金针菇黄酮的抗氧化性研究 根据杨文建等(2017)和弓威等(2015)的方法进行金针菇黄酮的抗氧化研究。
1.3.7.1 对DPPH·清除能力的测定 在具塞试管中加入浓度为1.0×10-4mol/L的DPPH溶液3.5 mL和无水乙醇0.5 mL,闭光静置30 min,测定其在517 nm下吸光度A0;以0.5 mL样品液代替0.5 mL无水乙醇,其余同上,测出吸光度A1;取 3.5 mL无水乙醇与0.5 mL样品液,相同波长下测得吸光度A2。以3.5 mL无水乙醇和0.5 mL蒸馏水的混合液作为空白对照。平行测定3次,取平均值。同时以Vc为对照。
1.3.7.2 对O2-·清除能力的测定 向试管中加入2.8 mL pH 8.2的Tris-HCl缓冲液 (50 mmol/L)及0.1 mL不同浓度的黄酮提取液,放入25℃恒温水浴锅中,保温10 min,加入0.1 mL同样条件下预温的60 mmol/L邻苯三酚 (以60 mmol/L盐酸配制),立即摇匀,倒入比色杯中,在420 nm处每隔0.5 min测一次吸光值,此吸光值记为A1。
用0.1 mL同样条件下预温的HCl溶液(60 mmol/L)代替邻苯三酚,其余步骤同上,测得吸光值A2;保留邻苯三酚,但用0.1 mL蒸馏水替代黄酮提取液,其余操作同上,测得吸光值A0。平行测定3次,取平均值。同时以Vc作为对照。
1.3.7.3 对OH·清除能力的测定 在试管中加入1.0 mL不同浓度的黄酮提取液,然后依次加入2.00 mL的 1.8 mmoL/mL FeS04溶液、1.5 mL的1.8 mmoL/mL水杨酸-乙醇、0.10 mL质量分数为0.03%的H2O2溶液,振荡混合,放入37℃恒温水浴锅中保温30 min,然后在510 nm下测定吸光度值 A1;用 0.10 mL蒸馏水代替 H2O2,重复上述操作,测得吸光度值A2;保留过氧化氢,但用蒸馏水代替黄酮提取液,重复上述操作,测得吸光值A0。以Vc作为对照。
1.3.7.4 对ABTS·清除能力的测定 精密称取ABTS 40.00 mg,依次加入10 mL蒸馏水,8.00 mL的1.0 mg/mL过硫酸钾,在室温避光条件下静置16 h,然后转移到250 mL容量瓶中,加32 mL蒸馏水,用无水乙醇定容至刻度,放置10 h备用。
在5只试管中依次加入0.5 mL不同浓度的黄酮提取液、1.5 mL 95%乙醇、2 mL配好的ABTS溶液,混合,静置30 min,在734 nm波长下测出吸光度值A1;用2 mL蒸馏水代替ABTS溶液,其他步骤同上,测得吸光度A2;保留ABTS溶液,但以95%乙醇代替黄酮提取液,其他步骤同上,测出吸光度值A0。同时以Vc作为对照。
2 结果与分析
2.1 线性回归方程 按照王广慧(2016)所述方法绘制标准曲线,得到线性回归方程为y=0.0949x+0.0024,R2=0.9992,其中 y 为吸光度值,x为芦丁浓度(mg/mL)。
2.2 X-5型大孔树脂纯化金针菇黄酮工艺的优化
2.2.1 样品液pH对饱和吸附率的影响 用5%盐酸溶液和2%的NaOH溶液调节样品液pH,分别设定为 4、5、6、7、8,上样流速为 0.35 mL/min,上样浓度为1.2 mg/mL,进行吸附试验并计算饱和吸附率(即当流出液的浓度达到初始浓度的1/10时,即可认为树脂已吸附饱和)。每个样品做三组平行试验,取平均值,试验结果见图1。
由图1可知,样品液pH太大和太小都不利于黄酮的吸附,原因可能是在弱酸状态下,黄酮类化合物以分子形式存在,容易被大孔树脂吸附,但酸性较强时,黄酮分子中的氧原子易形成盐而带上正电荷,不易被吸附;在偏碱性的状态下,黄酮分子羟基中的氢易解离,所以不容易被大孔树脂吸附。因此选择pH 5作为X-5大孔吸附树脂吸附金针菇黄酮的最佳pH。
2.2.2 样品液浓度对饱和吸附率的影响 调节样品液pH为5,设定样品液浓度分别为0.8、1.0、1.2、1.4、1.6 mg/mL, 上样流速为 0.35 mL/min,进行吸附试验并计算饱和吸附率。试验结果见图2。
由图2可知,当样品液浓度为1.4 mg/mL时,金针菇黄酮的吸附率最大,原因可能是样品液浓度太大,超过了树脂吸附的极限,黄酮就会过早流出,不易被吸附,导致吸附率降低;样品液浓度太小,不足以被大孔树脂吸附。因此选择1.4 mg/mL浓度作为X-5大孔吸附树脂吸附金针菇黄酮的最适浓度。
2.2.3 样品液流速对饱和吸附率的影响 在样品液浓度为1.4 mg/mL,pH为5的条件下,设定样品液流速分别为 0.20、0.35、0.5、0.65、0.80 mL/min,进行吸附试验并计算饱和吸附率。试验结果见图3。
由图3可知,样品液流速为0.2 mL/min时吸附率最高,原因可能是流速较慢时提取液与树脂接触的时间较长,有利于黄酮类物质扩散到树脂内部,从而提高了吸附率。
2.2.4 洗脱剂浓度对解析率的影响 在最佳条件下吸附饱和的树脂用蒸馏水清洗至无色,然后用乙醇洗脱。乙醇体积分数分别为40%、50%、60%、70%、80%,洗脱流速为2 mL/min,乙醇用量为50 mL,计算总黄酮解析率。试验结果见图4。
由图4可知,当洗脱剂体积分数为70%时,洗脱效果最好,原因可能是由于70%乙醇溶液与黄酮的极性最接近。根据“相似者相溶”的原理,此乙醇浓度下最有利于黄酮的洗脱。
2.2.5 洗脱剂流速对解析率的影响 采用70%乙醇溶液50 mL进行洗脱,设定洗脱剂流速分别为 1、2、3、4、5 mL/min,计算总黄酮解析率。 试验结果见图5。
由图5可知,洗脱速率越慢解析率越高,洗脱速率太快不宜于金针菇黄酮的洗脱,原因可能是流速越慢洗脱剂与树脂的接触越充分,洗脱的也更彻底,因此选择1 mL/min为金针菇黄酮的最佳洗脱速率。
2.2.6 洗脱剂用量对解析率的影响 采用70%乙醇溶液以1 mL/min的速率进行洗脱,设定洗脱剂用量为 10、20、30、40、50、60 mL,计算总黄酮解析率。试验结果见图6。
由图6可知,在洗脱剂用量为60 mL时,树脂上吸附的黄酮类化合物完全被洗出,因此选洗脱液的最佳用量为60 mL。
2.3 纯化前后金针菇黄酮纯度的对比 由表1可知,三组平行试验中纯化后金针菇黄酮的纯度平均是纯化前的1.83倍,可见用此工艺条件纯化金针菇黄酮效果较好。

表1 纯化前和纯化后的黄酮纯度
2.4 纯化后金针菇黄酮的抑菌性研究结果 由表2可知,在测试浓度范围内,几个菌种的培养基上均有抑菌圈形成,可见金针菇黄酮对4种菌体均有不同程度的抑制作用,其抑菌效果随着金针菇黄酮浓度的增大而增强。抑菌程度大小的顺序为:大肠杆菌>沙门氏菌>金黄色葡萄球菌>枯草芽孢杆菌。
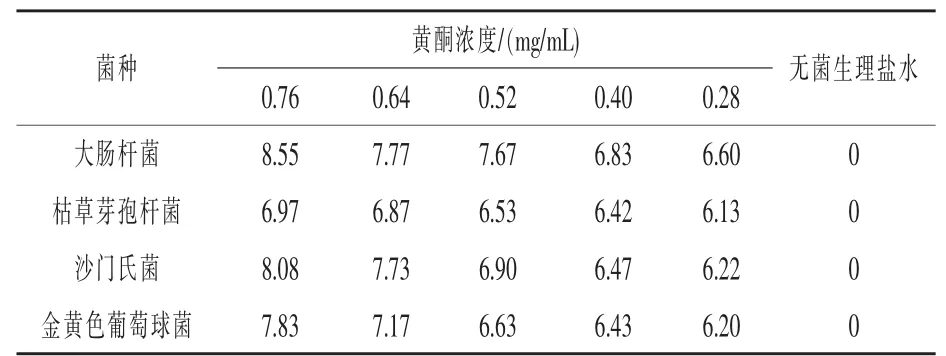
表2 黄酮浓度对菌种抑菌圈直径的影响
2.5 金针菇黄酮的抗氧化性研究结果
2.5.1 对DPPH·清除能力的测定结果 由图7可知,当浓度为0.25~0.85 mg/mL时,金针菇黄酮和Vc对DPPH·的清除率都随着浓度的加大而升高,但在同浓度下金针菇黄酮的清除率明显低于Vc。
2.5.2 对O2-·清除能力的测定结果 由表3可知,在一定浓度下,随着时间的延长,金针菇黄酮和VC对O2-·的清除率都呈下降趋势。当浓度为0.25~0.85 mg/mL时,二者对O2-·的清除率都随着浓度的加大而提高,但金针菇黄酮的清除率总体上来看比相同浓度时的Vc低。
2.5.3 对OH·清除能力的测定结果 由图8可知,当浓度为0.25~0.85 mg/mL时,金针菇黄酮和VC对OH·的清除率都随浓度的增加而增加,但在同浓度下,金针菇黄酮对OH·的清除能力比Vc弱。
2.5.4 对ABTS·清除能力的测定结果 由图9可知,当浓度为0.25~0.85 mg/mL时,金针菇黄酮和Vc对ABTS·的清除率均随二者浓度的增加而升高,但当浓度相同时,前者的清除率明显弱于后者。
3 结论
本文主要是对采用复合酶辅助高压法提取的金针菇黄酮经X-5型大孔树脂纯化后的抑菌和抗氧化能力进行检测,同时对X-5型大孔树脂纯化金针菇黄酮的条件进行了优化研究。根据研究结果得出如下结论:

表3 黄酮与Vc清除超氧阴离子自由基能力比较
3.1 X-5型大孔树脂可以作为纯化金针菇黄酮的介质,其最佳吸附条件为:浓度1.4 mg/mL,pH 5,上样流速为0.2 mL/min;最佳洗脱条件为:浓度70%的乙醇60 mL,洗脱速率1 mL/min。在此条件下得到的黄酮纯度是纯化前的1.83倍。
3.2 抑菌试验表明:金针菇黄酮对大肠杆菌、枯草芽孢杆菌、沙门氏菌和金黄色葡萄球菌均有不同程度的抑制作用,其抑菌效果随着金针菇黄酮浓度的增大而增强。抑菌程度大小的顺序为:大肠杆菌>沙门氏菌>金黄色葡萄球菌>枯草芽孢杆菌。
3.3 抗氧化试验表明:Vc和金针菇黄酮溶液均具有抗氧化作用,金针菇黄酮和Vc溶液对DPPH自由基、羟基自由基、超氧阴离子自由基和ABTS自由基的清除能力均随着浓度的增加而增大;金针菇黄酮对这四种自由基的清除能力均要弱于Vc。
由以上研究结果可知,利用复合酶辅助高压法提取金针菇黄酮后采用X-5型大孔树脂进行纯化处理,此工艺流程可行。
