脑信号蛋白3A及其受体神经菌毛素-1在慢性肝性脑病大鼠模型中的表达及意义
2020-06-20阮景晟李科志何剑波曾爱屏邬国斌
阮景晟, 陈 闯, 李科志, 黄 山, 何剑波, 曾爱屏, 连 芳, 邬国斌
1 广西医科大学附属肿瘤医院 肝胆外科, 南宁 530021; 2 广西医科大学 基础医学院, 南宁 530021
肝性脑病(hepatic encephalopathy,HE)是由肝功能不全和(或)门体静脉分流所引起的大脑功能障碍,表现为从轻微认知障碍到昏迷等一系列神经精神症状[1-2]。HE是急慢性肝病常见的并发症,病死率较高[3]。目前HE发病机制尚未完全阐明,也无有效的防治药物与方法。因此,建立HE动物模型对其发病机制、诊断和治疗的基础及临床研究发挥着重要作用[4]。HE患者临床表现出一系列的运动和认知相关的神经系统损伤症状,如运动能力、协调能力、运动活性等的降低[5-6]。寻找与HE发病相关的神经系统内相关蛋白的改变及作用很有探索意义[7]。Sema3A是一种分泌型蛋白,其具有影响神经发育和神经轴突导向的功能[8]。Sema3A可以通过跨膜蛋白受体神经菌毛素(neuropilins-1,NRP-1)结合形成Plex-NP复合物来诱导轴突末端的生长锥坍塌崩解来引发神经退行性疾病,但在神经系统损伤与修复中的作用尚未完全清楚[9-11]。国外已有研究[12]证明了去葡萄糖对大鼠神经皮质细胞内Sema3A及NRP-1的作用及影响。因此,本文通过建立HE大鼠模型检测Sema3A及其受体NRP-1的表达及变化情况,初步探讨Sema3A及NRP-1参与HE病理生理过程的相关机制,为相关实验研究及HE的临床干预提供新的思路及靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD雄性大鼠40只,体质量200~220 g,由广西医科大学动物实验中心提供,动物生产许可证号:SCKK桂2014-0002,动物使用许可证号:SYXK桂2014-0003。本研究所有动物实验均符合中国伦理委员会的相关要求。
1.1.2 药品及试剂 乙酸铵;Sema3A兔多克隆抗体,NRP-1兔单克隆抗体,Anti-beta Actin兔多克隆抗体(美国Abcam公司,批号分别为ab23393、ab81321、ab8227);山羊抗兔IgG(H + L)抗体(上海碧云天公司,批号A0208);大鼠血氨Elisa试剂盒(江苏JSBOSSEN公司,批号BS-E12304R2);大鼠ALP、ALT、AST、TAB、Alb、TBil ELISA试剂盒(江苏酶免公司,批号分别为MM-0217R1、MM-20436R1、MM-20437R1、MM-20428R1、MM-20429R1、 MM-20439R1); Real-time PCR试剂盒(日本Takara公司,批号:RR820A);引物β-Actin:上游5’-CTGAGAGGGAAATCGTGCGTGAC-3’;下游5’-AGGAA-GAGGATGCGGCAGTGG-3’;Sema3A:上游5’-TTGCTCGGGACCCTTATTGTG-3’;下游5’-CAGTGAGTCAGTGGGTCTCCATTC-3’;NRP-1:上游5’-CCCTCCTCCT-CGCAACTCCTC-3’;下游5’-CTCAAGTCGCCTGCATCCTGTC-3’。
1.1.3 仪器 SMART3.0行为学采集和分析系统(西班牙 Panlab 公司);Axio Observer 3型倒置显微镜(德国 Carl Zeiss 公司);Power/Pac300 型电泳仪,CelDoc2000型凝胶电泳成像分析仪(美国 Bio-Rad 公司)。
1.2 实验方法
1.2.1 大鼠HE模型(C型)的制备 将40只SD大鼠按照体质量、身体状况、活动性等均衡的原则随机分为4组:对照组,HE 1 d、15 d、30 d组,每组10只。HE模型制备:水合氯醛大鼠腹腔麻醉后,无菌操作开腹结扎大鼠胆总管,并将两结扎之间的胆总管切除,给予胆总管切除术后大鼠连续灌胃浓度10 %的乙酸铵2周。对照组给予开腹后缝合但不进行胆管结扎和灌胃。
1.2.2 大鼠行为学检测 利用SMART3.0行为学采集和分析系统在旷场中分析大鼠的行为,大鼠出现自主性活动减少、嗜睡、反应迟缓、共济失调等症状之一,即可诊断为HE[13]。Zimmermann法[14]对大鼠分级,0 级:正常(11 分);Ⅰ级:反应迟缓,神经反射正常(11 分);Ⅱ级:自主活动下降,但反射仍基本正常(10~11 分);Ⅲ级:共济失调(<10 分);Ⅳ级:角膜反射消失,动物昏迷(0 分)。
1.2.3 血液生化指标及肝脏与脑组织病理学检测 大鼠禁食12 h后水合氯醛麻醉,腹主动脉取血,离心,取上清。检测血清中血氨、TBA、Alb 、TBil、AST、ALT、ALP。取各组大鼠脑组织和一小块左叶肝组织固定,包埋,切片,染色。
1.2.4 Real-time PCR检测Sema3A及NRP-1 mRNA的表达水平 每组10只大鼠麻醉后处死,分离出大鼠脑皮质和海马各区,加入trizol提取RNA 进行Real-time PCR反应。2﹣△△ct用以计算mRNA的表达情况。
1.2.5 免疫组化法检测前额叶皮层、海马各区中Sema3A/NRP-1蛋白的表达 切片脱蜡、水化、抗原修复,封闭,一抗Sema3A(1∶300)/NRP-1(1∶200),4 ℃孵育,辣根过氧化物酶标记,DAB显色,封片。棕褐色或棕黄色为蛋白染色阳性表达。
1.2.6 Western Blot检测前额叶皮层及海马CA1、CA3、DG各区组织中Sema3A/NRP-1的表达 取各组大鼠皮层、海马CA1、CA3、DG区组织提取蛋白。SDS-PAGE电泳,封闭1 h,一抗Sema3A,NRP-1,β-actin(均1∶1000),4 ℃孵育,TBST洗膜3次,二抗孵育1 h,洗膜3次。Image J软件采集条带灰度值,取目的条带和内参条带灰度值比值作为相对表达量。

比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经反射、血氨水平及HE分级的比较 对照组大鼠活动正常,感觉及神经反射灵敏。造模组大鼠均出现不同程度的神经反射和自主活动的减弱。与对照组相比,随着时间的延长(1 d、15 d、30 d)模型组在旷场中神经反射等级、HE分级、血氨均明显升高,差异有统计学意义(P值均<0.05)(表1)。

表1 各组大鼠神经反射评分、血氨浓度、HE分级的比较
注:与对照组比较,1)P<0.01,2)P<0.001;与HE 1 d组相比,3)P<0.001;与HE 15 d组相比,4)P<0.001。
2.2 各组大鼠血清学各生化指标检测结果 4组间TBA、Alb 、TBil、AST、ALT、ALP比较差异均有统计学意义(P值均<0.001),与对照组相比,模型组Alb水平随时间的延长(1 d、15 d、30 d)明显降低,其余指标明显升高(P值均<0.05)(表2)。
2.3 各组大鼠肝脏和大脑皮层、海马CA1、CA3、DG区的病理结构的比较 肝脏HE染色结果显示:对照组大鼠肝小叶结构清晰,肝细胞正常,无肿胀、变性、坏死等明显病理改变。模型组大鼠肝脏汇管区及小叶周边可见纤维组织增生和炎性细胞浸润(图1)。对照组大鼠脑组织清晰,细胞结构完整,神经元分布均匀;海马CA1、CA3、DG区结构清楚,染色质均匀,细胞排列整齐。模型组可见大脑皮层及海马CA1、CA3、DG区大量神经细胞核固缩变形,染色加深,细胞排列紊乱(图2)。
2.4 造模后各脑区Sema3A及NRP-1 mRNA表达的改变 HE组大鼠前额叶皮层和海马CA1、CA3、DG区Sema3A及NRP-1 mRNA表达于造模后开始上调,随着时间的延长(1 d、15 d、30 d)明显增加,与对照组相比差异均有统计学意义(P值均<0.001)(表 3、4)。

表2 各组大鼠血清生化学指标结果分析
注:与对照组比较,1)P<0.001;与HE 1 d组比较,2)P<0.001;与HE 15 d组比较,3)P<0.05。

注:a、c,对照组;b、d,HE 30 d组。

注:a、c、g、e,对照组;b、d、f、h,HE 30 d组。
2.5 大鼠各脑区Sema3A及NRP-1蛋白表达分析 免疫组化结果显示,HE组大鼠前额叶皮层和海马CA1、CA3、DG区Sema3A及NRP-1呈阳性染色,Sema3A阳性染色可见于神经元胞质和轴突,以胞膜和胞质为主(图3);NRP-1阳性染色可见于神经元、星形胶质细胞、微血管内皮细胞,以胞质为主,偶可见于胞核(图4)。Western Blot 结果显示,与对照组相比, HE组Sema3A及NRP-1蛋白表达显著上调,随时间延长逐渐增加,差异均有统计学意义(P值均<0.001)(图5,表5)。
3 讨论
HE动物模型的制备分为A型、B型、C型等[15]。其中可能接近慢性HE形成机制的是C型动物模型,其他模型均会导致肝脏的急性损伤,造成模型动物的死亡率较高,对HE模型的病理生理机制的研究带来困扰[16-19]。本研究采用胆管结扎和以低毒性的乙酸铵灌胃的方式制备HE模型,模型动物神经功能呈现随时间延长的缓慢持续性受损,病理学观察肝脏内可见胆汁淤积和炎性细胞聚集的慢性肝损伤病变,脑组织内可见大量神经元变性,局部胶质细胞的增生及尼氏体的固缩紊乱。且模型动物的死亡率很低,说明本实验建立了较为可靠稳定的HE模型,这是进行相关分子机制研究的基础。
Sema3A在神经系统中可以根据神经元内cGMP水平的改变而呈现双重性的生物功能,可以作为某种化学抑制剂,抑制神经轴突生长,或作为化学激活剂,刺激树突顶端生长[20-22]。除了神经系统以外,Sema3A在其他组织也有分布,与细胞迁徙、肿瘤生长、免疫反应及血管生成都有密切关系[23-24]。2014年Nature发表了关于神经星形胶质细胞内Sema3A的研究成果[8],证实了阻断Sema3A的生成,运动神经元无法形成正常的连接,并且半数的运动神经元死亡。由此推断特定区域内神经系统Sema3A蛋白是维持控制反射动作神经回路的必要条件。近年来有研究[25-26]表明,在脑缺血梗死及脊髓损伤中,Sema3A在梗死灶及其周围瘢痕区的大脑皮层和海马组织中表达上调,呈现高表达状态。与此相似的是,本研究结果显示,大鼠HE模型中随着时间的延长,前额叶皮层和海马CA1、CA3、DG区Sema3A蛋白表达明显上调,提示HE的发生发展机制中可能与Sema3A蛋白的高表达有关。
NRP-1是一种跨膜受体,可以介导Sema3A的信号转导[27]。Sema3A通过与跨膜蛋白受体NRP-1结合形成Plex-NP复合物,构成了Sema3A信号通路第一级水平的调节,然后通过一定途径将信号传递给细胞骨架肌动蛋白,使轴突生长锥和其他细胞结构发生相应的变化[28]。NRP-1表达于神经元、星形胶质细胞、血管内皮细胞等多种细胞,可介导多种信号蛋白的转导,与脑损伤、脑缺血、肿瘤转移、血管生成等都有密切的关系[29]。有报道[30]显示,Sema3A与NRP-1形成的受体复合物,会使微管蛋白磷酸化,导致微管的失稳和解聚,从而导致生长锥的崩溃及神经功能的紊乱。本研究结果显示,大鼠HE模型建立后NRP-1逐渐上调。结合上述结果,认为HE的发生机制可能与Sema3A/NRP-1轴的表达上调有关。

表3 大鼠各脑区Sema3AmRNA表达的改变
注:与对照组比较,1)P<0.001;与HE 1 d组比较,2)P<0.001;与HE 15 d组比较,3)P<0.001。

表4 大鼠各脑区NRP-1mRNA表达的改变
注:与对照组比较,1)P<0.001;与HE 1 d组比较,2)P<0.001;与HE 15 d组比较,3)P<0.001。

图3 大鼠前额叶皮层和海马CA1、CA3、DG区不同时间Sema3A的表达改变(免疫组化染色,×400)

图4 大鼠前额叶皮层和海马CA1、CA3、DG区不同时间NRP-1的表达改变(免疫组化染色,×400)
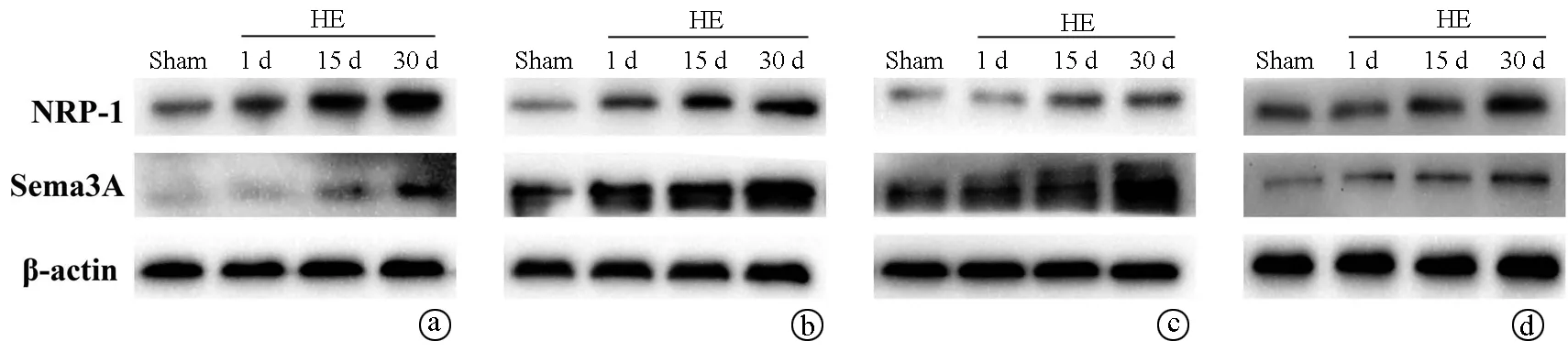
注:a,前额叶皮层;b,海马CA1区;c,海马CA3区;d,海马DG区。
表5大鼠前额叶皮层和海马中Sema3A和NRP-1蛋白表达的定量分析
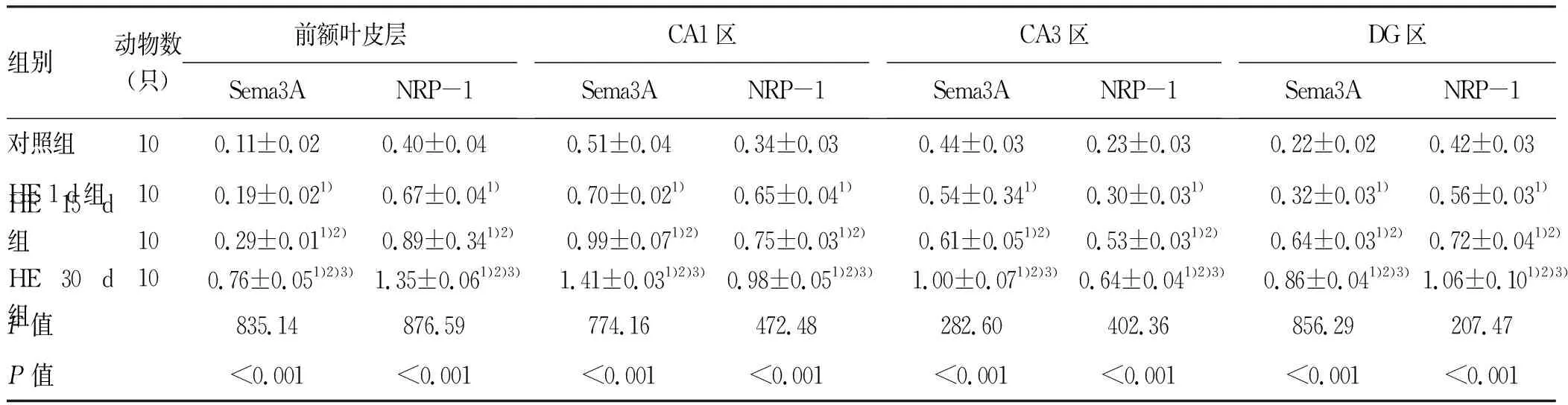
组别动物数(只)前额叶皮层Sema3A NRP-1CA1区 Sema3A NRP-1 CA3区Sema3A NRP-1DG区 Sema3A NRP-1 对照组100.11±0.020.40±0.040.51±0.040.34±0.030.44±0.03 0.23±0.03 0.22±0.02 0.42±0.03HE 1 d组100.19±0.021)0.67±0.041)0.70±0.021)0.65±0.041)0.54±0.341)0.30±0.031)0.32±0.031)0.56±0.031)HE 15 d组HE 30 d组10100.29±0.011)2)0.76±0.051)2)3)0.89±0.341)2)1.35±0.061)2)3)0.99±0.071)2)1.41±0.031)2)3)0.75±0.031)2) 0.98±0.051)2)3)0.61±0.051)2)1.00±0.071)2)3)0.53±0.031)2)0.64±0.041)2)3)0.64±0.031)2)0.86±0.041)2)3)0.72±0.041)2) 1.06±0.101)2)3)F值835.14876.59774.16472.48282.60402.36856.29207.47P值<0.001<0.001<0.001<0.001<0.001<0.001 <0.001 <0.001
注:与对照组比较,1)P<0.001;与HE 1 d组比较,2)P<0.001;与HE 15 d组比较,3)P<0.001。
目前HE的发病机制尚未完全明了,关于发病机制的主要学说有氨中毒、氧化应激、γ-氨基丁酸、锰离子、假性神经递质、血浆氨基酸失衡等[31]。氨中毒是目前主流的认同观点,在HE治疗过程中降低血氨仍是主要的治疗措施。在临床治疗过程中缓解氨中毒症状可以减缓HE患者的临床昏迷症状。临床前瞻性研究中血氨与认知功能障碍存在一定的剂量依赖关系[32]。而且国内外关于氨中毒对HE发病机制及其神经系统病变影响的研究已经取得了一定进展,已有研究[33]表明在大鼠慢性HE模型中,降低血氨后大鼠神经系统一系列测试和评分都有改善,降低血氨对大鼠肝功能生物标志物及一些炎症因子、凋亡基因、神经递质的表达都有一定影响。与此相似的是,本研究中慢性HE大鼠血氨的升高可能对Sema3A/NRP-1的表达也有一定的影响作用。
综上所述,本研究结果显示,Sema3A及其受体NRP-1在大鼠HE后随着病变的进展表达逐渐上调,Sema3A/NRP-1可能参与到抑制轴突生长,阻碍神经介导,扰乱神经功能的病理生理机制中。血氨、Alb等炎性介质也可能对Sema3A/NRP-1的表达及其他基因调控机制有一定的影响。基于当前的研究进展,可对Sema3A/NRP-1神经轴进行NRP-1抑制肽、基因调控、寻找上下游靶点等进行干预。本研究尚未进行干预措施的研究,但为其相关干预的研究提供了靶点及良好的理论基础。
