直接抗病毒药物治疗慢性丙型肝炎的效果及对肝硬度、APRI的影响
2020-06-20张亚苹向慧玲吕洪敏
梁 静, 张亚苹, 刘 芳, 向慧玲, 吕洪敏, 韩 涛
天津医科大学三中心临床学院, 天津市第三中心医院 消化肝病科, 天津 300170
HCV感染人群在全世界有1.3~1.5亿人[1],也是终末期肝病和肝细胞癌(HCC)的主要原因[2-3]。既往研究[4-5]证实,干扰素联合利巴韦林治疗获得病毒学应答的患者可以延缓纤维化并减少HCV相关HCC的发生。随着直接抗病毒药物(direct antiviral drug,DAA)在中国批准上市,我国的慢性丙型肝炎患者开始应用非干扰素方案治疗。既往DAA在我国的临床研究[6]提示其病毒持续应答率较高,然而真实世界研究报道较少,且尚无DAA治疗对于肝脏炎症纤维化影响的相关报道。本研究旨在观察DAA在真实世界的病毒学应答情况及通过无创指标评估肝脏炎症及纤维化改善的情况。
1 资料与方法
1.1 研究对象 本研究为前瞻性非干预性的观察性研究(临床注册号ChiCTR1900023747)。连续性纳入2018年4月1日-2018年11月30日就诊于天津市第三中心医院接受DAA治疗(中国食品药品监督管理局批准的DAA)的慢性丙型肝炎患者。由研究者根据患者的基因型、肝功能基础并参照《丙型肝炎防治指南(2015年更新版)》[7]及2018欧洲肝病学会慢性丙型肝炎指南[8]决定治疗药物及疗程。基线肝硬化参照《丙型肝炎防治指南(2015年更新版)》[7]中的诊断标准。
1.2 纳入标准 年龄≥18岁的男性或女性,经血清学检测确诊为慢性丙型肝炎,定义为HCV抗体阳性和可检测到血清HCV RNA[Cobas Taqman HCV试验V2.0,Roche诊断产品有限公司(瑞士),检测范围为6.9×107IU/ml]持续6个月以上[7-8],且无应用DAA及利巴韦林治疗禁忌证,患者签署知情同意书并完成治疗及治疗后12周随访。
1.3 排除标准 (1)基线BMI>35 kg/m2的患者;(2)治疗前存在腹水、肝内占位病变的患者;(3)合并HIV/HBV感染;(4)治疗期间仍酗酒者和(或)静脉注射吸毒者;(5)合并自身免疫性肝病及遗传代谢肝病患者;(6)既往应用过DAA治疗的患者;(7)治疗方案中含干扰素的联合方案;(8)失访或数据不完整者。
1.4 疗效评估 入组患者在基线、治疗结束、治疗结束后第12周评估临床、实验室及病毒学参数的改变。首要的疗效评估终点为治疗结束后12周获得持续病毒学应答(SVR)的患者比率。SVR12定义为完成治疗后12周HCV RNA低于检测下限的比率。
1.5 肝脏炎症及纤维化评估 应用肝硬度(liver stiffness measurement,LSM)及天门冬氨酸/血小板比值指数(AST/platelets ratio index,APRI)评价肝纤维化及炎症指标。于基线(治疗前3个月内)及治疗结束后12周进行LSM检测(FibroScan,巴黎,法国),检测者对患者的基线情况和DAA治疗方案不知情。LSM数值进行10次检测取中位数,按照操作要求10次测量的四分位数间距<15认为有效[9]。APRI评分计算公式参照无创肝纤维化指南[9]:APRI=AST(/ULN)/PLT(109/L)×100。
1.6 伦理学审查 本研究方案经由天津市第三中心医院伦理委员会审批(批号:IRB2018-031-01),所纳入患者在治疗前均签署知情同意书。
1.7 统计学方法 应用SAS9.4进行统计分析。非正态分布的计量资料以M(P25~P75)表示,治疗前后组间比较采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 纳入患者基线特征及DAA方案 共265例慢性丙型肝炎患者应用DAA进行抗HCV治疗,其中212例符合入组标准,截至2019年5月1日,174例患者完成了治疗疗程及12周随访。本研究中DAA治疗方案包括奥比帕利联合达塞布韦(paritaprevir/ombitasvir/ritonavir/dasabuvir,OBV/PTV/R+DSV)12周;索磷布韦联合达拉他韦(sofosbuvir/daclatasvir,SOF/DCV)24周;索磷布韦联合利巴韦林(sofosbuvir/ribavirin,SOF/RBV)治疗12周或24周;阿舒瑞韦联合达拉他韦(asunaprevir/daclatasvir,ASV/DCV)24周;艾尔巴韦/格拉瑞韦(elbasvir/grazoprevir,EBR/GZR)12周及索磷布韦/维帕他韦(sofosbuvir/velpatasvir,SOF/VEL)12周。患者纳入流程图及用药方案见图1。
212例患者中男96例,女116例,中位年龄为58岁,其中肝硬化患者占35.4%,基因1b、2a、3a、6a型分别占75.0%、18.4%、4.2%及2.4%。纳入患者基线情况及临床参数详见表1。
表1纳入患者的基线资料

项目数据男[例(%)]96(45.3)年龄(岁)58(49~65)肝硬化病史[例(%)]75(35.4)Child-Pugh分级[例(%)] A级60(80) B级15(20) C级0HCV RNA(log10 IU/ml)6.1(5.5~6.1)HGB(g/L)140(131~155)PLT(×109/L)151(102~192)血肌酐(μmol/L)63.5(56.0~74.0)LSM(kPa)11.4(7.7~19.1)APRI0.8(0.4~1.6)初治[例(%)]181(85.4)基因型[例(%)] 1b159(75.0) 2a39(18.4) 3a9(4.2) 6a5(2.4)治疗方案[例(%)] OBV/PTV/R+DSV(12周) 120(56.6) SOF/RBV(12周/24周) 62(29.2) SOF/DCV(24周) 10(4.7) EBR/GZR(12周)9(4.2) DCV/ASV(24周) 6(2.8) SOF/VEL(12周) 5(2.4)
2.2 病毒学应答 174例完成抗病毒治疗和12周随访患者在治疗结束及治疗结束后12周的SVR率分别为98.3%和95.4%。有3例患者(基因1b型、2a型、3a型各1例)治疗结束时病毒学应答失败,其中2例基线诊断为肝硬化;5例患者(基因1b型4例、2a型1例)为病毒学复发,即在治疗结束后12周可检测到HCV RNA,该5例基线诊断均为肝硬化。不同基因型患者病毒学应答情况详见表2。OBV/PTV/R+DSV方案治疗结束后12周病毒学应答率为98.11%;SOF/RBV方案治疗结束后12周病毒学应答率为86.96%;SOF/DCV方案、DCV/ASVOF/VEL方案以及EBR/GZR方案治疗结束后12周病毒学应答率均为100%。

表2 慢性丙型肝炎患者DAA治疗后病毒学应答情况[例(%)]
2.3 DAA治疗后肝功能指标的变化 截止到观察时间,分别有207例及165例患者完成了治疗结束及结束后12周肝功能随访。与基线相比,治疗结束及治疗结束后12周时,患者ALT、AST、ALP、GGT以及血清TBil水平均下降,血清Alb水平升高,差异均有统计学意义(P值均<0.05)(表3、4)。
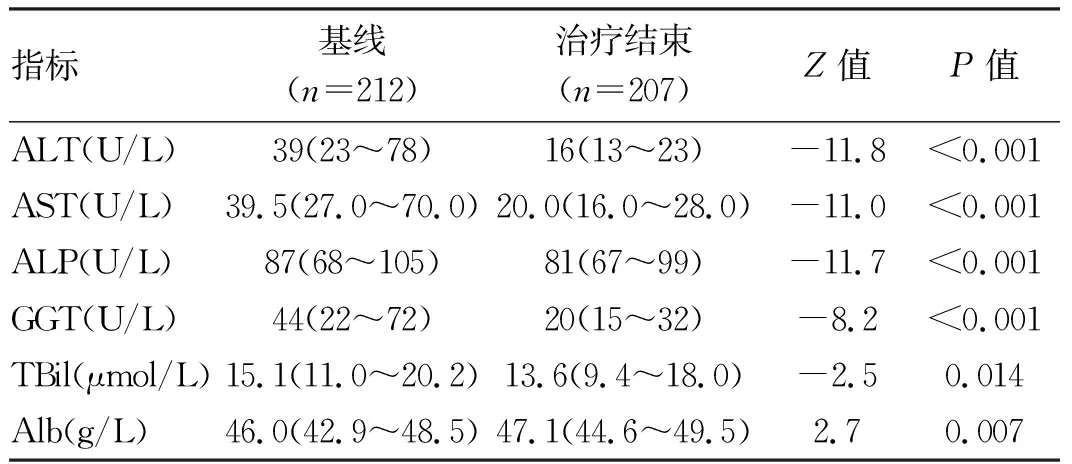
表3 基线与DAA治疗结束时患者肝功能指标比较

表4 基线与DAA治疗结束后12周患者肝功能指标比较
2.4 DAA治疗后LSM与APRI的变化 慢性丙型肝炎患者在DAA治疗后12周LSM、APRI较基线均显著降低(P值均<0.05)(表5)。
按照基线是否存在肝硬化进行分组,结果显示非肝硬化组患者在治疗后12周LSM较基线明显下降(P=0.007),而肝硬化组患者LSM治疗后12周与基线比较,差异无统计学意义(P=0.152);肝硬化组和非肝硬化组患者APRI在治疗后12周较基线均明显下降(P值均<0.001)(表5)。
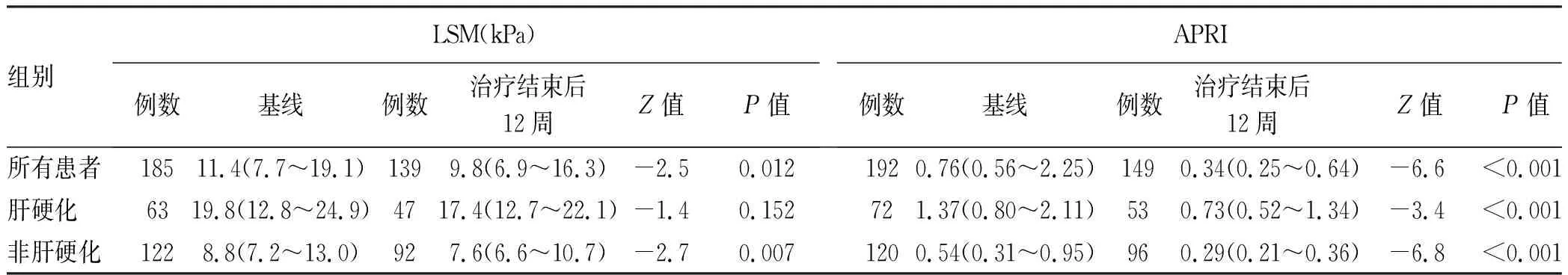
表5 DAA治疗前后LSM及APRI比较
3 讨论
我国HCV感染人群约有1100万[10],DAA由于其高效、短疗程及良好的耐受性已经成为国内外指南[7,11]推荐的治疗丙型肝炎的一线方案。真实世界的疗效是评价及指导DAA应用方案的重要依据,然而我国DAA治疗起始时间较欧美国家晚,目前缺乏真实世界的抗病毒疗效的报道。
本研究中,212例应用DAA治疗的慢性丙型肝炎患者中,HCV感染时间长,平均年龄偏高,以初治及基因1b型患者为主,肝硬化患者所占比例为35.4%。DAA治疗的总体SVR12达95.4%;基因1b型患者SVR12为96.3%,2a型、3a型患者SVR12分别为93.1%、80.0%,较基因1b型患者的SVR12偏低。考虑其原因可能是基因3a型慢性丙型肝炎在抗病毒应答方面为相对难治性患者[12],同时由于治疗时药物可及性的因素,本研究中基因2a型和3a型患者有88.2%(30/34)应用了SOF联合RBV治疗(12周或24周)方案,该方案在《丙型肝炎防治指南(2015年更新版)》[7]中作为推荐,但对于基因3型慢性丙型肝炎患者研究表明其应答率偏低[13]。SOF/VEL以及格卡瑞韦/哌仑他韦为代表的泛基因方案,在既往的研究[14-15]中显示对于2型及3型丙型肝炎患者有较高的病毒学应答,因此成为目前国内外推荐基因2型/3型丙型肝炎患者的首选治疗方案。本研究中4例基因6a型的慢性丙型肝炎患者均获得了SVR,但所占比例仅为2.4%,仍需扩大观察人群了解其真实的抗病毒治疗效果。
慢性丙型肝炎患者肝纤维化程度是其肝病进展及HCC发生的重要预后因素[16-17],亦是DAA治疗后随访及管理的关键影响因素。非侵入性技术目前常用于评估HCV治疗前后的肝纤维化[18],已有证据表明瞬时弹性成像对肝纤维化和肝硬化具有良好的敏感性和特异性[19],APRI也是目前常用于无创评价肝脏炎症及纤维化的指标[20-22]。
本研究在治疗前及治疗结束后12周测定慢性丙型肝炎患者的LSM及APRI,两次测量的中位时间为26周,结果表明在HCV根除后的较短时间内,慢性丙型肝炎患者总体LSM及APRI改善。LSM的变化在一定程度上可以反映纤维化程度,但由于该指标容易受到肝脏炎症的影响[23],因此本研究中LSM值的快速下降不能排除存在炎症因素的影响。通过亚组分析显示,LSM在非肝硬化组治疗后显著下降,原因可能是非肝硬化慢性丙型肝炎患者肝纤维化程度较肝硬化组轻微,因此LSM值的下降很可能与病毒清除后肝脏炎症的减轻有关。DAA治疗后炎症的减轻,在一定程度上可能有助于组织学的改善,结合既往研究[24-25]抗病毒治疗对于肝脏炎症及早期肝纤维化的逆转更为有效。本研究显示DAA治疗后肝硬度的改善在非肝硬化患者中更为显著,而对于已经处于肝硬化的患者,短时间内实现SVR并不一定能同时使肝硬化程度得到改善,这部分患者仍存在肝病进展及肝癌的风险,因此HCV的早期筛查及治疗尤为重要。本研究结果显示,慢性丙型肝炎患者在治疗后APRI明显降低,且肝硬化及非肝硬化组患者治疗前后APRI比较差异亦均有统计学意义,这种降低在一定程度上反映了肝纤维化程度的改善。APRI应用生化指标进行评估,相对LSM检测更为简便,但该指标单独诊断肝纤维化准确性略差,容易受到AST变化的影响。本研究中患者治疗后AST水平明显下降,因此治疗后APRI的改变可能存在AST的影响。病毒清除后肝纤维化的逆转仍需长期观察及联合多种指标综合判定。
本研究的缺陷为样本量相对较少,且为单中心的队列研究,在研究队列中患者的基因型主要以1b型为主,应用不同DAA方案的患者数量也存在差异,因此对于不同基因型的患者治疗结果可能存在偏倚,需要在今后的研究中进一步扩大研究人群。本研究中LSM及APRI在治疗后早期(治疗结束后12周)显著降低在一定程度上反映了肝脏炎症及纤维化程度的改善,但仍不能对纤维化改善进行量化评估,需要延长随访时间以观察肝脏纤维化持续改善的过程。特别是考虑到既往报道长效干扰素治疗后纤维化消退的组织学改善[26-27],DAA治疗后肝纤维化的改善是可以预期的,因此,将继续对丙型肝炎队列进行长期随访研究。
