COSSH-ACLFs评分模型对HBV相关慢加急性肝衰竭患者短期预后的预测价值
2020-06-20田小利吴松林
田小利, 吴松林, 王 波, 吴 刚
西南医科大学附属医院 a. 感染科; b. 重症医学科, 四川 泸州 646000
慢加急性肝衰竭(ACLF)是指在慢性肝脏疾病的基础上由于多种诱因导致的急性或者亚急性肝功能恶化,短期病死率高达50%~90%[1-2]。早期准确评估ACLF患者预后能够有助于临床制订最佳治疗方案。目前,临床常见ACLF预后评估模型包括:MELD、MELD-Na、CLIF-C OFs和 CLIF-C ACLFs。MELD评分最初主要用于评估肝硬化患者经颈静脉肝门门体分流术后的临床预后,目前也被推荐用于评估肝移植的临床预后[3]。荟萃分析[4]显示,MELD评分对预测ACLF患者短期临床预后的准确度高于Child-Turcotte-Pugh评分。在此基础上,Biggins等[5]将血清钠(Na)纳入MELD模型,从而衍生出MELD-Na评分。研究[6]显示,MELD-Na评分预测ACLF患者3个月生存率准确度高于MELD评分。Jalan等[7]在CLIF-SOFA 模型的基础上提出简化版评分模型即CLIF-C OFs,该模型不仅更简单实用,而且与CLIF-SOFA 在预测患者病死率方面价值相当。Hernaez等[8]在CLIF-C OFs的基础上纳入WBC和年龄两个因素,提出了CLIF-C ACLFs模型。研究[9]显示,在预测28 d病死率方面,CLIF-C ACLFs 评分的准确度优于CLIF-C OFs、MELD 和Child-Pugh评分。与其他国家不同,我国ACLF患者的病因主要为慢性乙型肝炎。一项纳入我国13家医院HBV-ACLF患者的研究[10]发现,COSSH-ACLFs评分预测患者90 d病死率的准确度优于CLIF-C ACLFs 评分。因此,COSSH-ACLFs评分可能更加适用于我国患者。本研究旨在验证COSSH-ACLFs评分预测HBV-ACLF患者90 d病死率的准确度,并与上述评分模型比较。
1 资料与方法
1.1 研究对象 选取2014年1月-2019年10月西南医科大学附属医院、2017年1月-2018年12月内江市第一人民医院及宜宾市第二人民医院收治的HBV-ACLF患者。纳入标准:(1)HBsAg阳性;(2)符合《肝衰竭诊治指南(2018年版)》[11]中慢加急性(或亚急性)肝衰竭诊断标准。排除标准:(1)合并其他嗜肝病毒感染(HAV/HCV/HDV/HEV),或可能导致肝衰竭的其他病毒感染(如HIV/EB病毒/巨细胞病毒/疱疹病毒);(2)合并肝癌或其他恶性肿瘤;(3)合并其他系统严重基础疾病(如心肌梗死、心力衰竭、肺结核等)或入院时即存在严重营养不良;(4)合并自身免疫性肝病/酒精性肝病/遗传代谢性肝病;(5)临床资料不全者;(6)失访患者。所有患者入院后均给予内科综合治疗。自确诊之日起随访90 d,通过电子病历资料或者电话随访获得90 d时的生存状况。
1.2 研究方法 收集所有患者的一般资料及实验室检查指标,包括年龄、性别、外周血WBC、RBC、Hb、PLT、ALT、AST、Alb、TBil、肌酐(Cr)、Na、PT、国际标准化比值(INR)、PTA。收集患者相关并发症,包括上消化道出血、肝性脑病(HE)、腹膜炎。此外,由于计算CLIF-C OFs与HBV-SOFA[12]的需要,收集患者血氧饱和度(SPO2)及吸氧流量(FiO2)、平均动脉压。各评分模型的计算公式如下:
MELD=3.8×ln[TBil (mg/dl)]+11.2×ln (INR)+9.6×ln[Cr (mg/dl)]+6.4×(胆汁性或酒精性:0,其他:1)[3]。
MELD-Na=MELD+1.59×[135-Na(mmol/L)][5]。
CLIF-C OFs评分公式见表1。
CLIF-C ACLFs = 10×[0.33×CLIF-OFs[7]+0.04×年龄+0. 63×In(WBC) -2][8]。
COSSH-ACLFs=0.741×INR+0.523 × HBV-SOFA+0.026 ×年龄+0.003×[TBil (mg / dl)][10]。
HBV-SOFA 评分公式见表2。

表1 CLIF-COFs 评分
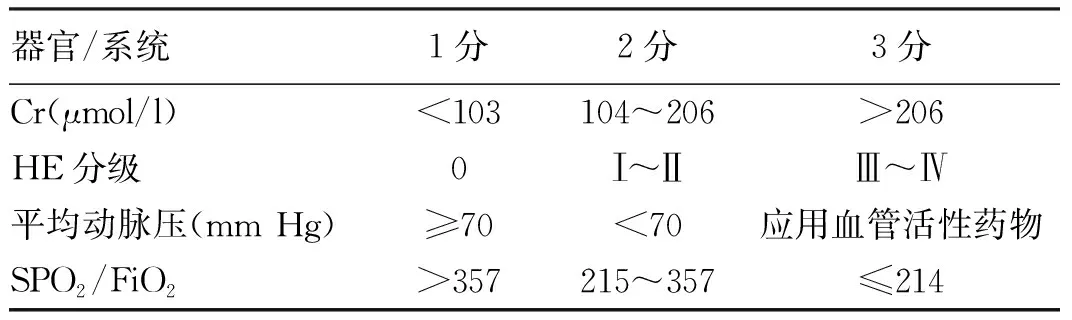
表2 HBV-SOFA评分
1.3 伦理学审查 本研究经由西南医科大学附属医院伦理委员会审批通过(批号:KY2020033)。
2 结果
2.1 一般资料 共纳入患者573例(其中西南医科大学附属医院417例,内江市第一人民医院及宜宾市第二人民医院总计156例)。将所有患者按照90 d时的生存状况分为生存组和死亡组,其中生存组339例,死亡组234例。2组患者一般资料比较情况见表3。
2.2 2组患者各模型评分比较 按照公式计算两组各模型评分,结果显示,MELD、MELD-Na、CLIF-C OFs、CLIF-C ACLFs、COSSH-ACLFs在2组之间差异均有统计学意义(P值均<0.001)(表4)。
2.3 各评分模型预测效能比较 各评分模型AUC分别为 MELD(AUC=0.726)、MELD-Na(AUC=0.587)、CLIF-C OFs(AUC=0.712)、CLIF-C ACLFs(AUC=0.735)、COSSH-ACLFs (AUC=0.750)(表5)。对COSSH-ACLFs模型的AUC与另外4个模型进行比较发
现,COSSH-ACLFs模型AUC大于其他4个预测模型(COSSH-ACLFs vs MELD,Z=7.89,P<0.001;COSSH-ACLFs vs MELD-Na,Z=18.83,P<0.001;COSSH-ACLFs vs CLIF-C OFs,Z=12.49,P<0.001;COSSH-ACLFs vs CLIF-C ACLFs,Z=5.05,P<0.001)(图1)。

表3 2组患者一般资料比较

表4 2组患者模型评分比较

表5 各预测模型AUC比较
3 讨论
我国ACLF的主要病因为乙型肝炎[13]。HBV-ACLF与酒精性肝病等其他病因导致的ACLF的临床特征不同,因此,基于国外临床数据建立的ACLF预测模型在我国患者中的应用存在一定局限性[14]。本研究一方面验证了基于中国数据建立的COSSH-ACLFs模型的预测准确性,另一方面比较了COSSH-ACLFs与其他四种临床常用模型在HBV-ACLF患者中预测短期预后的优劣。
本研究的数据资料来自3所医院,避免了单中心数据造成的偏差。根据纳入标准和排除标准,本研究共纳入573例,随访90 d时病死率40.84%,与既往报道[2]结果相近。比较2组一般资料可见,生存组患者年龄小于死亡组(P=0.002),性别组成在两组之间无统计学差异,这与Li等[15]的报道结果相近。死亡组WBC水平、腹膜炎发生率均高于生存组(P值分别为<0.001、0.021),可能由于死亡组感染发生率较高。细菌感染是ACLF患者常见的并发症,并且已成为ACLF的第二大死亡原因[16]。Katoonizadeh等[1]也认为感染是影响ACLF患者预后的重要指标。死亡组中发生消化道出血的发生率大于生存组(P=0.001),且Hb水平低于生存组(P=0.044),可能是消化道出血导致的Hb丢失。此外,严重肝损伤产生的大量胆红素引发快速钙内流、活化鞘磷脂酶等对RBC有毒性作用[17],可导致Hb水平下降,本研究中也发现,死亡组胆红素水平明显高于生存组(P<0.001)。凝血指标和血Alb均反映肝脏合成功能,本研究中发现,生存组凝血相关指标(PT、INR、PTA)及血Alb水平优于死亡组(P值均<0.001),与既往的认识[18-19]一致。最后,笔者还发现HE分级/Cr/Na在两组之间有统计学差异(P值均<0.001),与既往研究[20-21]结果一致。
有研究[22]表明,在酒精为病因的ACLF患者中,CLIF-C ACLFs预测患者28、90 d病死率的准确度高于Child-Turcotte-Pugh、MELD和MELD-Na。Li等[15]在HBV-ACLF患者中发现,CLIF-C OFs预测患者短期病死率的准确度高于MELD、CLIF SOFA和CLIF-C ACLFs。本研究结果显示,COSSH-ACLFs预测HBV-ACLF 90 d病死率的AUC大于其他4个预测模型(MELD、MELD-Na、CLIF-C OFs、CLIF-C ACLFs),与 Wu等[10]的研究结果一致[COSSH-ACLFs预测HBV-ACLF 28、90 d病死率的准确性高于其他5个常用模型(Child-Turcotte-Pugh、MELD、MELD-Na、CLIF-C OFs、CLIF-C ACLFs)]。
本研究的不足之处在于:首先,本研究是一个回顾性分析。其次,由于回顾性研究的限制,未能够与一些新发现的具有预后评估作用的生物标志如乳酸、吲哚菁绿清除试验进行比较。最后,一些研究[23-25]发现,动态MELD较单一MELD分值的临床应用价值更大,因此,如果能够动态评估COSSH-ACLFs可能会有更好的效果。
