尖叶牛樟染色体制片优化与核型分析
2020-06-19官锦燕罗青文谭嘉娜黄海英文明富罗剑飘
官锦燕 罗青文 谭嘉娜 黄海英 文明富 罗剑飘

摘 要:本研究以尖叶牛樟根尖为材料,采用酶解去壁低渗法制片,探讨不同预处理方式和酶解时间对牛樟根尖染色体制片的影响,并对其进行核型分析,以期为牛樟的起源、演化及遗传育种提供一定的理论依据。结果表明:于9:00—11:00进行取材,用0.002 mol/L 8-羟基喹啉液预处理2 h,4%果胶酶和5%纤维素酶酶解5 h,能获得较佳的染色体制片。核型分析结果表明:尖叶牛樟的染色体数目为24条,核型公式为2n=2x=24=22m+2sm,第10对染色体带有随体,属于2B类型,核型不对称系数55.81%。核型对称程度较高,这表明尖叶牛樟可能进化程度较低,属于比较原始的物种。
关键词:尖叶牛樟;根尖;染色体制片;核型分析
中图分类号:Q943.2 文献标识码:A
Optimization of Chromosome Mounting Technique and Karyotype Analysisi of Cinnamomum kanehirae Hay of Sharp Leaves
GUAN Jinyan, LUO Qingwen, TAN Jiana, HUANG Haiying, WEN Mingfu, LUO Jianpiao*
Guangdong key Lab of Sugarcane Improvement Biorefinery / Guandong Provincial Bioengingeering Institute Guangzhou Sugarcane Industry Research Institute, Guangzhou, Guangdong 510316, China
Abstract: In order tooptimize the chromosome mounting technique and explore the chromosome karyotype of C. kanehirae Hay, and to provide important cytological evidences for the study of the evolution, evolutionary characteristics and genetic regularity of camphor plants, the effects of differentpretreatment methods and enzymatic hydrolysis time on the production of C. kanehirae were discussed by the enzymatic dissociation wall low permeability method. The observation showed that pretreated in 0.002 mol/L 8-hydroxyl for 2 h, dissociated in 4% cellulase and 5% pectinase for 5 h could achieve the optimal experimental results. The karyotype analysis showed that the chromosome number was 24, with a karyotype formula 2n=2x=24=22m+2sm. The results demonstrated that the asymmetry index was 55.81%, the karyotype was 2B type, suggesting that C. kanehirae Hay maybe a relatively primitive species.
Keywords: Cinnamomum kanehirae Hay of sharp leaves; root tip; chromosome preparation; karyotype analysis
DOI: 10.3969/j.issn.1000-2561.2020.05.007
牛樟(Cinnamomum kanehirae Hay)隶属于樟科樟属,又名黑樟,为中国台湾地区特有常绿阔叶树种[1]。牛樟具有很高的经济价值,根、茎、叶全株可提炼牛樟精油,木材是雕刻家具的上等材料。此外,牛樟是牛樟芝(Antrodia camphorata)的唯一宿主,牛樟芝在医学上被称为“药芝之王”,常用来醒酒与缓解疲劳,具有免疫调节、保护肝脏等作用[2]。有关牛樟的研究起步晚,研究方向单一且以宏观研究为主,主要集中在牛樟的组培快繁[3-4]、扦插[5]、引种[6]等方面。近年来,在牛樟分子生物学遗传多态性上的研究取得了一些进展[7-8],但有关牛樟细胞遗传学上的研究至今
仍旧空白。
染色体核型分析主要通过研究其染色体数目及形态特征,反映不同物种或品种之间存在的染色体细胞学差异[9]。不同物种的染色体核型模式在进化的过程中不受外界环境因素干扰和影响,在一定程度上反映出其进化的基本特征[10]。因此,植物核型的研究不仅能为种间遗传变异、系统演化以及亲缘关系提供证据,还可以为杂交育种选育及杂种后代鉴定等提供理论依据[11]。樟科植物核型的研究已取得一些进展,已报道过核型研究的樟科植物共有42种,涉及樟属、楠属、润楠屬、新木姜子属、无根藤属和檫木属等多属品种。Okada等[12]于1975年报道了樟科9属16种植物的染色体数目,基数均为12。陈成彬等[13]于1998年报道了樟科5属9种植物的染色体数目,均为2n=24。陈细芳等[14]于2009年报道了浙江楠的染色体数目为2n=24。刘玉香[15]于2013年报道了樟科5属17种植物的染色体数目为24。在这42种植物中,核型类型为“1A”“1B”“2A”“2B”4种类型,尚未发现C类型的核型。其中,樟属中有10种植物的核型已报道,包括大叶樟、沉水樟、阴香、樟树、油樟等,染色体均为24条,核型类型为2B、2A两种类型。至今,有关牛樟的染色体核型分析的研究仍未见报道。因此,本研究以尖叶牛樟根尖为材料,对其染色体制片技术进行优化并对其进行核型分析,为牛樟的演化、进化特征和遗传规律的研究提供重要的细胞遗传学佐证。
1 材料与方法
1.1 材料
试验材料为尖叶牛樟组培苗的根尖,采自广东省生物工程研究所湛江甘蔗研究中心良种组培实验室。
1.2 方法
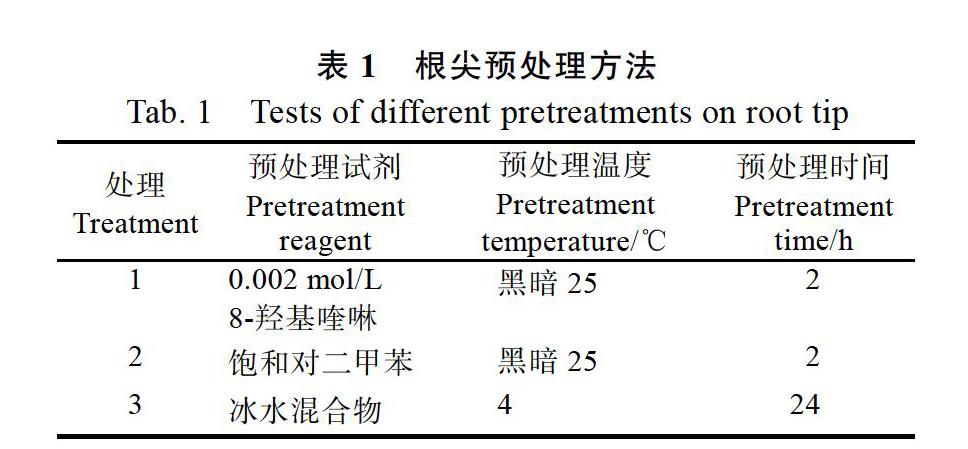
1.2.1 取材和预处理 于9:00—11:00采集牛樟组培苗健壮、白嫩的根尖(0.5~1 cm),分别采用以下方法(表1)进行预处理。再清水冲洗预处理液3~4次,把根尖移至卡诺固定液(无水乙醇∶冰乙酸的比例为3∶1)固定24 h,最后置于70%乙醇中4 ℃保存备用。
1.2.2 染色体标本制备 染色体标本制备采用酶解去壁低渗法,具体步骤参照官锦燕[16]硕士论文。
(1)前低渗:把固定好根尖置于蒸馏水中进行前低渗30 min。
(2)酶解:把步骤(1)的根尖置于盛有5%纤维素酶和4%果胶酶混合液的1 mL离心管中,并置于37 ℃的恒温水浴锅中酶解3~5 h。
(3)后低渗:吸取酶液,缓缓地沿着管壁加入蒸馏水,后低渗30 min。
(4)后固定:吸取蒸馏水,滴加临时配制的固定液,后固定15 min。
(5)涂片:把玻片、臨时配制的固定液均置于冰面上,取1张玻片,先滴3滴固定液,再夹取根尖置于玻片上,用解剖针挑取白色的根尖分生组织,并迅速捣碎再均匀涂抹在载玻片上,再从载玻片一端滴加1滴固定液使细胞扩散,接着在火焰上迅速烘烤,自然风干。
(6)染色:将KH2PO4和Na2HPO4混合缓冲液(pH 6.8)与吉姆萨原液按比例为49∶1配制成工作液,再把干燥的制片置于吉姆萨染色液中染色10~20 min,清水冲洗干净,置烘箱37 ℃烘干。
1.2.3 核型分析 用POTIKA正立显微镜观察,Optika Vision pro拍照系统拍照。选择30个染色体分散且形态较好的细胞进行染色体数目统计,选取5个染色体形态清晰且无重叠的细胞,用Photoshop图像软件进行核型分析。核型分析方法参照李懋学等[17]的标准,核型对称性按照Stebbins[18]的标准划分,染色体形态根据Levan等[19]的方法归类。
臂比(r)=长臂(S)/短臂(L)
染色体相对长度=染色体长度/染色体组总度×100%
平均长度核型不对称系数(As.k)=长臂总长/全组染色体总长×100%
2 结果与分析
2.1 牛樟染色体制片技术的优化
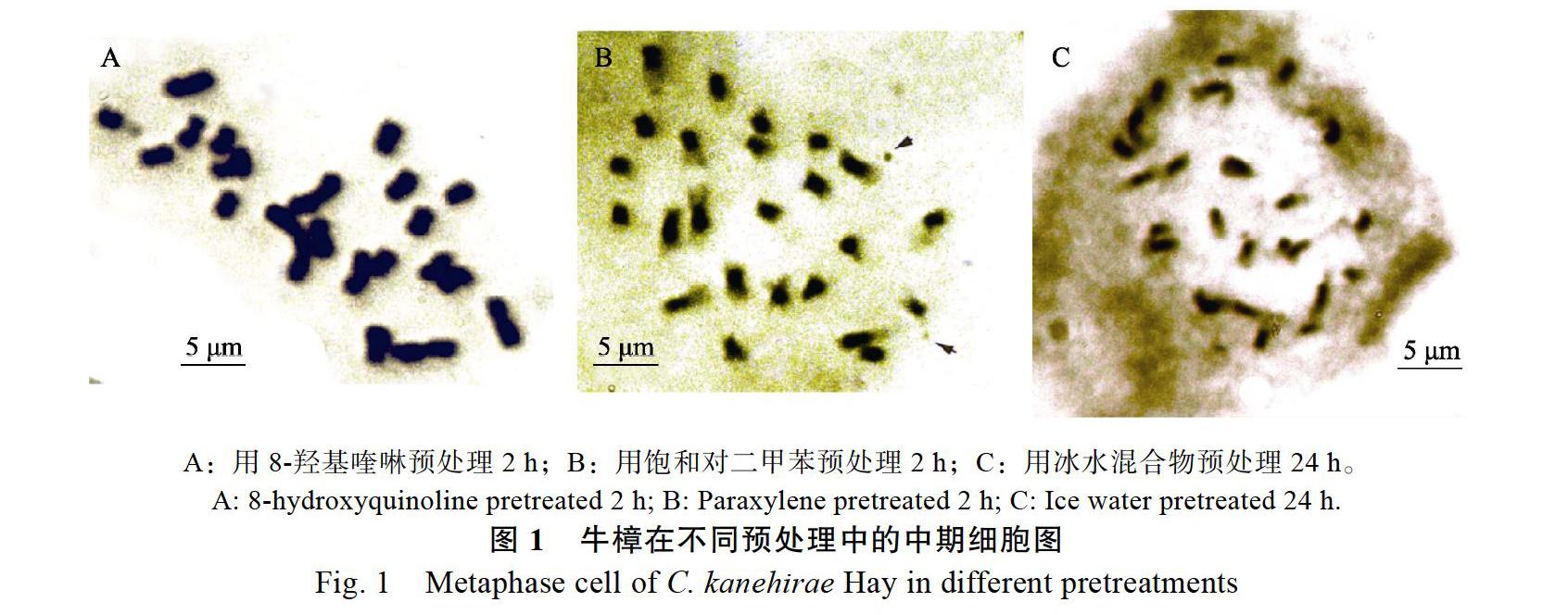
2.1.1 不同预处理方法对染色体制片效果的影响 3种不同预处理方法对牛樟根尖处理的结果表明(表2和图1):不同预处理方法对中期细胞数目及染色体分散效果及清晰度都有一定的影响。8-羟基喹啉预处理2 h所得的中期细胞所占比率为14.37%,明显高于其他处理组,染色体较分散、聚缩程度适中、形态和溢痕清晰,很适合用于核型分析研究。其次是饱和对二甲苯预处理2 h,染色体分散、聚缩,但有拖尾现象、缢痕不够清晰,不适合进行核型分析。而冰水混合物处理效果最差,染色体不够分散和聚缩、形态不清晰,不利于染色体计数和核型分析。
2.1.2 不同的酶解时间对染色体制片效果的影响 不同酶解时间对牛樟染色体制片效果影响的结果表明,酶解时间对牛樟染色体制片效果的影响主要体现在制片背景和染色体的清晰度上(图2)。酶解5 h的细胞效果最佳,没有细胞壁、细胞质很稀薄、背景干净、染色体分散,有利于进行核型分析。酶解4 h细胞效果一般,没有细胞壁、但细胞质比较厚、背景不够干净。酶解3 h制片效果最差(图2),细胞壁没有溶解完、细胞质浓厚、背景不干净,不利于染色体识别和进行核型分析。
2.2 牛樟染色体核型分析
2.2.1 染色体数目 尖叶牛樟的染色体数目为2n=24,为二倍体。
2.2.2 核型特征 尖叶牛樟的染色体核型参数(表3)及染色体核型分析图(图3)分析结果表明,尖叶牛樟的核型公式为2n=2x=24=22m+2sm;
除第8对为近中部着丝点染色体(sm)外,其余为中部着丝粒染色体(m),发现第10对染色体上有随体。其染色体相对长度范围为5.35%~ 12.22%,最长与最短染色体长度比值为2.28,臂比值范围为1.1~2.3,其中臂比值大于2的染色体有1对,为第8对染色体;核不对称系数为55.81%,为2B型。
3 讨论
3.1 尖叶牛樟染色体制片的优化
染色体制片技术是核型分析、基因定位等细胞学研究的基础。不同的物种在取材、预处理、解离和制片方法上有较大的差异,预处理和解离的效果直接关系到制片的质量。刘玉香[15]对17种樟科植物进行核型分析研究,表明以根尖为材料,用0.002 mol/L 8-羟基喹啉溶液预处理2 h,采用压片法在60 ℃的1 mol/L HCl解离3 min能达到理想的处理效果。陈细芳等[14]对浙江楠进行核型分析研究采用对二氯苯饱和预液处理根尖3~5 h,用压片法在60 ℃的1 mol/L HCl解离12~ 15 min也取得较好的效果。陈成彬等[13]采用酶解去壁低渗法对樟科5属9种植物进行核型分析。本研究首次报道牛樟染色体制片技术和核型,研究表明采用8-羟基喹啉在黑暗条件下对根尖预处理2 h,采用酶解去壁低渗法制片并以5%纤维素酶和4%果胶酶混合液酶解5 h,所得制片效果最佳,预处理方式和刘玉香[15]所采用的相同。采用压片法和酶解去壁低渗法均能获得良好效果。
3.2 牛樟染色体数目及核型特征的探讨
同一物种或品种的染色体数目在进化过程中是比较恒定的,染色体核型稳定特征被作为分类指标,对阐述植物进化程度和分类方面有重要意义[20]。前人已开展核型研究的樟科植物共有42种,染色体基数均为12,但染色体倍性不同[12-15]。有38种植物的染色体数目为2n=24条,为二倍体。另4种植物为多倍体,其中无根藤、月桂和美洲檫木3种植物的染色体数目为2n=4x=48条,为四倍体。台湾新木姜子的染色体数目为2n=6x=72,为六倍体。本研究首次报道了尖叶牛樟的染色体数目为24条,核型为2n=2x=24=22m+2sm,符合樟科植物的染色体基数为12的规律。
Stebbins[18]对大量核型资料进行分析,认为核型由对称向不对称发展是植物界核型进化的基本趋势;核型不对称系数越接近50%,核型的对称程度越高,进化程度越低,属于越原始的植物。对已报道的42种樟科植物,发现核型有“1A”“1B”“2A”“2B”4种类型,没有发现“C”类型的核型,说明樟科植物的核型总体上较为对称,在系统进化中可能属于较为原始的类型。其中,樟属中大叶樟、沉水樟等4种属于2B类型,核不对称系数在56.44%~60.78%之间。本研究得出尖叶牛樟核型不对称系数为55.81%,接近50%,且属于2B类型,由此推断尖叶牛樟可能属于比较原始的物种,进化程度较低。
尖叶牛樟常被误认为樟科樟属中的另一树种沉水樟(Cinnamomum micranthum Hayata),两者外形極似,都是高大的常绿乔木[1]。刘玉香等[15]曾报道了沉水樟核型为2n=2x=24=20m+4st,第12号染色体有随体,核不对称系数为58.60%,为2B类型。与本研究中尖叶牛樟的核型和核不对称系数相似,且都有随体(牛樟在第8号染色体上),均为2B类型。可见牛樟和沉水樟不仅外形极似,核内的染色体核型也相似。核型是物种特有的再现性很高的细胞遗传学信息,核型分析的研究对牛樟资源的应用具有非常重要的价值。
参考文献
官锦燕, 谭嘉娜, 罗剑飘, 等. 牛樟的组织培养和植株再生[J]. 南京林业大学学报(自然科学版), 2016, 40(4): 63-68.
Tien A J, Chien C Y, Chen Y H, et al. Fruiting bodies of
Antrodia cinnamomea and its active triterpenoid, antcin K, ameliorates N-nitrosodiethylamine-induced hepatic inflammation, fibrosis and carcinogenesis in rats[J]. The American Journal of Chinese Medicine, 2017, 45(1): 173-198.
戴小英, 雷昌全, 刘新亮, 等. 牛樟组培快繁体系的建立与优化[J]. 南方林业科学, 2018, 46(6): 39-44.
辛亚龙, 唐军荣, 杨宇明, 等. 牛樟组织培养技术研究[J]. 中南林业科技大学学报, 2017, 37(8): 48-53.
章 挺, 邱凤英, 刘新亮, 等. 插穗和基质对牛樟扦插繁殖的影响[J]. 南方林业科学, 2018, 46(4): 15-18, 23.
邢文婷, 许 奕, 陈 培, 等. 台湾牛樟在海南引种栽培及生长特性研究[J]. 热带作物学报, 2018, 39(4): 630-634.
郭 莺, 孟红岩, 林文珍, 等. 牛樟EST-SSR标记的开发及遗传多态性分析[J]. 热带作物学报, 2018, 39(8): 1561- 1569.
Liao P C, Kuo D C, Lin C C, et al. Historical spatial range expansion and a very recent bottleneck of Cinnamomum kanehirae Hay. (Lauraceae) in Taiwan inferred from nuclear genes[J]. BMC Evolutionary Biology, 2010, 10(1): 124.
徐洪国, 祁宏英, 顾灵杰. 黄果龙葵和龙葵染色体制片优化及核型分析[J]. 西北植物学报, 2017, 37(2): 387-393.
谢卓宓, 牛 欢, 古 力, 等. 9种金线莲资源的染色体倍性及其核型分析[J]. 中国现代中药, 2018, 20(8): 920-927.
杨汉波, 饶龙兵, 郭洪英, 等. 5种桤木属植物的核型分析[J]. 植物遗传资源学报, 2013, 14(6): 1203-1207.
Okada H, Tartaka R. Karyological studies in some species of Lauraceae[J]. Taxon, 1975, 24(2/3): 271-280.
陈成彬, 李秀兰, 孙成仁, 等. 中国樟科5属9种植物的核型研究[J]. 武汉植物学研究, 1998, 16(3): 219-222, 294.
陈细芳, 郝明明, 陈 菽, 等. 浙江楠染色体核型分析[J]. 浙江林业科技, 2009, 29(6): 26-28.
刘玉香. 樟科主要属种核型研究及其亲缘关系的ISSR分析[D]. 南昌: 江西农业大学, 2013.
官锦燕. 巴西橡胶树SUT和RZF基因家族物理定位的研究[D]. 海口: 海南大学, 2014.
李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究, 1985, 3(4): 297-302.
Stebbins G L. Variantion and Evolution in Plants[M]. Co1umbia: Columbia University Press, 1950.
Levan A, Fredga K, Sandberg A A. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 1964, 52(2): 201-220.
任文娟, 郭小菲, 姜立娜, 等. 菜用大黄染色体制片优化及核型分析[J]. 华北农学报, 2013, 28(5): 128-132.
