将皮肤细胞“转分化”为肝细胞
2020-06-19惠利健
惠利健

惠利健惠利健 中国科学院上海生命科学院上海生物化学和细胞研究所研究员,上海科技大学生命科学与技术学院特聘教授、博士生导师。主要研究方向为肝脏疾病的分子病理机制,特别关注肝脏再生和癌化过程中细胞属性维持与转变(包括转分化、去分化等)的作用和分子机制。
2019年5月,中国科学院上海生命科学研究所惠利健等完成的“细胞属性转变的基础和应用研究”项目荣获2018年度上海科学技术奖自然科学一等奖。该项目以肝细胞为核心,围绕细胞的转分化和癌化开展研究,实现了小鼠和人类跨胚层转分化肝细胞;证明了转分化肝细胞具有较完备的肝功能,对小鼠肝脏代谢性疾病和急性肝衰竭有治疗效果;揭示了转分化和癌化的共同调控机制,实现了转分化肝细胞的大规模扩增,为其临床应用提供了技术保障。
什么是细胞属性的转变?皮肤细胞是通过什么途径“转分化”为肝细胞的?该项目成果的应用前景如何?一起来听听中国科学院上海生命科学研究院惠利健研究员的分析。
需要了解的三个概念
1.再生 很多人都知道,低等动物的再生能力很强,比如大鲵、蝾螈等,其肢体受损后能够很快再生,且可以完美恢复到损伤前的“原貌”。随着物种进化,在哺乳动物等高等动物中已经看不到这种强大的再生能力。人体的大多数重要脏器和组织(如神经系统、心脏、肺、肾脏等)都不具备有效的自我修复和再生能力。而再生医学就是一门促进创伤与组织器官缺损的生理性修复,进行组织器官再生与功能重建的学科。
2.干细胞 干细胞是一类具有多向分化潜能和自我更新能力的细胞,在体内能够分化产生某种特定组织类型的细胞。正因为如此,它一直是再生医学研究的热点领域。目前,尝试将干细胞用于治疗疾病的研究很多,外周造血干细胞移植治疗白血病是干细胞治疗领域的成功典范。
干细胞分为胚胎干细胞和成体干细胞。胚胎干细胞具有发育全能性,从理论上说可以诱导分化为机体所有种类的细胞。成体干细胞是存在于已经分化组织中的未分化细胞,这种细胞能够自我更新并在特定条件下转化为该类型组织的细胞,如造血干细胞、骨髓间充质干细胞、神经干细胞、肝干细胞、皮肤表皮干细胞、肠上皮干细胞、视网膜干细胞、胰腺干细胞等。
3.转分化 由于成体干细胞的获取并不容易,疗效也不太确定。于是,科学家们大胆设想,如果可以找到一种使细胞从一种分化属性直接转化为另一种分化属性的方法,就能绕开“干细胞”这个环节,开辟一条新路。不过,既往的理论均认为,在高等动物的发育过程中,干细胞向终末细胞分化的过程是单向的,且在正常生理状态下,终末分化细胞是稳定的,不会转变为其他类型的细胞。
可喜的是,近年来有多个国家的研究人员发现,在特定条件下,细胞的属性是可以转变的,这就是“转分化”。简而言之,“转分化”就是一种可以直接将某种终末分化细胞转分化为另一种终末分化细胞的过程,比如在特定条件下,皮肤细胞可以变为肝细胞。
皮肤细胞是如何“变身”为肝细胞的
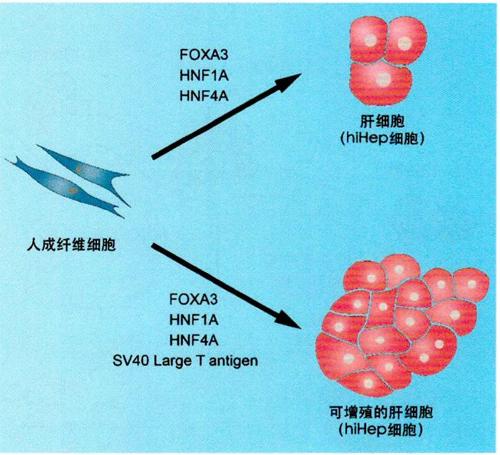
图1:成纤维细胞{皮肤细胞}转分化为干细胞示意图
惠利健研究员用生动的比喻来解释“转分化”这个术语:“不同的细胞就像不同职业的人,在各自的工作岗位上发挥着不同的作用。‘转分化就是让一个人轉行,比如让农民转行当工人,且随着转行,他所从事的工作也相应改变了。”
中国是肝病大国,目前约有4亿肝病患者。对终末期肝病患者而言,最有效的治疗手段是肝移植。然而,由于供肝短缺和治疗费用高昂,大量患者因无法得到及时治疗而死亡。
经过数年的研究,惠利健研究员团队通过过表达FOXA3、HNF1A和GATA4基因,成功将小鼠成纤维细胞(皮肤细胞)直接转分化为肝细胞(hiHep细胞),首次证明了肝脏以外的体细胞可以被诱导直接转化为肝细胞(hiHep细胞)。该研究在国际上属首次报道,具有开创性意义(图1)。
“工种”变,“功能”也变
惠利健研究员告诉记者,将皮肤细胞成功转分化为肝细胞,只能算是迈出了第一步。虽然肝细胞在体内具有强大的再生能力,但在体外,肝细胞的这种能力就完全消失了。于是,如何让这些转分化而来的肝细胞在体外也能够大量扩增,成为摆在他们面前的又一难题。
在经历了一次次失败后,惠利健团队终于发现了使肝细胞在体外实现大量扩增的办法。他们发现,细胞衰老、凋亡的信号通路是转分化的关键负调控机制,只要通过抑制相关通路,就能实现转分化肝细胞的大规模扩增。
肝细胞有了,大量扩增也不是问题了,那么这些从皮肤细胞“转行”过来的肝细胞们,是否具有与肝脏细胞类似的功能呢?要知道,肝脏是人体内的“化工厂”,具有解毒、合成、分泌、代谢等多种功能,除了肝移植以外,目前尚无替代品。
这一点,惠利健研究员早就想到并已通过动物实验证实了:这些“转分化”而来肝细胞具有较完备的肝功能,如积累糖原、分泌血清白蛋白、吸收和积累脂质、药物代谢和胆汁排泄等,对小鼠肝脏代谢性疾病和急性肝衰竭具有治疗效果。简而言之,这些从皮肤细胞“转行”而来的肝细胞并非“徒有其表”。
“生物人工肝”即将造福重症肝病患者
既然转分化肝细胞具有与肝脏细胞类似的功能,那么是否可以从患者身上获取皮肤细胞,将其转分化为肝细胞,再回输给患者,使之发挥肝细胞的功能呢?惠利健研究员表示,这一做法从理论上说是可行的。不过,考虑到在细胞转分化过程中进行过一些遗传学操作,若直接将这些转分化肝细胞输入人体,可能存在一定的风险。因此,他们转变了思路,设计了一个与肾脏透析类似的“生物人工肝”装置(图2)。
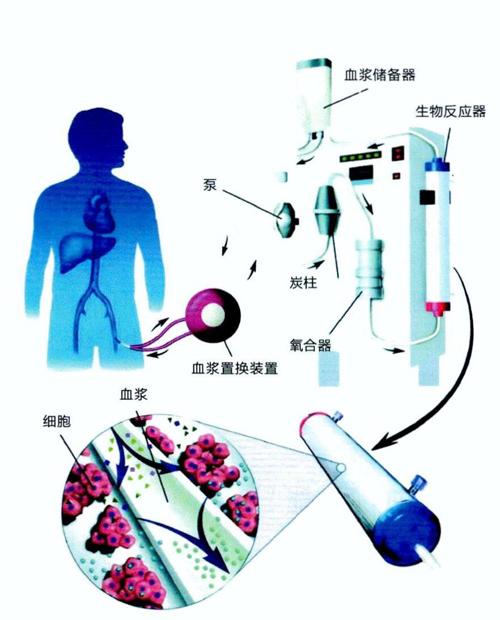
图2:生物人工肝示意图
动物实验证实,将肝衰竭动物的血浆在体外经“转分化肝细胞生物人工肝”解毒、代谢并获得营养成分后,再回输到动物体内,可以起到暂时替代肝脏的作用,同时也能避免体外培养的转分化肝细胞进入体内可能引发的种种风险。在此之前,由于缺乏肝细胞来源,生物人工肝主要采用动物(猪)的肝细胞或人类的肝肿瘤细胞。
惠利健研究员表示,转分化肝细胞生物人工肝目前已经实现了技术专利授权与转化,并已经在部分医院开展临床研究。相信在不久的将来,这一成果将使大量重症肝病患者获益。
“转分化”与“癌化”:调控机制相同,有望带来癌症治疗新策略
与转分化类似,持续的组织损伤会造成细胞属性的恶性转变——癌化,使正常细胞转变为恶性增殖的癌化细胞。
“转分化和癌化是细胞属性转变的不同形式,存在共同的调控机制。”惠利健研究员告诉记者,“我们的研究发现一个重要促癌基因Survivin,它在肝脏损伤再生中对胆管反应来源的肝干细胞活化进行调控。这一发现对于建立促进再生、避免癌化的精准治疗具有重要意义。”
最新进展:从“转分化”到“去分化”,创新永远在路上
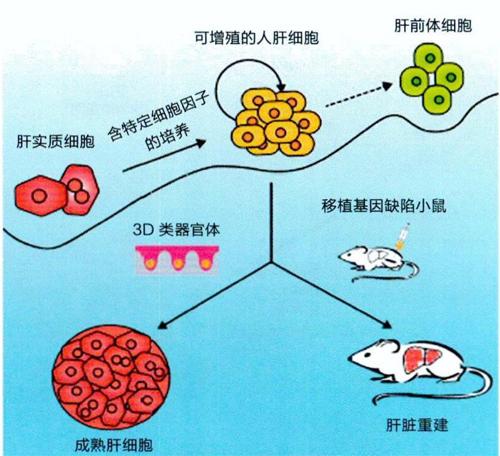
圖3:去分化示意图
在进行“转分化”研究(将一种细胞转变为另一种细胞)的同时,惠利健研究团队又将目光聚焦于“去分化”的研究(图3)。所谓“去分化”,通俗地说,就是在特定条件下,体内具有可塑性的细胞会发生“返祖”现象,转变为具有分化潜能的前体细胞。惠利健研究员团队发现,肝细胞在遭受损伤的情况下,会“去分化”为肝前体细胞(也可称为“肝干细胞”)。同时,他们还掌握了使肝干细胞在体外大量扩增的技术,可以将肝干细胞在体外增殖10 000倍,并证明了这些细胞在体内具有分化为肝细胞的能力。惠利健研究员表示,“去分化”+体外扩增技术使肝干细胞的来源不再是问题,且由于没有经过遗传学操作,这些细胞对人体是安全的。未来,如果这些肝干细胞能够应用于临床治疗,将有望开创肝脏再生新思路,甚至有望使一部分肝衰竭患者免于肝移植。