去甲斑蝥素对人未分化甲状腺癌FRO细胞增殖和凋亡的影响及机制▲
2020-06-19许景伟王晓鑫赵雪松陈宏月
樊 丽 许景伟 王晓鑫 赵雪松 陈宏月
(1 齐齐哈尔医学院医药科学研究院,黑龙江省齐齐哈尔市 161006,电子邮箱:fan123456li@126.com;2 齐齐哈尔医学院附属第一医院普通外科,黑龙江省齐齐哈尔市 161041)
甲状腺癌是最常见的内分泌及头颈部恶性肿瘤,约占内分泌相关恶性肿瘤的 95%,其发病率在女性恶性肿瘤中位于的第5位[1]。未分化甲状腺癌虽然只占甲状腺癌的2%左右,但其恶性度高、进展快,预后极差,常规抗肿瘤治疗方法效果甚微,且多数患者确诊时已处于晚期,伴有远处转移,部分患者生存期仅半年左右,5年生存率低于10%[2-4]。斑蝥属鞘翅目,芜菁科昆虫,斑蝥素是从斑蝥体内提取出来的一种半萜烯毒素,具有较好的抗肿瘤作用[5-6]。但由于其具有较强的毒副作用,尤其对消化系统及泌尿系统的毒性较大,限制了其临床应用。改造斑蝥素的结构,降低其毒副作用,已经成为研究热点。去甲斑蝥素(norcantharidin,NCTD)是我国首先研发的抗肿瘤药物,由斑蝥素脱去1,2位甲基制成,保留了其抗肿瘤活性的同时,减少了毒副作用[7]。目前鲜见有关NCTD抑制未分化甲状腺癌细胞增殖的研究。本研究以NCTD处理人未分化甲状腺癌 FRO 细胞,观察其对 FRO 细胞增殖的抑制作用,并初步探讨其作用机制。
1 材料与方法
1.1 细胞来源与主要试剂 甲状腺癌细胞系FRO细胞由中科院上海生命研究院提供;NCTD 由贵州金桥药业有限公司提供(批号:JRSW170311-1);杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)培养基由美国Sigma公司提供(批号:8198451);胎牛血清由美国Gibco公司提供(批号:42G5182K);细胞计数检测(cell counting kit-8,CCK-8)试剂盒与二甲基亚砜(dimethyl sulfoxide,DMSO)均购自上海碧云天生物技术有限公司(批号:C0038、ST1276);M-MLV反转录试剂盒购自Invitrogen公司(批号:K1622);SYBR Green qPCR SuperMix购自美国ABI公司(批号:4368708);吖啶橙/溴乙啶(acridine orange/ethidium bromide,AO/EB)试剂购自罗莱宝科技有限公司(批号:20171029);线粒体膜电位检测试剂盒购自上海碧云天生物技术有限公司(批号:022618180620)。
1.2 实验方法
1.2.1 细胞培养与分组干预:复苏FRO细胞,并接种于含10%胎牛血清的DMEM培养液中,在37℃、5%CO2培养箱中培养,细胞贴壁生长后每2 d换液1次,生长达到90%孔底面积时经胰酶消化传代。取对数生长期的细胞,分为空白对照组(0 μg/mL组)以及NCTD低、中、高剂量组(10 μg/mL组、20 μg/mL、40 μg/mL组,均采用DMEM配制),各剂量加入相应剂量的 NCTD,空白对照组加入等体积DMEM培养基。
1.2.2 CCK-8法检测细胞活性: 收集对数生长期的细胞,以5 000个/孔加到96孔培养板中,每孔100 μL;于37.0℃,5% CO2培养箱中培养,至细胞长满孔底后吸出培养基,分别加入含终浓度为0、5、10、20、40、80 μg/mL的NCTD的培养液100 μL继续培养,每个浓度设5个平行孔,分别于12 h、24 h、48 h取出培养板,加入含10 μL CCK-8溶液的无血清培养基继续培养4 h,于酶标仪测定450 nm处的吸光度(A)值。计算细胞的生长抑制率。抑制率=[(对照孔A-实验孔A)/(对照孔A-空白孔A)]×100%。
1.2.3 平板克隆形成实验:取对数生长期的细胞以300个/孔接种于6孔板,每孔2.5 mL。按照1.2.1的方法将细胞分组干预后置于37℃、5% CO2的培养箱中继续培养,每隔3 d换液一次,培养液与初始干预时所用培养液相同。培养2周后,弃去培养基,用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗2次,甲醇固定15 min,PBS清洗3次,用0.1%结晶紫染色液染色1 h,PBS 洗净晾干后于显微镜下观察细胞集落数量并拍照。以细胞数大于50个为1个克隆,克隆形成率=形成克隆数/接种细胞数,实验重复3次,取平均值。
1.2.4 AO/EB实验:取对数生长期的细胞,将细胞数调整至1×105个细胞/mL,接种于6孔板中培养24 h后,按照1.2.1方法将细胞分组干预,置于37℃、5% CO2的培养箱中继续培养24 h,弃去上清液,PBS洗涤细胞,4%多聚甲醛固定10 min,滴加AO与EB等体积混合的染料,激光共聚焦扫描并拍照,观察细胞凋亡情况。
1.2.5 实时定量PCR检测:检测B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2 )和Bcl-2 相关X蛋白(Bcl-2-associated X protein,Bax)mRNA表达水平。按照1.2.4方法干预细胞24 h后收集各组细胞,按照试剂盒方法提取总RNA,经微量紫外分光光度计检测RNA浓度及纯度。将RNA反转录成cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,进行实时定量PCR。按试剂盒说明加入相应的反应物,反应体系总体积为50 μL。反应条件为:95℃ 3 min,95℃ 30 s,60℃ 30 s, 40个循环。Bcl-2上游引物为GTGACTTCCGATCAGGAAGG,下游引物为CTTCCAGACATTCGGAGACC;Bax上游引物为AGTAACATGGAGCTGCAGAGG,下游引物为ATGGTTCTGATCAGTTCCGG;GAPDH上游引物为AGCCACATGGCTCAGACAC,下游引物为GCCCAATACGACCAAATCC。采用2-△△Ct计算目的基因的表达水平。实验重复3次。
1.2.6 JC-1法检测细胞线粒体膜电位:按照1.2.4方法干预细胞24 h后收集各组细胞。分别加入0.5 mL新鲜DMEM培养基和0.5 mL JC-1染色工作液,充分混匀,置于细胞培养箱中避光孵育20 min,1 000 r/min离心5 min弃去上清,用预冷的JC-1缓冲液洗涤2次,采用美国BD FACSCalibur流式细胞仪检测线粒体膜电位。
1.3 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以(x±s)表示,多组样本间均数比较采用单因素方差分析,两两比较采用LSD-t法进行。以P<0.05为差异有统计学意义。
2 结 果
2.1 NCTD对FRO细胞增殖的影响 不同浓度NCTD处理FRO细胞12 h、24 h、48 h后,随着浓度增大、时间延长,各组细胞抑制率增加(均P<0.05 )。40 μg/mL组作用24 h后,对FRO细胞增长抑制率为52.48%,达到半数致死率,见表1,故本实验采用10、20、40μg/mL NCTD作用细胞24 h进行观察。
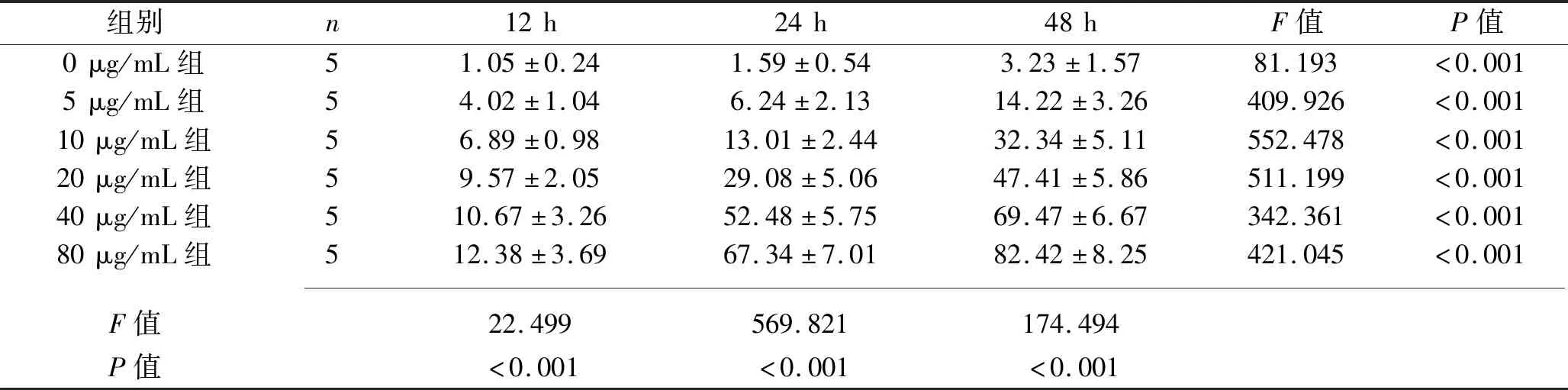
表1 不同浓度NCTD干预后FRO细胞增殖抑制率(x±s,%)
2.2 NCTD对FRO细胞克隆形成的影响 0、10、20、40 μg/mL组克隆形成率依次降低(均P<0.05),克隆集落逐渐变小。见图1及表2。
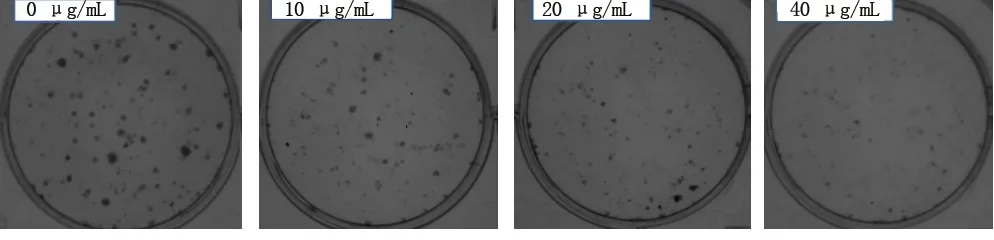
图1 不同浓度NCTD干预后FRO细胞克隆形成情况
2.3 NCTD对FRO细胞凋亡的影响 AO可以进入细胞膜完整的细胞,与DNA结合发出绿色荧光;EB可进入破损的细胞膜,与DNA结合发出橙红色荧光,并可见核固缩及凋亡小体。AO/EB实验结果显示,0 μg/mL组镜下可见均一的绿色荧光,核型结构正常;10、20、40 μg/mL组正常细胞数量逐渐减少,凋亡细胞数逐渐增多,绿色荧光逐渐转为橙红色。10 μg/mL组可见核固缩、边集、新月形等早期凋亡形态。20 μg/mL和40 μg/mL组可见一些细胞核发生碎裂,高度聚集等形态,核被染色成橘红色,且40 μg/mL组较20 μg/mL更加明显。见图2。
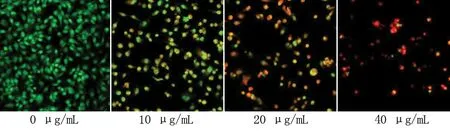
图2 不同浓度NCTD干预后FRO细胞凋亡的情况(×200)
2.4 NCTD对FRO细胞Bcl-2和Bax mRNA表达的影响 0、10、20、40 μg/mL组Bax mRNA相对表达水平依次升高,Bcl-2 mRNA相对表达水平依次降低(均P<0.05),见表2。

表2 不同浓度NCTD干预后FRO细胞Bcl-2和Bax mRNA 表达量、克隆形成率及线粒体膜电位比较(x±s)
注:与0 μg/mL 组比较,aP<0.05;与10 μg/mL组比较, bP<0.05;与20 μg/mL 组比较,cP<0.05。
2.5 NCTD对FRO细胞线粒体膜电位的影响 右上象限表示JC-1在细胞内以聚合物形式存在,细胞线粒体膜电位升高,并发出红色荧光;右下象限表示JC-1在细胞内以单体形式存在,细胞线粒体膜电位降低,并发出绿色荧光。流式细胞结果显示,0、10、20、40 μg/mL组右下象限细胞比率依次升高,即细胞线粒体膜电位依次降低(均P<0.05)。见图3及表2。

图3 不同浓度NCTD干预后FRO细胞线粒体膜电位
3 讨 论
近年来甲状腺癌发病率呈逐年快速增长趋势,其中恶性程度最高的是未分化甲状腺癌,迄今尚无特别有效的治疗方法。未分化甲状腺癌生长迅速,且不可控制,很快累及到周围组织,如气管、血管、神经和肌肉等,并伴有远处器官转移[4]。斑蝥用于肿瘤治疗已有两千多年的历史,但由于其毒副作用大,限制了其临床应用。NCTD是我国拥有自主知识产权的抗肿瘤药物之一,对多种肿瘤治疗有效,尤其对消化系统肿瘤效果较好,已成为当前抗肿瘤药物研究的热点[8]。
Bcl-2家族蛋白在细胞凋亡中发挥着重要作用,主要分布于线粒体外膜、内质网和核膜中。其中抗凋亡蛋白Bcl-2和促进凋亡蛋白 Bax是该家族的主要成员[9]。Bcl-2可以维持线粒体膜电位、钙离子的动态平衡,同时抑制线粒体释放 细胞色素C和半含胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase) 等凋亡因子,从而发挥抗凋亡作用。Bax则是最早发现的促进凋亡的蛋白之一。一方面,Bax同源聚合物插入线粒体外膜形成通道,释放钙离子,对Bax有协同作用,可以激活Caspase-9,还可以发挥对Caspase蛋白酶家族的酶解级联激活作用,最终导致细胞凋亡;另一方面,Bax与Bcl-2形成异源二聚体,对Bcl-2产生阻抑作用。研究表明,Bax/Bcl-2蛋白比例是决定细胞凋亡的关键因素[10-11]。本研究结果显示,NCTD对FRO细胞的生长抑制作用呈浓度依赖性,且随着NCTD浓度的增加,Bcl-2 mRNA表达水平逐渐降低,Bax mRNA表达水平逐渐升高;AO/EB实验结果也显示,与0 μg/mL组比较,其他组细胞均出现凋亡,且呈浓度依赖性。这提示NCTD可浓度依赖性地抑制FRO细胞增殖,并促进细胞凋亡。
线粒体由内外双层膜组成,是促进细胞能量转换、参与细胞凋亡的重要细胞器。由于线粒体内膜两侧的质子与其他离子浓度呈不对称分布,因而形成线粒体膜电位。线粒体膜电位是维持线粒体正常功能的必要条件。研究显示,线粒体膜电位下降是细胞凋亡的前提,其变化早于线粒体的形态变化及DNA 的断裂等[12-13]。本研究的JC-1实验结果显示,随NCTD浓度的增加,细胞线粒体膜电位随之降低,提示NCTD可能通过线粒体途径诱导FRO细胞凋亡。
综上所述,NCTD可以抑制FRO细胞增殖,并促进其凋亡,且呈浓度依赖性,其相关机制可能与降低线粒体膜电位有关。
