Cd胁迫对马铃薯根际土壤细菌群落组成及多样性的影响
2020-06-19付天岭何腾兵成剑波符东顺
谢 朝,付天岭,何腾兵,3,成剑波,符东顺,罗 胜
(1.贵州大学 农学院,贵州 贵阳 550025;2.贵州省山地畜禽养殖污染控制与资源化技术工程实验室,贵州 贵阳 550025;3.贵州大学 新农村发展研究院,贵州 贵阳 550025;4.贵州大学 生命科学学院,贵州 贵阳 550025)
国土资源部与环境保护部2014年发布的《全国土壤污染状况调查公报》显示,我国土壤总的点位超标率为16.1%,耕地土壤重金属点位超标率为19.4%。其中,Cd污染点位超标率达7.0%,位居无机污染物之首[1]。Cd元素是环境中移动性和生物毒性最强的重金属之一,极易被植物根系吸收且部分被运输到植物地上部[2-3]。由于土壤Cd污染对农作物生长、产量以及食品质量安全构成严重威胁,农田土壤环境Cd污染问题已成为土壤和环境科学领域的研究热点。
土壤微生物生物量在一定程度上可指示参与调控土壤能量和养分循环以及有机质转化的微生物数量[4]。一般认为,微生物生物量碳占土壤总有机碳的1%~3%,绝对数量虽然不大,却在有机质代谢、养分转化及污染物降解等过程中扮演重要角色,是土壤活性养分的储备库,是土壤肥力的重要参数,而且对外界环境变化反应灵敏,是土壤生态系统稳定性变化的警示器[5]。许多研究表明,土壤微生物群落活性、组成、多样性对调控土壤重金属的生物地球化学过程及作物的生长发育具有重要作用[6-21]。土壤微生物生物量对重金属污染极其敏感[22-24]。曾路生等[25]的研究表明,低浓度Cd污染胁迫下,水稻根际土壤微生物量碳和氮与Cd浓度呈正相关,而在较高浓度的Cd污染胁迫下,水稻根际土壤微生物量碳和氮与镉浓度呈负相关。有研究发现,土壤细菌群落随重金属含量的增加而减少[26]。长期使用污水灌溉会对土壤造成重金属污染,微生物生物量随Cd、Pb、Zn含量的增加而下降[27]。由此可见,仅从微生物生物量变化角度不足以全面揭示微生物群落对重金属污染胁迫的响应,需进一步结合微生物群落组成和结构多样性变化特征才能更全面认识重金属污染胁迫对微生物群落的影响。
随着分子生物技术的发展,高通量测序技术在分析微生物的群落结构方面具有独特的优势,可通过从环境样本中直接获取的总DNA进行文库构建并测序[28],能更加真实地揭示原位环境中微生物群落的复杂性、多样性及物种构成[29]。前人的研究表明,马铃薯土壤Cd污染点位超标率较高,马铃薯组织中Cd含量不超标,且后者主要是受作物品种的影响[30-31]。但这些研究忽略了马铃薯根际土壤微生物群落组成及多样性对土壤-作物系统中重金属迁移转化的调控作用,且目前关于马铃薯根际土壤微生物群落组成及多样性对重金属胁迫响应的研究鲜见报道。鉴于此,利用高通量测序技术探讨Cd 胁迫对马铃薯根际土壤中细菌群落组成和多样性的影响,旨在揭示Cd胁迫下马铃薯根际土壤细菌群落结构的差异及根际细菌对Cd胁迫的响应特征,为深入研究马铃薯根际土壤细菌与耐Cd性之间的关系提供理论基础。
1 材料和方法
1.1 试验材料
供试土壤采集于贵州省花溪区孟关乡耕地表层土壤(-20 cm),土壤类型为黄壤。盆栽试验前将供试土壤自然风干,捡出杂物,过1 cm 筛后备用。土壤的基本理化性质:有机质 30.7 g/kg、全氮0.97 g/kg、全磷1.03 g/kg、全钾 10.79 g/kg、镉 1.25 mg/kg,pH值5.2。马铃薯品种为贵州主栽品种青署9号。
1.2 试验设计及指标测定
1.2.1 土壤处理与盆栽试验 以CdCl2·H2O配制1 g/L的镉溶液作为外源Cd胁迫的母液,向供试土壤中分别添加0、10、50、100 mg/kg的外源Cd溶液,每个处理3次重复,依次记为Cd0、Cd10、Cd50、Cd100。使用喷壶喷洒Cd溶液,将土壤与 Cd 溶液充分混匀后装入直径和高度分别为30、40 cm的塑料盆钵,每盆装入混匀的土壤10 kg,浇水至田间持水量的60%,沉积 7 d后种植马铃薯。种薯选用25 g左右带有2个薯眼,表面光滑、干净清洁、健康的薯种。使用 0.5%的多菌灵水溶液对种薯消毒杀菌,并将其晾晒至切面完全干燥。种植前 20 d对马铃薯进行催芽处理。每盆一次性施入复合肥(氮∶磷∶钾为15∶15∶15) 10 g 作为基肥,在块茎形成期追施 2 g 尿素。于2018年3月8日贵州大学盆栽实验场进行盆栽试验,温度与当地外界温度保持一致,试验期间定时浇水(2 d浇灌1次)。
1.2.2 土壤样品采集 马铃薯种植5个月后,采用抖落法采集马铃薯根际土壤样品。具体采样方法:将马铃薯植株连同周围的土体取出,抖掉根系外围土,取根系附近的表层土壤,将取到的土样混合,作为根际土。共采集12份土壤样品,将采集的样品每份平均分成2份,1份鲜样放在-4 ℃装有干冰的保温箱中送往上海美吉生物医药科技有限公司进行土壤细菌测序,另1份剔除植物残体和石块后自然风干,用于测定土壤基本性质。
1.2.3 土壤理化性质分析 土壤pH值采用水浸提—电位法(水∶土为2.5∶1)测定;土壤有机质采用重铬酸钾容量—外加热法测定;土壤重金属Cd采用HF-HNO3-HClO4加热消解,石墨炉原子吸收分光光度计(ICE-3000)测定;全氮采用H2SO4-HClO4消煮—蒸馏法测定;碱解氮采用碱解扩散法测定;全磷采用H2SO4-HClO4消煮—钼锑抗比色法测定;速效磷采用0.5 mol/L NaHCO3溶液浸提—钼锑抗比色法测定;全钾采用氢氧化钠熔融法测定;速效钾采用1 μmol/L乙酸铵浸提—原子吸收分光光度法测定;土壤含水量采用烘干法测定。
1.2.4 土壤 DNA 提取及PCR反应 采集的土壤样品根据E.Z.N.A.®soil试剂盒(Omega Biotek,USA)说明书抽提总DNA。DNA浓度和纯度利用NanoDrop 2000(Themo,USA)检测,通过1%琼脂糖凝胶电泳检测DNA质量;通过引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对V3-V4可变区进行PCR扩增,扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环;72 ℃延伸 10 min。
1.2.5 文库构建、测序 使用2%琼脂糖凝胶回收PCR产物,通过AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。通过QuantiFluorTM-ST(Promega,USA)进行检测定量。根据Illumina MiSeq 平台(Illumina,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库[32]。构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA片段。利用Illumina公司的Miseq PE300平台进行测序(由上海美吉生物医药科技有限公司完成)。
1.3 数据分析
对测得的所有序列进行 OTU(Operational taxonomic units,操作分类单元) 划分,基于97%的相似性生成OTU表格。应用 Mothur 软件中的Summary.single 命令,计算Chao1、Shannon 及 Simpson 3 种常用生物多样性指数。基于 Alpha 多样性指数进行稀释性分析。使用 Qiime 平台与 RDP classifier 贝叶斯算法对 97%相似水平的 OTU代表序列进行分类学分析(置信度阈值为 0.7),其中以 Unite 为数据库,得到不同含量Cd处理样本细菌在门和属水平上的组成[33-34]。分类学数据库中出现的一些分类学谱系中的中间等级没有科学名称,以Norank作为标记。分类学比对后根据置信度阈值的筛选,会有某些分类谱系在某一分类级别分值较低,以Unclassified标记[35]。使用相关性 Heatmap分析环境因子与所选物种之间的相关性。采用SPSS 17.0软件分析Cd污染水平与细菌群落组成和多样性间相关性[36]。
2 结果与分析
2.1 Cd胁迫下马铃薯根际土壤样品细菌的OTU聚类分析
由图 1可知,4个处理(Cd0、Cd10、Cd50、Cd100) 土壤样本中分别检测到1 405、1 974、1 412、1 178个OTU,其中共有的 OTU 为929个,特有的 OTU 依次为51、486、43、27个,分别占土壤样本Cd0、Cd10、Cd50、Cd100总OTU 的 3.63%、24.62%、3.05%、2.29%。不同处理土壤所含OTU数排序为Cd10>Cd50>Cd0>Cd100,即在Cd含量为10 mg/kg时OTU数最多,微生物类群最丰富。当Cd含量为100 mg/kg时OTU数最少,微生物类群最少。
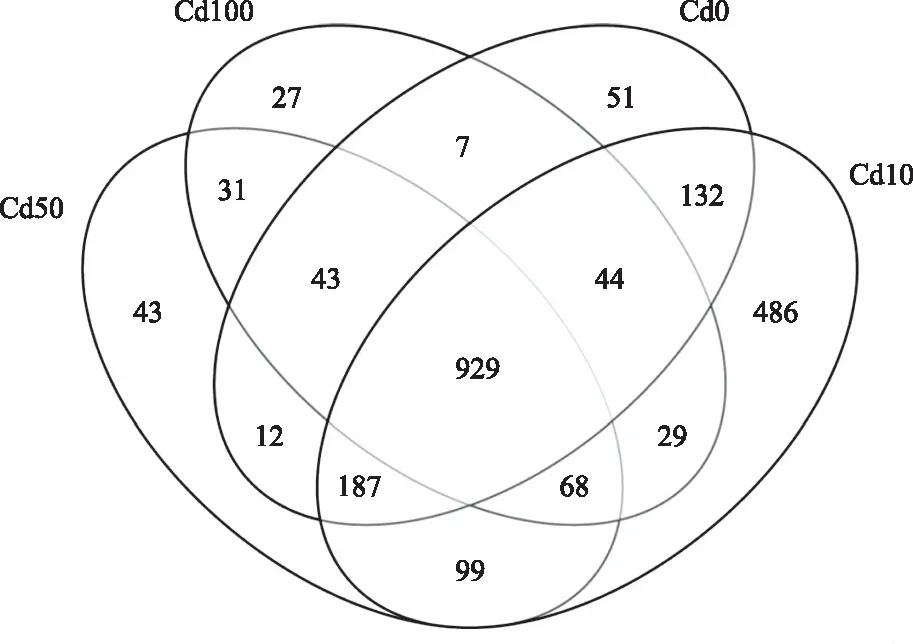
图1 Cd胁迫下马铃薯根际土壤样品细菌 OTU 数量韦恩图Fig.1 Wayne map of bacterial OTU number in potato rhizosphere soil samples
2.2 Cd胁迫下马铃薯根际土壤细菌的多样性分析
由Cd胁迫下马铃薯根际土壤细菌群落丰富度及多样性指数(表1)可知,从4个不同处理(Cd0、Cd10、Cd50和Cd100)的土壤样本分别获取了63 224、61 113、47 293、42 929条优质序列,且各样本覆盖率均在99%以上,表明此次测序的结果真实地反映了各个处理土壤中微生物的情况。Alpha多样性指数中,Cd10处理土壤细菌的Chao1指数最高,而Cd100处理土壤细菌的Chao1指数最低,说明Cd10处理土壤细菌群落的丰富度最高,Cd100处理土壤细菌群落的丰富度最低。各处理土壤中细菌的Shannon和Simpson指数大小分别依次表现为Cd10>Cd50>Cd0>Cd100和Cd100>Cd50>Cd0>Cd10。其中,Cd100处理的Simpson指数最高,Shannon指数最低,表明该处理的土壤细菌群落多样性最低。随着Cd含量的增加,土壤细菌群落多样性逐渐降低,表明土壤细菌群落多样性受Cd含量的影响。
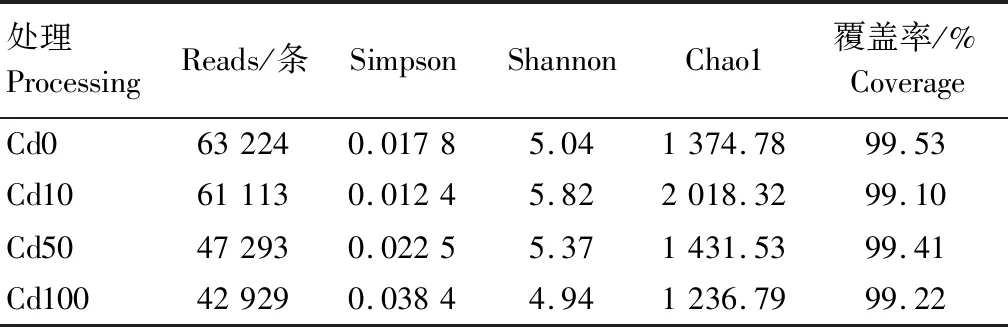
表1 Cd胁迫下马铃薯根际土壤细菌群落的丰富度及多样性指数Tab.1 Bacterial community richness and diversity index in potato rhizosphere soil under Cd stress
由图2可知,4 个不同处理的土壤细菌稀释性曲线均呈先上升随后趋于平缓的趋势,更多的数据量只会产生少量新的OTU,说明取样基本合理,样本能够比较真实地反映不同处理土壤中细菌群落。结合覆盖率和稀释性曲线数据可知,测序结果包含了大多数细菌类群,可以反映不同处理土壤中细菌群落结构组成。
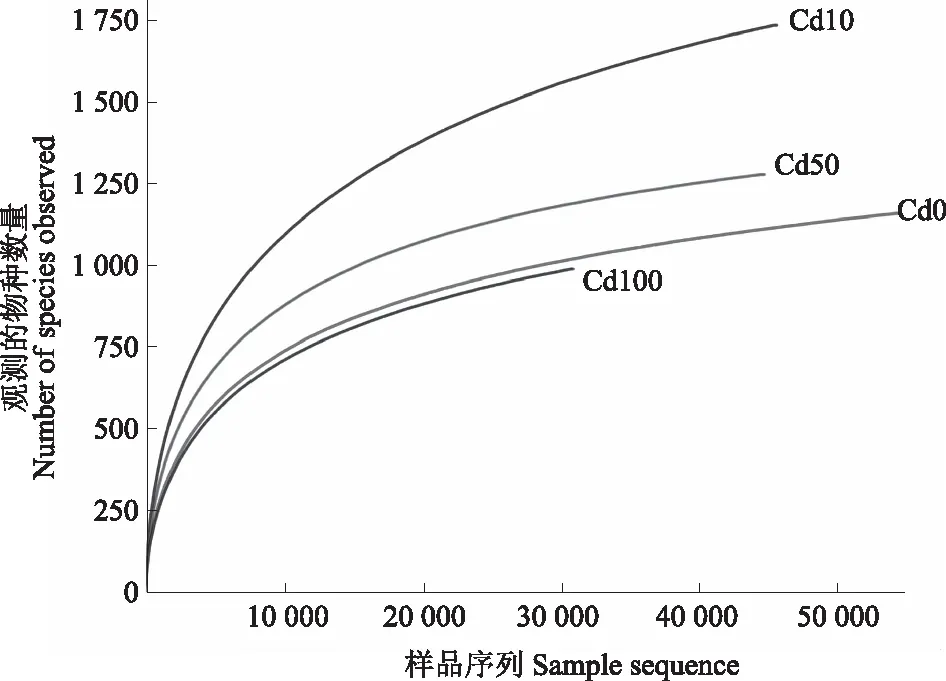
图2 Cd胁迫下马铃薯根际土壤细菌的稀释性曲线Fig.2 Dilution curve of bacteria in potato rhizosphere soil under Cd stress
2.3 Cd胁迫下马铃薯根际土壤细菌的群落组成
由图3可知,在门水平上,将样本中相对丰度占比<0.01的样品归为一类(Others)后发现,Cd胁迫下马铃薯根际土壤细菌群落主要属于11门:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、Saccharibacteria、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、蓝藻门(Cyanobacteria)和Unclassified_k_norank。总体而言,变形菌门丰度最高,占比为37.78%~48.28%,为优势菌门;其次为放线菌门,占比为10.14%~17.16%;已命名菌门中蓝藻门丰度最低,占比为0.19%~2.07%。与对照土壤(Cd0)相比,放线菌门、绿弯菌门和蓝藻门的丰度增加,表明放线菌门、绿弯菌门、蓝藻门对重金属Cd具有耐受性。
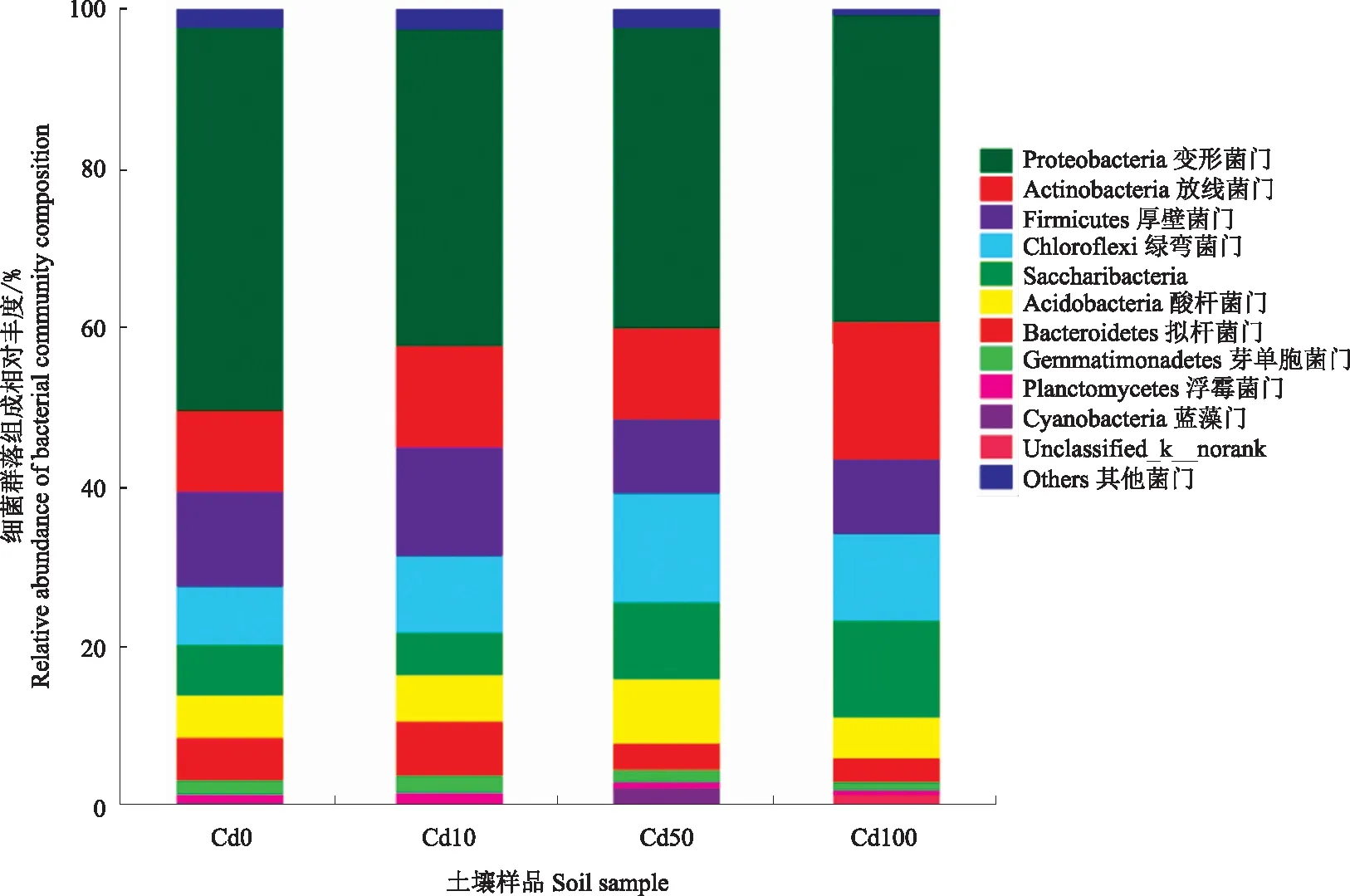
图3 Cd胁迫下马铃薯根际土壤细菌的群落组成Fig.3 Bacterial community composition of potato rhizosphere soil under Cd stress
在属水平上(细菌群落的相对丰度用对数表示),对4个处理的土壤细菌丰度分布特征进行聚类(图4),Cd100与Cd50处理土壤细菌类群相似度最高,其与Cd10 处理聚为一类;Cd0与上述3个处理聚成的一大类为同一水平。在属水平上获得了前50个优势菌属,其中,丰度>1%的有水恒杆菌属(Mizugakiibacter)、类芽孢杆菌属(Paenibacillus)、Norank_p__Saccharibacteria、产黄杆菌属(Rhodanobacter)等24个菌属。其中,水恒杆菌属占比为9.16%~20.44%,Norank_p__Saccharibacteria占比为5.36%~12.11%,产黄杆菌属占比为3.67%~5.26%,显著富集在各个处理中。此外,在Cd胁迫后,部分具有优势的菌属消失,出现了新的菌属。Norank_c__TK10和Norank_f__DA111仅出现在对照组中。另外一些菌属仅在某一Cd处理中出现,如德沃西亚菌属(Devosia)、Paenibacillus仅存在于Cd10处理中。以上结果表明,土壤受Cd胁迫后,其细菌群落发生了明显变化。
与Cd0相比,随着Cd含量增加,根微菌属(Rhizomicrobium)、腐土杆菌属(Humibacter)、产黄杆菌属的丰度分别降低了83.51%、54.33%、56.59%,说明Cd污染胁迫对这些细菌类群的生长具有抑制作用。另外,随着Cd含量增加,马铃薯根际土壤细菌菌属中的苔藓杆菌属、Norank_o_Gaiellales、Flexivirga的丰度分别依次增加了37.32%、46.35%、66.67%,说明这3个菌属对Cd具有耐受性。

图4 Cd胁迫下土壤前20种优势菌属细菌在属水平上的群落结构热谱图Fig.4 Thermogram of community structure of the top 20 dominant bacterial genera at genus level under Cd stress
2.4 Cd胁迫下马铃薯根际土壤细菌群落结构的变化
以马铃薯根际细菌群落结构为研究对象,利用主成分分析(PCoA)研究了镉胁迫下马铃薯根际细菌群落结构的变化。如图5所示,第1主坐标轴的贡献值为53.51%,第2主坐标轴的贡献率为14.44%。种类聚类分析表明,Cd100和 Cd50处理土壤细菌群落结构最相似,但对照组(Cd0)土壤细菌群落结构与其他3个处理相比差异较大,表明Cd 胁迫对马铃薯根际土壤细菌群落结构有明显影响。

图5 Cd胁迫下土壤细菌群落PCoA分析Fig.5 PCoA analysis of soil bacterial community under Cd stress
2.5 马铃薯根际土壤细菌群落相对丰度与Cd胁迫的相关性
选择马铃薯根际土壤细菌前50个优势菌属的相对丰度与Cd含量进行相关性分析,结果见表2。绝大部分细菌属与Cd含量间无显著关系,仅有5种菌属(苔藓杆菌属、Flexivirga、Jatrophihabitans、德沃西亚菌属和Norank_f__Planctomycetaceae)与Cd含量具有显著相关关系,其中,苔藓杆菌属和Flexivirga相对丰度与Cd含量呈显著正相关(P<0.05),Jatrophihabitans相对丰度与Cd含量呈极显著正相关(P<0.01),表明该3个细菌属对Cd胁迫具有耐受性。而德沃西亚菌属和Norank_f__Planctomycetaceae

表2 Cd含量与马铃薯根际土壤优势菌属间的相关性Tab.2 The correlation between Cd concentration and dominant bacteria in potato rhizosphere soil
注:*代表显著相关(P<0.05),**代表极显著相关(P<0.01),下同。
Note:*represents significant correlation (P<0.05),**represents extremely significant correlation (P<0.01),the same below.
与Cd含量间呈负显著相关,表明这2个菌属对Cd不具有耐受性。
利用相关性热谱图分析了细菌门相对丰度与土壤环境因子之间的相关性。热谱图(图6)显示,不同细菌门相对丰度与环境因子的相关性存在差异。其中,厚壁菌门的相对丰度与有机质含量呈显著正相关;拟杆菌门的相对丰度与有机质含量呈极显著正相关;糖细菌门(Saccharibacteria)的相对丰度与有机质含量呈显著负相关;变形菌门(Proteobacteria)的相对丰度与有机质含量呈极显著正相关,但与速效钾含量呈显著负相关;栖热菌门(Deinococcus-Thermus)的相对丰度与有机质含量和全氮含量均呈极显著正相关;假单胞菌门(Gemmatimonadetes)的相对丰度与有机质含量呈显著正相关,但与速效钾含量呈极显著负相关;TM6_Dependentiae的相对丰度与有机质和全氮含量均呈显著正相关;螺旋菌门(Spirochaetae)的相对丰度与全氮含量、含水率和碱解氮含量均呈显著正相关;拟杆菌门(Bacteroidetes)、衣原体门(Chlamydiae)、Parcubacteria的相对丰度均与速效钾含量呈显著负相关。

AN:碱解氮;AK:速效钾;TK全钾;TP:全磷;AP:速效磷;M:含水率;TN:全氮;OM:有机质AN:Available N;AK:Available K;TK:Total K;TP:Total P;AP:Available P;M:Moisture content;TN:Total N;OM:Organic matter图6 细菌与土壤环境因子相关性热谱图Fig.6 Thermogram of correlation between bacteria and soil environmental factors
3 结论与讨论
长期以来,重金属污染对土壤生物化学及微生物学特性的影响,尤其是对土壤微生物群落组成及多样性影响方面[37]一直备受关注。本研究表明,Cd胁迫对马铃薯根际土壤细菌群落多样性具有重要影响,表现为在低Cd含量(10 mg/kg)胁迫下,马铃薯根际土壤中细菌群落的Simpson指数最低,Shannon指数最高,而高含量(100 mg/kg)Cd胁迫下,根际土壤中细菌群落的Simpson指数最高,Shannon指数最低,表明在低Cd含量胁迫下马铃薯根际土壤中细菌群落多样性最高,而在高Cd含量胁迫下,根际土壤中细菌群落多样性受到抑制,其原因可能是随着土壤Cd含量增加,耐受性低的细菌数量会降低或者绝灭,而耐受性强的细菌数量呈升高或积累的态势,进而使土壤细菌的群落结构及多样性发生明显改变。JOSE等[38]研究表明,重金属浓度与土壤细菌的数量和群落多样性密切相关,高浓度重金属污染会显著降低细菌群落多样性,且土壤细菌的数量和群落多样性随着重金属Cd含量增加均呈逐渐降低的变化规律。在本研究中,土壤细菌群落多样性并未呈现随着Cd含量增加而逐渐降低的趋势,而是呈现先增加后降低的趋势,其原因可能是低含量Cd胁迫对马铃薯根际土壤中细菌群落丰度和多样性具有刺激作用,高含量Cd较强的毒性作用则会抑制土壤中微生物的生长,限制了细菌群落对养分的利用率[39],但高Cd含量胁迫下细菌抗逆性增强导致其活动强度增大,细菌群落为了维持正常的生命活动就需要消耗更多的能量维持生理功能,从而将用于生长繁殖的能量用于新陈代谢,使细菌群落的丰度和生物量发生改变,进而降低细菌群落的丰度和多样性。王继玥等[40]的研究表明,重度Pb污染会显著降低三叶草根际土壤细菌微生物量及其群落多样性,而中度 Pb 污染却增加了三叶草根际土壤细菌群落多样性,这与本研究中Cd污染的规律一致。
土壤污染不仅明显改变土壤微生物群落多样性,也明显地影响土壤微生物群落组成[41]。本研究结果表明,在Cd污染的马铃薯根际土壤中变形菌门、放线菌门、厚壁菌门、Saccharibacteria和酸杆菌门的相对丰度较高,是Cd污染土壤中的主要类群,这与前人的研究结果相似[42]。其中,变形菌门在受Cd污染的马铃薯根际土壤中的相对丰度最高,说明变形菌门对重金属污染具有较强的耐受性,这与FRAZAR等[43]和GILLAN等[44]的研究结果相似。本研究中,热谱图显示变形菌门相对丰度与土壤有机质含量呈极显著正相关,说明在Cd污染土壤中变形菌门的抗性与有机质的含量密切相关。在本研究中,受Cd污染胁迫的马铃薯根际土壤中放线菌门、绿弯菌门和蓝藻门的相对丰度均高于对照土壤的相对丰度,说明这3个菌门对Cd具有较强的耐受性。其中,EI-ENANY等[45]的研究表明,蓝藻门具有通过细胞壁吸附高浓度溶解态重金属的能力,且其表面具有吸附重金属的小球体和可以隔离重金属蛋白质的机制。放线菌门自身对Cd污染具有一定的耐性。TAJ等[46]的研究表明,在植物生长过程中,放线菌在对重金属解毒和减轻生物及非生物胁迫方面具有重要作用,可凭其较强的抗性取代更为敏感的真菌作为土壤的主要分解者。前人研究表明,绿弯菌门中的许多物种是生长缓慢且功能多样的兼性需氧异养生物,具有较高的代谢可塑性,是土壤中的耐重金属微生物[47-49]。
在本研究中,随着Cd含量的增加,马铃薯根际土壤中根微菌属、腐土杆菌属、产黄杆菌属的相对丰度降低,说明高Cd含量胁迫会抑制这些敏感的细菌属生长。另外,不同含量Cd胁迫下马铃薯根际土壤中一些细菌属的相对丰度存在明显差异,如10 mg/kg Cd胁迫下马铃薯根际土壤中的细菌属如Norank_O_JG30-KF-CM45和Norank-f-Gemmatimonadaceae的相对丰度最高,均高于100 mg/kg胁迫土壤的相对丰度;而10 mg/kg Cd胁迫下马铃薯根际土壤中的细菌属如水恒杆菌属和产黄杆菌属的相对丰度均低于对照土壤。上述结果表明,不同种类的细菌属对Cd污染胁迫的敏感程度不同,一定程度的Cd污染胁迫会抑制一些种类细菌属的生长,但同时在一定程度上促进另一些种类细菌属的生长。随着Cd含量增加,属于酸杆菌门的苔藓杆菌属、Norank_o_Gaiellales、Flexivirga的丰度增加,说明这3种菌群是对Cd具有耐性的优势菌群。其原因可能有两方面,一是Cd胁迫会促使某些在未受Cd胁迫的土壤中不占优势的微生物种类成为优势种群,而这些微生物可能具有某些能够耐受重金属胁迫的特殊功能[50];二是一定含量的Cd胁迫改变了原有细菌群落内部种群之间的竞争关系,导致原始种群失去了优势,而耐Cd微生物的相对丰度增加,并且某些微生物在耐受Cd的过程中产生的物质保护了其他种群的微生物,从而使Cd胁迫土壤的优势种群发生了明显改变[51]。本研究表明,芽孢杆菌属(Bacillus)在Cd胁迫的土壤中的相对丰度高于对照土壤,这是因为芽孢杆菌属具有抗逆性,是重金属抗性菌株[52-53]。同时,本研究利用主成分分析表明,马铃薯根际土壤受Cd胁迫后,其群落结构与对照具有明显差异;由优势菌属与Cd含量相关性分析可知,苔藓杆菌属、Flexivirga和Jatrophihabitans与Cd含量呈显著的正相关关系,表明这3个细菌属对Cd胁迫具有耐受性。细菌种群与理化因子相关性分析发现,有机质和全氮对细菌种群的影响最大。
综上所述,不同含量Cd胁迫下,马铃薯根际土壤中细菌群落组成和多样性具有显著变化,而细菌群落组成和多样性的变化对马铃薯抗Cd的响应程度有待进一步研究。
