小麦幼苗根系应答重金属Pb胁迫的转录组分析
2020-06-19王怡仁聂梦杰王玉泉胡喜贵丁位华胡铁柱
王怡仁,聂梦杰,王玉泉,胡喜贵,丁位华,胡铁柱
(河南科技学院 小麦中心/河南省杂交小麦重点实验室,河南 新乡 453003)
近年来,随着我国农业的快速发展,出现了大量污水灌溉及农药、除草剂、化肥过度使用等情况,导致土壤中的重金属含量明显增加[1]。积累在土壤中的重金属经植物吸收和转运后进入食物链,被动物和人类食用并在其体内积累,最终对植物、动物和人产生极强的毒害作用[2]。重金属是目前主要的环境污染源,同时也是制约植物生长和影响农产品安全的重要因素[3-5]。
铅(Pb)是一种常见的重金属,是毒性很强的植物生长非必需元素[6],可抑制植物的生长和发育[7]。研究表明,Pb胁迫可危害植物根系,造成根系生理代谢失调,吸收能力减弱,导致营养亏缺,进而影响植株地上部生长和生物量积累[8];Pb会干扰植物对矿质营养元素的吸收,还会对植物的光合作用造成严重的影响[9-11];当Pb在植物根、茎或叶中不断积累后会影响植物的生长发育[12-13]。此外,Pb会通过食物链进入人体,极易在人体内积累,对人体神经、肾脏、心血管等造成危害[14],同时还会通过呼吸道进入肺部或通过皮肤接触侵入体内,进而对人体的造血系统造成危害,引起贫血和神经系统末梢神经炎等[15]。Pb还可以随血液流入脑组织,损害小脑和大脑皮质细胞,干扰新陈代谢,引起脑损伤[16]。Pb污染是一个重要的生态问题,受Pb污染的土壤在世界范围内急剧增加,其对人体健康的危害逐渐引起全世界的关注[17]。
小麦(Triticumaestivum)是我国重要的粮食作物。关于重金属Pb对小麦的影响研究主要集中于小麦生理生化及农艺性状方面[18-19]。对小麦根系的研究发现,重金属Pb能干扰根细胞分裂,抑制根系生长发育,使根系生物量和体积下降,最终对根系的生理生化特性产生影响[20]。根系作为植物生长发育的基础,也是植物最早遭受重金属胁迫的组织,了解根系对逆境胁迫的反应,是系统认识逆境伤害机制的较好途径。从转录组层面深入研究小麦根系对Pb的吸收、转运以及积累,对于保证人类健康有重要意义[21]。目前,从转录组水平分析小麦根系对Pb胁迫的应答研究尚未见报道。为此,采用水培法对不同质量浓度Pb胁迫下的小麦幼苗根系进行扫描和Illumina Hiseq高通量测序,探讨小麦幼苗根系对重金属Pb胁迫的响应情况,为深入研究重金属Pb胁迫对小麦生长发育的影响机制提供理论基础。
1 材料和方法
1.1 供试材料及Pb胁迫处理
供试小麦品种为矮抗58。首先,在超净工作台中选取大小一致、颗粒饱满的小麦种子放入无菌三角瓶中,用1.0 g/L的HgCl2浸泡消毒10 min。随后用去离子水洗干净,放置于发芽机中发芽。3 d后,选取长势一致的幼苗分别移栽至含有40 mg/L(R1)、80 mg/L(R2)和160 mg/L(R3)Pb(NO3)2的Hoagland营养液中,以未添加Pb(NO3)2的Hoagland营养液为对照(CK)。15 d后,各处理选取长势一致的小麦进行根系扫描,经液氮速冻放入-80 ℃冰箱中保存,用于后续转录组测序。
1.2 试验方法
1.2.1 小麦根长、根数测定 使用根系扫描仪对小麦幼苗根系进行扫描,统计得出根长及根数。
1.2.2 小麦幼苗根系转录组测序 小麦幼苗根系总RNA由柏豪生物技术有限公司采取Trizol法抽提并完成测序文库的构建,利用Illumina Hiseq 2500平台进行测序,在测序过程中对测序数据采用边测序边分析的方法进行实时分析。
1.2.3 序列比对与差异表达基因筛选 应用Hisat2[22]将测序数据与参考基因组序列(ftp://ftp.ensemblgenomes.org/pub/release-41/plants/fasta/triticum_aestivum/dna/Triticum_aestivum.IWGSC.dna.toplevel.fa.gz)进行比对。采用edgeR[23]分析样本间的差异表达基因,得出P值后进行多重假设验证,并通过控制FDR(False discovery rate)决定P值的阈值[24-25]。同时,基于FPKM值计算基因差异表达倍数,即Fold-change,进行差异表达基因的筛选,筛选条件:P≤0.05、|log2(Fold-change)|≥2。
1.2.4 差异表达基因的功能注释与富集分析 分别利用GOseq和KOBAS[26]对筛选得到的差异表达基因进行GO(Gene ontology)分类与KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析。
1.2.5 实时荧光定量PCR(RT-PCR)分析 为了检验RNA-Seq的可靠性,选取80 mg/L Pb胁迫处理与CK中差异表达的6个基因,采用RT-PCR分析其表达量。差异表达基因的引物采用Primer Express 3.0.1软件设计,引物序列见表1。内参基因为β-actin,引物为β-actin-F(5′-TCTCGGTTCAGCTTTTCCTT-3′)和β-actin-R(5′- TTCATACAGCAGGCAAGCAC-3′)。RT-PCR扩增程序如下:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,40个循环。用2-ΔΔCt法计算基因的表达量,每个样品3次重复。

表1 采用的RT-PCR引物序列Tab.1 RT-PCR primer sequences used in study
1.3 数据处理
试验数据利用Excel 2010进行处理和作图,利用 SPSS 19.0软件进行方差分析。
2 结果与分析
2.1 不同质量浓度Pb处理对小麦幼苗根系的影响
由图1和表2可知,不同质量浓度Pb对小麦幼苗根长及根数都有影响。在CK下,小麦幼苗根长及根数分别为26.27 cm和5.7个,随着Pb质量浓度逐渐升高,根长与根数受到的抑制作用越来越明显。其中,R1处理的小麦幼苗根长、根数受到显著抑制,根长和根数分别为23.26 cm和5.5个;R2处理下的根长、根数均受到更显著抑制,根长和根数分别为21.16 cm和5.2个;R3处理下,根长和根数分别为17.38 cm和4.8个,均受到极显著抑制。

图1 不同质量浓度Pb处理下小麦幼苗根系的扫描情况Fig.1 Wheat seedling root scan under different concentrations of Pb
2.2 小麦幼苗根系转录组测序分析
将CK与Pb胁迫处理小麦幼苗根系样品进行高通量测序。各样品测序后的高质量数据均达到12 Gb,测序质量质控值(Q20)均大于95.0%,说明测序结果质量良好,将获得的转录组数据与参考基因序列进行比对,如表3所示。每个测序样品与参考基因组唯一位置上的比对效率均在86.93%以上,比对效果良好。

表2 不同质量浓度Pb处理对小麦幼苗根长及根数的影响Tab.2 Effects of different concentrations of Pb on root length and root number of wheat seedlings
注:*、**分别表示Pb处理与CK间差异显著(P<0.05)、极显著(P<0.01)。
Note:*,** indicate significant differences between Pb treatment and CK at 0.05,0.01 levels,respectively.

表3 小麦幼苗根系转录组数据比对质量分析Tab.3 Mapped quality of transcriptome data in wheat seedling root
2.3 小麦幼苗根系中差异表达基因的筛选
对不同质量浓度Pb处理与CK间的小麦幼苗根系差异表达基因进行分析,一共获得了38 904个差异表达基因,40、80、160 mg/L Pb处理条件下的差异表达基因分别为6 072、16 581、16 251个。在所有Pb处理中下调表达基因居多。其中,在40 mg/L Pb处理条件下有3 218(53%)个基因表达下调、2 854(47%)个基因表达上调;80 mg/L Pb处理条件下有10 769(65%)个基因表达下调、5 812(35%)个基因表达上调;160 mg/L Pb处理条件下有10 661(65%)个基因表达下调、5 590(35%)个基因表达上调。在80 mg/L Pb处理条件下呈现的差异表达基因数量最多且表型趋于临界状态,所以选取该质量浓度下的差异表达基因作为本研究的重点。
2.4 小麦幼苗根系中差异表达基因的GO分类
对CK与80 mg/L Pb处理之间获得的小麦幼苗根系差异表达基因进行GO分类。由图2可知,上调表达基因主要富集在生物学过程中的免疫系统过程、运动过程、代谢过程和节律性过程等4个亚类;在细胞组分方面,主要富集在细胞器和细胞核2个亚类;此外,在分子功能方面,显著富集在催化活性和电子载体活性2个亚类。
小麦幼苗根系中下调表达基因的GO分类与上调表达基因不同。如图3所示,在生物学过程中,下调表达基因主要富集在发育过程、生长过程、定位过程、复制过程和生殖过程等5个亚类;在细胞组分方面,主要富集在细胞连接、胞外区域、膜和共质体等4个亚类;在分子功能方面,主要富集在抗氧化活性、信号传感活性、结构分子活性和转运活性等4个亚类。

图2 80 mg/L Pb处理小麦幼苗根系中上调表达基因的GO分类Fig.2 Classification of up-regulated genes of 80 mg/L Pb treatment in wheat seedling root compared with CK

图3 80 mg/L Pb处理小麦幼苗根系中下调表达基因的GO分类Fig.3 Classification of down-regulated genes of 80 mg/L Pb treatment in wheat seedling root compared with CK
2.5 小麦幼苗根系中差异表达基因的KEGG富集分析
通过KEGG对80 mg/L Pb处理与CK间的差异表达基因主要富集的代谢通路进行分析,如图4所示。上调表达基因主要富集在植物激素信号转导途径,其次是植物-病原互作途径、药物代谢途径、MAPK信号通路等;下调表达基因主要富集在次生代谢物的生物合成途径,其次是苯丙烷类生物合成途径、抗生素生物合成途径、碳代谢和蔗糖代谢等。由此可知,在Pb胁迫下植物通过信号转导激活MAPK信号通路,同时植物体内的碳代谢以及蔗糖代谢均有明显变化。
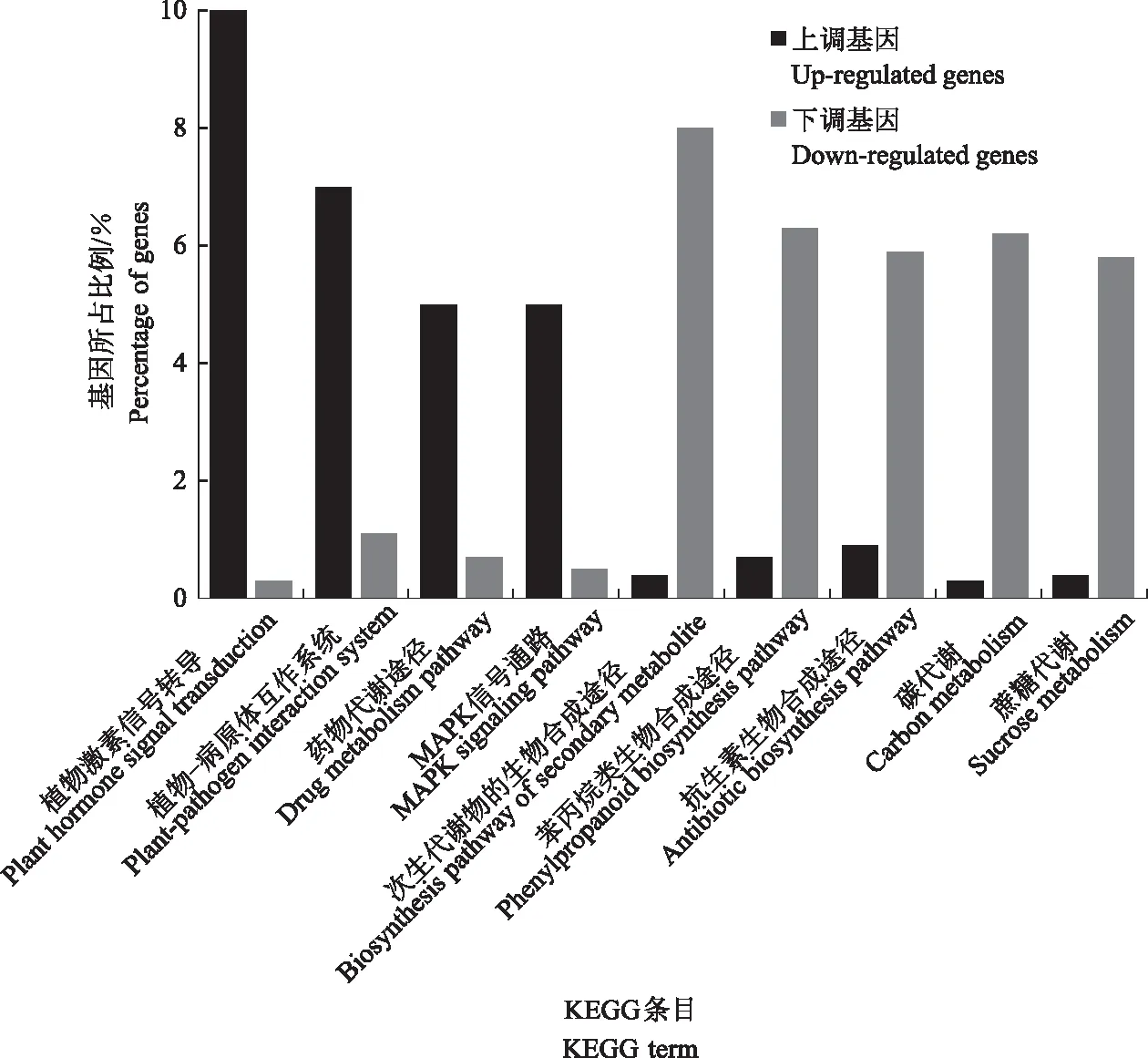
图4 80 mg/L Pb处理小麦幼苗根系差异表达基因的KEGG富集分析Fig.4 KEGG enrichment analysis of differentially expressed genes of 80 mg/L Pb treatment in wheat seedling root compared with CK
通过上述GO分类和KEGG的富集分析发现,在上调基因中筛选出了2个差异最显著的基因PETF(TraesCS7B02G226100)和PR4B(TraesCS3D02G524700),它们分别富集在发育过程和免疫系统过程;在下调基因中筛选出共同富集在代谢途径、次生代谢物的生物合成和苯丙烷类生物合成等途径的基因GLU1B(TraesCS2B02G599800)、GLU1C(TraesCS2D02G594400)、GLU1D(TraesCSU02G036600)和OMT1(TraesCS7B02G245500),用于RT-PCR分析。
2.6 小麦幼苗根系中差异表达基因RT-PCR结果分析
对上述6个响应Pb胁迫的基因进行RT-PCR验证,如图5所示,6个差异表达基因的RT-PCR结果与RNA-Seq的分析结果一致,证实了RNA-Seq分析结果的可靠性。

图5 差异表达基因的RT-PCR验证Fig.5 Validation of differentially expressed genes using RT-PCR
3 结论与讨论
在过去的10 a内,耕作土壤中重金属含量大大增加[27],包括小麦在内的大多数农作物在污染的环境中均遭受重金属的毒害[28]。前人关于重金属对作物种子萌发和幼苗生长的影响研究认为,较低重金属浓度对作物种子萌发和幼苗生长有促进作用,高浓度具有抑制效应[29]。本研究通过对小麦幼苗根系扫描对比发现Pb对根长和生根数产生影响,且随着Pb质量浓度的升高抑制作用越来越明显。Pb毒害引起植物的中毒症状主要为根量减少,根冠膨大变黑、腐烂,植物地上部分生物量下降,叶片失绿明显,严重时逐渐枯萎,植株死亡[30]。
本研究对Pb处理与CK的根系进行Illumina Hiseq高通量测序,共获得38 904个差异表达基因。其中,在40、80、160 mg/L Pb处理中分别有6 072、16 581、16 251个差异表达基因,且在所有处理中均以下调基因居多。随着Pb质量浓度升高,差异表达基因数量呈现先增加后减少的趋势,说明绝大多数基因的表达水平对Pb处理的质量浓度比较敏感,大多数基因只在特定的质量浓度下表达水平才出现差异。GO功能分类发现,80 mg/L Pb处理与CK间的差异表达基因主要富集在免疫系统过程、运动过程、代谢过程、节律性过程、发育过程、生长过程、定位过程、复制过程和生殖过程等,与之前苜蓿芽孢杆菌受到Cd胁迫的转录组分析结果一致[31]。另外,还富集在细胞组分中的细胞器、细胞核、细胞连接、胞外区域、膜和共质体等;在分子功能方面,主要富集在催化活性、电子载体活性、抗氧化活性、信号传感活性、结构分子活性和转运活性,这可能是植物受到重金属Pb胁迫时的一种应激反应。
在80 mg/L Pb处理中挖掘到了6个应答重金属Pb胁迫的候选基因。PETF作为上调基因富集在发育过程中,另一个上调基因PR4B富集在免疫系统过程中。众所周知,光合作用是植物生长发育的重要能量来源和物质基础,当小麦受到重金属胁迫时,通过提高PETF和PR4B的表达量缓解毒害。另外,还发现了GLU1B、GLU1C、GLU1D和OMT1等基因在Pb处理中呈现下调表达。它们在代谢途径、次生代谢物的生物合成和苯丙烷类生物合成等途径显著富集。本研究中,GLU1B、GLU1C、GLU1D编码葡萄糖苷酶GLU1,葡萄糖苷酶是糖苷水解酶家族中的一大类酶,是生物体代谢途径中不可或缺的一类酶。OMT1是与黄酮代谢相关的基因。由此可见,Pb胁迫会降低小麦幼苗根系GLU1基因、黄酮代谢相关基因的表达量来影响植物的生长发育。
