HPV16 E786-93纳米颗粒疫苗的免疫杀伤效果研究
2020-06-18胡张可邓雄威赵佳琦韩卢石思伟董晓筱肖向茜盛望
胡张可,邓雄威,赵佳琦,韩卢,石思伟,董晓筱,肖向茜,盛望
1.北京工业大学 生命科学与生物工程学院,北京 100124;2.国家纳米科学中心,北京 100190
宫颈癌是全球第三大常见的癌症[1-2]。由人乳头瘤病毒(human papillomavirus,HPV)引起。在所有子宫颈癌病例中,超过80%发生在发展中国家[3]。我国癌症数据统计显示,2014年全国宫颈癌新发病例10.2万,死亡3.0万例[4]。虽然预防性HPV疫苗在全球范围内得到推广并获得一定成效,但对于已感染人群没有保护效果,传统手术和放化疗只能去除病变组织,不能清除病毒,存在一定的复发风险,且暂无治疗性HPV疫苗上市[5-6]。在已鉴定出的200多种HPV亚型中,以HPV16型感染与宫颈鳞癌的关系最为密切。HPV阳性细胞可表达2种对诱导和维持细胞转化至关重要的病毒癌蛋白E6和E7,E6和E7在癌前病变和晚期病变中均有组成性表达,使其成为HPV诱导的恶性肿瘤免疫治疗的理想靶标。HPV癌蛋白E6和E7已广泛用于早期治疗性HPV疫苗研究中,通过激活细胞免疫应答达到清除受病毒感染细胞的目的。目前治疗性HPV疫苗多以E7作为靶抗原,这是因为其表达量及保守性较高[7]。E7蛋白可以与Rb蛋白结合使后者磷酸化而与E2F解离,失去对E2F转录的抑制作用,从而导致细胞分裂增殖失调,转化为永生化细胞[8]。目前,已有一些以HPV16 E6、E7为靶抗原的小鼠或人的T 细胞表位被鉴定出来,如 E711-20、E749-57、E786-93等CTL 表位[9-10],E735-50、E743-77、E750-62、E748-54等 Th 表位,以及兼有CTL表位和Th表位的E643-57[11-12]。
近年来,纳米技术的出现,为肿瘤疫苗不能引起机体产生较强烈的特异性免疫反应、生物利用度不高等问题提供了新的解决思路。利用纳米技术制备抗肿瘤疫苗成为有效激发体内特异性免疫反应的新方法。Tang等构建了HIV-1 Tat49-57/HPV16 E749-57融合肽和粒细胞巨噬细胞集落刺激因子(GM-CSF)DNA的自组装纳米疫苗,在小鼠中引起强效且持续的CTL依赖性抗肿瘤免疫[13]。Rad-Malekshah等[14]通过将自组装肽片段Ac-AAVVLLLW-COOH添加到HPV E743-57N端形成融合肽纳米颗粒,并与免疫佐剂CpG-ODN联用,以增强肽抗原HPV E743-57的免疫原性,结果表明纳米颗粒疫苗能够有效诱导强烈的CTL细胞毒性反应,并显著抑制荷瘤小鼠的肿瘤生长,延长了生存期。此类研究表明,纳米颗粒中的抗原肽能够诱导比其在非纳米形式下更强的免疫反应,使两者能够作用于同一抗原递呈细胞,更好地发挥协同作用,实现肿瘤疫苗和免疫增强剂的共传递。同时,也可保护抗原不被机体快速降解和清除,有效延长抗原在体内的作用时间,提高抗原的摄取和递呈效率,增强疫苗的免疫效应。CpG-ODN被认为是一种理想的免疫佐剂,可诱导机体产生肿瘤特异性或病毒特异性免疫反应,激活B细胞和浆细胞样树突状细胞,诱导细胞因子的产生和抗原呈递细胞的成熟[15-16]。但其在体内易被酶类降解,稳定性有待提高。随着纳米技术研究的逐渐深入,为小核酸药物的体内递送提供了新的思路。
在本研究中,我们采用HPV16 E7蛋白CTL表位中与MHC-Ⅰ分子亲和力高又具有较强抗原性的优势表位E786-93,将序列为TLGIVCPI的抗原表位肽连接在在富含正电荷的多聚赖氨酸(Poly K10)末端,通过静电引力与带负电荷的CpGODN自组装成纳米颗粒疫苗,探讨其抗肿瘤和体外刺激树突状细胞(DC)分泌细胞因子的作用。
1 材料与方法
1.1 材料
6~8周龄雌性C57BL/6N小鼠购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于PONY测试集团SPF级动物房[SYXK(京)2018-0022];TC-1细胞(转染ras基因和HPV16E6、E7基因的C57BL/6小鼠肺上皮细胞)由本实验室保存;CpG1826由生工生物工程(上海)股份有限公司合成;添加亲水序列的HPV16 E786-93表位肽(序列:KKKKKKKKKKTLGI VCPI,纯度≥95%)由南京源肽生物科技有限公司合成;GM-CSF、IL-4购自Peprotech公司;小鼠IL-6、IL-12p40 ELISA 试剂盒,鼠 CD3-FITC、CD4-APC、CD8-PE单克隆抗体均购自BioLegend公司;胎牛血清(FBS)、PBS(pH7.4)、RPMI-1640培养基购自Gibco公司;青霉素-链霉素、DNA酶购自索莱宝公司;胶原酶Ⅴ购自Sigma Aldrich公司;小鼠淋巴细胞分离液购自北京达科为生物技术有限公司。
1.2 纳米颗粒的制备
用去离子水制备400 μg/mL的CpG-ODN溶液和1 mg/mL的HPV16 E786-93溶液,将CpG-ODN溶液逐滴滴加到等体积的HPV16 E786-93溶液中并不断搅拌,室温孵育30 min后于4℃、15 000 r/min离心30 min分离纳米颗粒,弃上清液,用去离子水复溶沉淀,即得到CpG/E786-93纳米颗粒。
1.3 CpG包载效率测定
采用荧光强度-浓度法测定纳米颗粒中包载CpG-ODN的含量,本实验使用Cy-3荧光标记的CpG-ODN(Cy-3-CpG)。分别通过Cy-3-CpG的荧光强度和浓度制作相应的标准曲线,计算出纳米颗粒包载后上清液中的CpG-ODN质量,通过与初始投料质量相比,计算包载效率。
1.4 纳米颗粒的表面形态及粒径大小
取纳米颗粒溶液滴于铜网上,以磷钨酸负染色法拍摄透射电镜照片,观察其形态。采用激光粒度仪测定纳米粒子水合粒径、多分散指数(polydispersity,PDI)和表面ζ电位,每项测量3次,取平均值。
1.5 小鼠免疫方案
取对数生长期的小鼠肺上皮细胞TC-1加入RPMI-1640配制成浓度为5×106/mL的细胞悬液,以0.1 mL接种于C57BL/6N小鼠右侧腹皮下,待接种后6 d肿瘤生长至2~3 mm时随机分为PBS组、CpG组、E786-93组、CpG/E786-93组、纳米颗粒疫苗(Nano)组,每组5只。给药方式见表1,共给药3次,每次给药间隔1周,最后一次给药后1周处死小鼠,取肿瘤、外周血及脾脏。每隔2 d用游标卡尺测量肿瘤直径,并记录体重变化,观察实验小鼠抗肿瘤的效应。肿瘤体积=1/2×a×b2,其中a、b分别表示肿瘤的长和宽。

表1 小鼠免疫组给药方案
1.6 细胞表面抗原染色与流式细胞分析
第3次免疫后1周将小鼠麻醉,眼眶取血至EDTA抗凝管中,4000 r/min离心10 min,弃上清,加入1 mL PBS稀释,用滴管将稀释后的血液沿试管壁缓慢加入含有2 mL淋巴细胞分离液的15 mL离心管中,并与分离液形成明显界面,1500 r/min离心15 min,吸出中层呈白絮状的淋巴细胞,PBS润洗2次。
将分离的肿瘤组织切成小块,转移到含有RPMI-1640、胶原酶Ⅴ(41.75 μg/mL)和 DNA 酶(2 μg/mL)的培养皿中,37℃孵育30 min,于细胞筛网中研磨组织并用PBS冲洗,收集细胞悬液,重悬在淋巴细胞分离液中。分离的淋巴细胞在染色前用PBS润洗2次。
取出脾脏,放入预先加入4 mL淋巴细胞分离液的平皿中,将细胞筛网置于平皿上进行组织研磨,收集细胞悬液,缓慢加入1 mL RIPM-1640,水平离心30 min,取淋巴细胞层溶液,PBS润洗2次后进行流式染色。
用CD3-FITC、CD4-APC、CD8-PE荧光抗体进行淋巴细胞染色,BD-FACS流式细胞仪分析。
1.7 体外骨髓来源树突状细胞(BMDC)分离及诱导培养
取小鼠胫骨和股骨,用RPMI-1640冲洗骨髓,收集细胞,37℃静置30 min,收集非贴壁细胞及轻微贴壁细胞,1000 r/min离心5 min,按5×106/mL的浓度铺6孔板,RPMI-1640培养基中加入20 ng/mL GM-CSF和 1 ng/mL IL-4培养 7 d,第3、5 d更换培养基,补充血清及细胞因子,第7 d收集悬浮细胞,在含20 ng/mL GM-CSF、1 ng/mL IL-4的培养基中以1×106/mL的浓度铺板,分别加入 PBS、E786-93(10 μg/mL)、CpG(4 μg/mL)、CpG/E786-93(CpG 4 μg/mL,E786-9310 μg/mL)、Nano(CpG 4 μg/mL,E786-9310 μg/mL),培养 24 h。
1.8 ELISA检测BMDC培养液中IL-6和IL-12p40水平
收集各组BMDC的培养上清液,于-80℃储存。根据标准品浓度和所测得标准品的吸光度值绘制标准曲线,将样品稀释到合适浓度,用ELISA试剂盒分别测定IL-6、IL-12p40的D450nm值,计算各细胞因子的含量,每组设3个复孔。
1.9 统计分析
流式细胞结果用FlowJo软件分析,用SPSS 17.0软件进行统计学分析,用GraphPad Prism 8.0软件绘制图表。组间比较采用方差分析和t检验,所有分析中差异的显著性表示为*P<0.05、**P<0.01、***P<0.001。
2 结果
2.1 纳米颗粒的物理表征
E786-93表位肽的氨基基团带有正电荷,CpGODN带负电荷,借助正负电荷间的相互作用使二者在水溶液中相互作用,制备得到CpG/E786-93纳米颗粒(图1)。通过激光粒度仪测定纳米颗粒的物理性质,可知纳米颗粒的水合粒径为206±5.1 nm(图 2),PDI为 0.123±0.1,表面ζ电位为 15.6±2.2 mV,CpG-ODN的包载效率达到91.5%。
2.2 纳米颗粒疫苗对小鼠TC-1细胞的抑制作用
以C57BL/6N小鼠为模型,皮下成瘤进行体内治疗性实验。图3A显示Nano组小鼠的肿瘤体积显著低于其他各组,该组平均肿瘤大小仅为CpG/E786-93组的39%。图3B为小鼠个体肿瘤生长曲线,Nano组内5只小鼠的肿瘤体积增长个体差异小,其他组内存在很大的个体差异。

图1 CpG/E786-93纳米颗粒的透射电镜照片
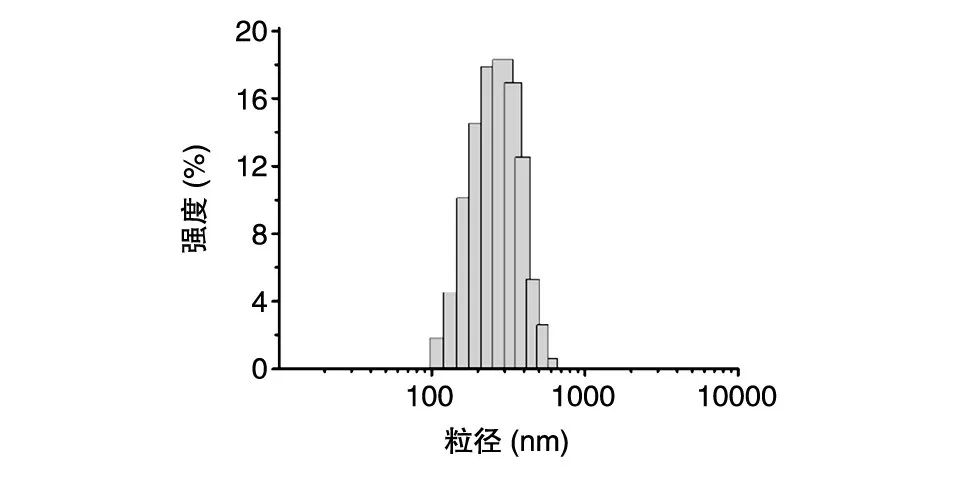
图2 CpG/E786-93纳米颗粒的粒径分布
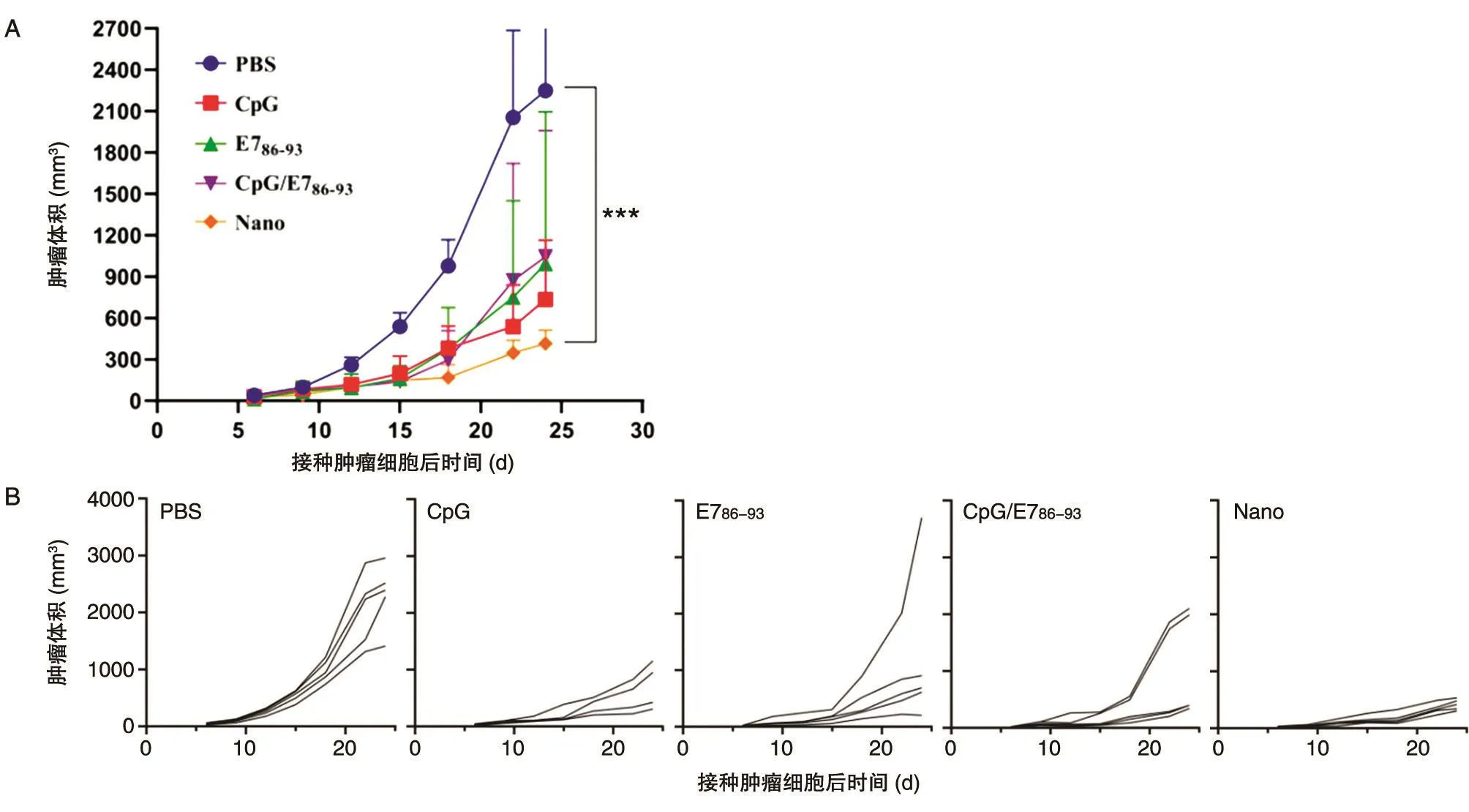
图3 体内肿瘤治疗性效果研究
2.3 小鼠瘤内浸润性T淋巴细胞百分比
处死小鼠后将分离的肿瘤组织切成小块,在细胞筛网中研磨组织,收集的细胞重悬于淋巴细胞分离液中,表面染色后用流式细胞仪分析肿瘤组织内浸润性T淋巴细胞含量。由图4可见,CpG/E786-93组与Nano组相比于对照组都有较为明显的上升。与注射CpG/E786-93相比,Nano组小鼠瘤内浸润性T淋巴细胞比例较高并具有显著性差异(*P<0.05)
2.4 小鼠脾脏内T淋巴细胞百分比
取出小鼠脾脏置于平皿中,加入淋巴细胞分离液进行组织研磨,收集细胞悬液离心,取中间部位的淋巴细胞层溶液进行流式染色。由图5可知,Nano组小鼠脾脏内T淋巴细胞相比于对照组有较为明显的升高。与CpG/E786-93组相比,Nano组小鼠脾脏内T淋巴细胞百分比较高并具有显著性差异(*P<0.05)
2.5 小鼠外周血T淋巴细胞百分比
麻醉小鼠后眼眶取血置于抗凝管中,将稀释后的血液缓慢加入含有淋巴细胞分离液的离心管中,并与分离液形成明显界面,离心后吸出中层呈白絮状的淋巴细胞,进行染色。由图6可知,与对照组相比,CpG/E786-93组与Nano组T淋巴细胞百分比均有明显提升,但是2组之间不具有统计学上的显著性。

图4 小鼠瘤内浸润性CD4+(A)和CD8+(B)T淋巴细胞百分比
2.6 ELISA检测BMDC培养上清中IL-6和IL-12p40浓度

图5 小鼠脾脏内浸润性CD4+(A)和CD8+(B)T淋巴细胞百分比

图6 小鼠外周血CD4+(A)和CD8+(B)T淋巴细胞百分比
取小鼠胫骨和股骨冲洗骨髓,收集非贴壁细胞培养7 d,加入不同刺激物培养24 h,用ELISA试剂盒测定BMDC培养上清中IL-6和IL-12p40的浓度。由图7A可知,与对照组相比,CpG组、CpG/E786-93组及Nano组培养上清中的IL-6浓度均明显上升,其中Nano组与CpG/E786-93组相比具有显著性差异(***P<0.001)。据图7B可以看出,CpG组、CpG/E786-93组及Nano组与对照组刺激后的BMDC培养上清分泌的IL-12p40相比有明显提升,Nano组与CpG/E786-93组相比具有显著性差异(*P<0.05),说明纳米颗粒疫苗对于成熟BMDC分泌促炎性细胞因子IL-6、IL-12p40具有明显的刺激作用。
3 讨论
肿瘤肽疫苗能够直接刺激机体产生特异性免疫应答,且不会引起自身免疫反应或免疫抑制,应用前景广阔。与传统疫苗相比,肿瘤表位肽疫苗具有更高的临床安全性,设计简单,易于大量合成制备,可与佐剂联用,诱导较强的CD8+T细胞反应,弥补单独使用肽疫苗的不足[17]。在针对早期宫颈癌的Ⅱ期临床试验中,以E711-22及E786-93短肽结合通用Th表位PADRE的疫苗对12个病人中的4位诱导产生了肽特异性的免疫应答,表明基于CTL表位的肽疫苗对于治疗HPV16引起的早期宫颈疾病是有效的[18]。近年来随着纳米技术的发展以及新型纳米材料的开发应用,多肽免疫治疗与纳米技术相结合的纳米疫苗策略显现出不可替代的优势,纳米颗粒可以对包裹其中的抗原起到有效保护作用,可防止其在体内新陈代谢过程中过早分解,延长抗原在体内的滞留时间,利于提高免疫效应,且纳米疫苗粒径较小,具有淋巴靶向性。

图7 BMDC经体外刺激后IL-6(A)和IL-12p40(B)的表达分析
我们以HPV16 E7限制性CTL表位E786-93为模式表位,与免疫佐剂CpG-ODN通过静电引力作用自组装成纳米颗粒疫苗,通过直接注射经过筛选的CTL抗原表位肽,使抗原肽能够被DC摄取并呈递给相应的MHC-Ⅰ类分子,诱导CD8+T淋巴细胞增殖、活化。流式检测脾脏、瘤内浸润性T淋巴细胞结果显示,纳米颗粒疫苗相对非纳米组有显著性升高,而在血液中两者差异虽不具有显著性,但相比对照组均明显上升;CpG作为佐剂,可通过与B淋巴细胞、DC等细胞表面的模式识别受体结合,激活下游MAPK和NF-κB等信号通路,促使细胞分泌各种细胞因子。ELISA检测体外培养DC上清显示,Nano组可显著增加促炎性细胞因子IL-6、IL-12的分泌,诱导并增强炎症反应,IL-6可以促进B淋巴细胞分化和分泌抗体,增强NK细胞对靶细胞的杀伤,从而间接增强T淋巴细胞的抗肿瘤能力,而IL-12可以促进T淋巴细胞分泌IFN-γ,诱导Th0向Th1细胞的分化。在肿瘤抑制方面,虽然纳米颗粒疫苗组平均肿瘤体积与CpG/E786-93组相比不具有显著性差异,但个体生长曲线显示纳米颗粒疫苗组对小鼠肿瘤体积抑制效果比较稳定,组内小鼠的肿瘤体积较为平均,而非纳米化直接给药的生物利用率有高有低,可能是因为未经修饰的CpG-ODN易被血清中的DNA酶降解,而纳米颗粒通过对CpGODN的包载,使其能在体内环境中保持稳定,以及单独注射E786-93表位肽不能有效被抗原提呈细胞提呈等原因。
综上所述,纳米颗粒疫苗可以有效且稳定地抑制荷瘤小鼠的肿瘤生长,改善肿瘤微环境,且与CpG/E786-93组相比生物利用率更高,无药物注射后的副反应。由于传统的免疫佐剂具有一定的毒副作用,以纳米为基础的疫苗在安全性上要优于传统的免疫佐剂辅佐免疫的方法。后续将着力于探究纳米颗粒疫苗的免疫效果与肽段及佐剂的选择、疫苗的剂量及免疫方法等因素的关系,以及能否通过联合体液、细胞免疫双途径等方式来提高肿瘤抑制效果,为基于纳米技术的免疫治疗方法提供新思路。
