补阳还五汤减轻脑梗死小鼠神经损伤的作用机制*
2020-06-18刘德浪燕垚旬刘卫花顾勇
刘德浪,燕垚旬,刘卫花,顾勇,2
(1.海南省中医院脑病科,海口 570203;2.南方医科大学南方医院神经内科,广州 510515)
脑血管病已经成为中国第一大致死和致残的疾病,目前临床上治疗方法有限,美国食品药品管理局(FDA)仅将组织纤溶酶原激活物(一种用于溶栓的重组蛋白)作为唯一药物用于治疗缺血性脑卒中[1]。近两年来,机械取栓术治疗脑梗死取得巨大的成功[2]。然而,不管是溶栓药物还是机械取栓术都有严格的时间窗,大多数脑梗死患者因为错过短暂时间窗而未能获得有效治疗[1]。因此,研究神经保护剂及其在脑梗死中的保护作用依然是重要的研究方向。
祖国医学认为,中风的发病与痰、瘀、虚、风、火等因素有关,病性多为本虚标实,在本为元气亏虚,在标为痰火、风瘀,气虚血瘀是发病的关键环节,故在治疗上以益气补气活血化瘀为治则[3]。气虚导致血瘀是缺血性脑中风的病理基础,气虚血瘀是常见脑中风证型,临床上经常使用补阳还五汤是益气活血祛瘀法的代表方剂[4],该方能改善脑梗死患者的血液流变学,且疗效显著[5]。然而脑梗死病理基础是动脉血管发生粥样硬化,而这一过程与炎性反应关系密切。因此,急性脑梗死患者临床治疗中通常采取抑制炎性因子生成的方式来逆转斑块形成[6-7]。
白细胞介素1受体相关激酶M(interleukin-1 receptor associated kinase M,IRAKM)是IRAK家族成员之一,又名IRAK-3,可负调控toll样受体(toll-like receptors,TLRs)促炎信号通路,具有减轻组织炎症损伤的作用[8]。其通过抑制IRAK-4对IRAK-1的磷酸化,进而阻止IRAK-1与肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor associated factor 6,TRAF6)的解离,从而减轻下游NF-κB介导的炎症反应[9]。本课题组近期两项研究充分证实IRAKM在脑内小胶质细胞中特异表达且其诱导表达可介导缺血预适应和梗死后的脑保护作用[10-11]。笔者本研究进一步研究补阳还五汤对IRAKM表达及在基因敲除小鼠上的脑保护作用。报道如下。
1 材料与方法
1.1实验动物 基因敲除小鼠在南方医科大学无特定病原体(SPF)动物房饲养,C57BL/6野生型小鼠由Irak3杂合小鼠(Irak3-/-)交配繁殖而成。纳入研究雄性Irak3基因敲除和同笼繁殖野生型小鼠,鼠龄7~10周,体质量22~26 g。动物予12 h的明暗循环,饲养平均室温23 ℃,平均相对湿度为50%,自由进食和饮水。所有动物实验方案均已通过南方医科大学动物伦理委员会审查,并严格遵守中国以及美国国立研究所的动物实验相关指导方针,所有操作均尽最大努力减轻动物痛苦及减少动物使用数量。所有出生的小鼠都会取鼠尾后提取基因组DNA,PCR扩增后行琼脂糖凝胶电泳以鉴定各基因型。
1.2材料与试剂 补阳还五汤所用药材均由南方医院购自广州香雪制药有限公司,由南方医院中医科谢炜教授鉴定均为正品。Irak3基因敲除小鼠以C57BL/6为遗传背景并购自美国Jackson实验室(RRID:IMSR_JAX:007016)。基因组DNA提取试剂盒购自北京康为世纪公司(CW0530S),扩增鉴定试剂盒购自日本Takara(R074A)。单股尼龙线栓购自美国强生公司;二甲亚砜(DMSO)、RIPA、2,3,5-三苯基氯化四氮唑(TTC)购自美国Sigma公司;TRIzol购自美国Invitrogen;白细胞介素1β(interleukin,IL-1β)、IL-6、IL-10、肿瘤坏死因子α(TNF-α)、诱导型一氧化氮合酶(iNOS)、环氧合酶2(COX-2)和 β-actin的引物购自生工生物工程(上海)股份有限公司。
1.3仪器 超声多普勒购自美国摩尔仪器公司。小鼠脑槽购自深圳瑞沃德生物技术公司(68707)。荧光定量PCR仪LightCycler 480 II购自罗氏公司。
1.4小鼠前脑缺血-再灌注模型 小鼠在术前6 h禁食但不禁水,用异氟烷气体麻醉,术中以加热垫将小鼠体温维持在(37±0.5) ℃。小鼠按随机数字表法分为4组:假手术组,假手术+汤剂组,模型对照组,模型+汤剂组,每组6只。采用大脑中动脉栓塞(MCAO)法制备小鼠前脑缺血-再灌注模型,方法同前报道[12]。具体如下:结扎并游离颈外动脉,切口后将7-0尼龙单股线栓通过颈内动脉插入大脑中动脉,并梗阻该动脉持续45 min。假手术组和假手术+汤剂组插入的线栓仅抵达颈内动脉颈段,不栓线,其他操作一样。利用超声多普勒检测局部的脑血流,多普勒探头放置在大脑中动脉供血区(前囟后1 mm,中线侧方5 mm),分别在梗死前、梗死后、拔线栓前、拔除线栓后检测,梗死前所测得脑血流速度为基线值,将其他状态时脑血流表示为基数值的百分数,局部血流降低值<70%的小鼠被排除以保证各组小鼠均一性。
1.5补阳还五汤的准备与给药 人用补阳还五汤组成:生黄芪120 g,当归尾6 g,赤芍5 g,地龙、川芎、红花、桃仁各3 g。按此配比准确称量相应中药,水煎浓缩成含生药2 g·mL-1,避光,4 ℃冷藏箱中备用。依据人和小鼠体表面积折算,假手术+汤剂组,模型+汤剂组小鼠给予剂量为4 g·kg-1,每日早晚灌胃2次,在造模前灌胃给药3 d,造模后给药1 d,共8次,假手术组和模型对照组给予等容量0.9%氯化钠溶液。
1.6TTC染色 给药结束后,处死小鼠后,分离小鼠脑组织,置于-20 ℃冰箱中速冻15 min,取出置于预冷小鼠脑槽。冠状位切片,厚度1 mm,把切好的脑片浸到0.5% TTC溶液中,避光置于37 ℃放置15 min;取出脑片,用滤纸吸干液体,摄像。Image J软件计算梗死面积并定量。
1.7荧光定量聚合酶链反应(PCR) 用TRIzol提取总RNA,定量、反转录获取cDNA,然后再以cDNA为模板,加入TNF-α、iNOS、IL-1、β-actin的引物、荧光染料等在ABI 7500中进行PCR反应以对炎症因子mRNA进行定量。引物的序列见表1。

表1 定量PCR涉及到的基因引物序列
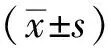
2 结果
2.1假手术和脑梗死小鼠脑血流 脑血流检查结果见表2。在插线栓前、插线栓后、拔线栓前、拔线栓后大脑中动脉供血区域的脑血流,可见脑血流降低约75%,局部血流降低值<70%小鼠被排除以保证各组小鼠均一性。
2.2IRAKM基因表达 荧光定量PCR法检测IRAKM表达结果见图1,不管是假手术或脑梗死模型,给予补阳还五汤能明显提高IRAKM表达水平至少3倍以上。该结果提示IRAKM有可能参与补阳还五汤的神经保护作用。
表2 两组小鼠在血管栓塞前后、再灌注前后的局部脑血流
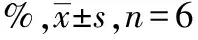
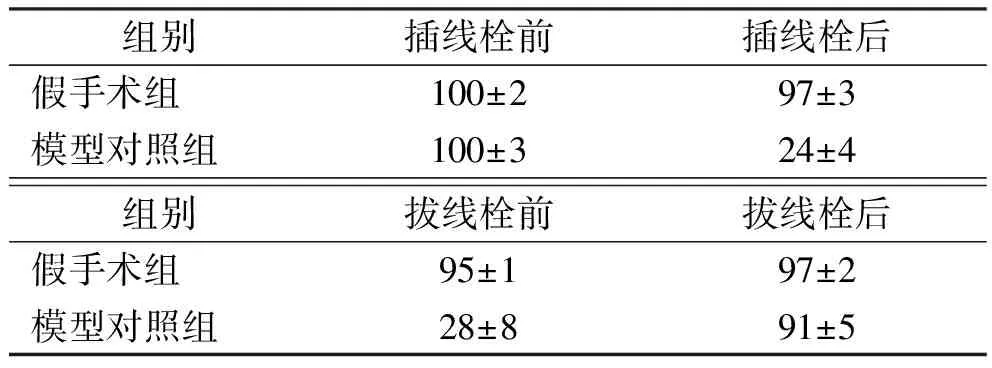
组别插线栓前插线栓后假手术组100±297±3模型对照组100±324±4组别拔线栓前拔线栓后假手术组95±197±2模型对照组28±891±5

A.假手术组;B.假手术+汤剂组;C.模型对照组;D模型+汤剂组;①与假手术组比较,P<0.01;②与模型对照组比较,P<0.01。
A.Sham operation group;B.Sham operation+decoction group;C.model control group;D.model+decoction group;①Compared with sham operation group,P<0.01;②Compared with model control group,P<0.01.
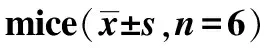
2.3IRAKM基因缺失炎症指标 图2结果显示,IL-β、IL-6和TNF-α在梗死后均有不同程度上升;对比同笼繁殖的野生型(KO)小鼠,IRAKM基因敲除(WT)后在非缺血侧对IL-β、IL-6和TNF-α影响不大,而在模型对照组中,基因敲除后有进一步增加的趋势,尤其是TNF-α (图2A-C)。诱导型一氧化氮合酶(iNOS)和环氧化酶(COX)2是脑梗死稍晚期表达并引起细胞炎性损伤的因子。结果显示,在模型对照组中,IRAKM基因敲除后,iNOS和COX-2的mRNA表达明显进一步增加(图2D-E)。此外,炎症抑制分子IL-10在基因敲除后基因表达也出现进一步的增加(图2F)。
2.4IRAKM基因敲除对补阳还五汤脑保护的影响 为了证实IRAKM基因是否介导补阳还五汤的脑保护作用,直接在KO和同周龄同笼繁殖WT小鼠上给予补阳还五汤给药和造模。图3,4结果显示,在WT小鼠上,补阳还五汤缩小脑梗死体积,具有一定的脑保护作用;IRAKM基因敲除后,梗死体积明显扩大,提示该基因对神经损伤和保护具有调控作用。而KO小鼠在补阳还五汤给药后并不能很好地发挥减小梗死体积的作用。说明IRAKM敲除后明显削弱补阳还五汤在脑梗死模型中的脑保护作用。

①与非缺血WT比较,P<0.05;②与同模型WT组比较,P<0.05;③与同模型WT组比较,P<0.01。
①Compared with non-ischemia of WT,P<0.05;②Compared with the same model of WT,P<0.05;③Compared with the same model of WT,P<0.01.
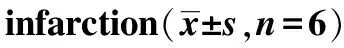
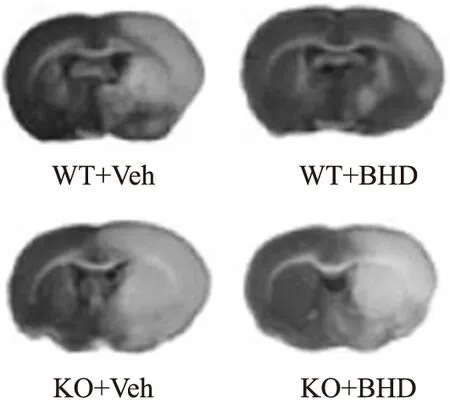
图3 补阳还五汤对敲除IRAKM(WT)和野生型(KO)小鼠脑保护作用
①Compared with WT+Veh,P<0.05;②Compared with WT+Veh,P<0.01.
Fig.3 Cerebral protection ofBuyangHuanwudecoction in IRAKM knockout (WT) or wild-type (KO) mice
3 讨论
中风是临床常见病,通常根据意识情况分为中经络和中脏腑。目前中风中经络大多本虚标实,气虚的基础上夹杂血瘀,因此,益气活血法是治疗中风中经络的常用治法,而补阳还五汤是其治疗的代表方剂,目前在临床上广泛使用,疗效显著。本研究从抗炎机制角度抓住一个抗炎的总开关分子“IRAKM”,挖掘补阳还五汤的神经保护机制,发现敲除IRAKM基因后可大大削弱补阳还五汤的脑保护作用,为补阳还五汤的作用机制研究提供了重要参考。

①与WT+Veh比较,P<0.05;②与WT+Veh比较,P<0.01。
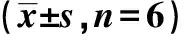
①Compared with WT+Veh,P<0.05;②Compared with WT+Veh,P<0.01.
Fig.4 Volume percentage of cerebral infarction in four groups of mice
IRAKM在较早前报导仅表达于单核细胞,通过强烈抑制NF-κB减少炎症因子的转录[13-15],该基因多态性与脓毒血症的敏感性具有相关性[16]。但其在脑内的定位与功能未知。本课题组曾发现IRAKM定位于小胶质细胞,受到高迁移率族蛋白(HMGB1)的诱导并介导细胞的缺血耐受[10]。进一步深入研究发现,IRAKM缺失能引起多种促炎因子过度表达并加剧脑梗死小鼠的神经血管损伤[11],这一研究提示IRAKM作为一个重要的抗炎分子在神经保护中重要作用。以其为靶标分子的药物筛选策略可能会对先导药物研发具有指引作用,对解析经典药物的作用机制也会有很大帮助。本研究中补阳还五汤在假手术和缺血-再灌注模型小鼠中均能显著诱导IRAKM表达,且其敲除后能显著减少补阳还五汤的脑保护作用,表明补阳还五汤通过IRAKM表达发挥脑梗死后神经保护。
补阳还五汤中活性成分众多,黄芪含有多种黄酮成分、黄芪皂苷等成分,这些都是经典的抗炎分子,在包括脑梗死在内的多种神经损伤模型中具有保护作用[17-19]。黄芪中单一成分或多个成分可从多个方面抑制谷氨酸受体,发挥神经保护进而抗脑缺血损伤的作用,与补阳还五汤重用黄芪具有一致性[20]。具体是哪种分子激活IRAKM表达还不清楚,有可能是众多分子一起发挥IRAKM诱导表达的功能,原因在于IRAKM表达本身受到多种转录因子调控,包括NF-κB、缺氧诱导因子1α(HIF-1α)、糖皮质激素受体(GR)和AP-1[21-24]。此外,补阳还五汤或其中活性成分通常都能同时抑制多种促炎因子的表达[18],具体原因不清楚。刘娟等[25]通过观察补阳还五汤对局灶性脑缺血损伤及再灌注损伤模型大鼠有明显改善作用。可以显著提高脑缺血损伤后大鼠相小窝蛋白1、2(caveolin1、2)、血管内皮生长因子及其受体阳性细胞数的表达,并降低脑内一氧化氮(NO)、一氧化氮合酶(NOS)的含量,增加超氧化物歧化酶(SOD)含量。
而IRAKM是调控这些分子的“总开关”,通过诱导这一个分子发挥作用,为其能同时抑制多种促炎因子表达找到解释。然而脑内的炎症不仅仅是小胶质细胞释放,内皮细胞、外周血巨噬细胞、淋巴细胞都或多或少地参与其中[26]。而IRAKM在脑内仅定位小胶质细胞,在外周血中定位于巨噬细胞,是否浸润的巨噬细胞也能被补阳还五汤诱导出IRAKM从而发挥抗炎作用,这点在本文中尚不明确。
脑缺血-再灌注损伤产生的自由基和炎症因子在引起梗死体积扩大的同时,会进一步导致血脑屏障破坏和脑水肿形成。本课题组发现,IRAKM在缩小脑梗死体积的同时,更重要的是其可以减轻血脑屏障破坏、脑水肿形成,甚至降低脑内出血转化的发生率[11]。考虑到IRAKM的诱导补阳还五汤抗炎的作用,很有可能其也参与补阳还五汤在脑梗死过程中保护血脑屏障和脑水肿的功能,当然这些假设还需要数据的进一步支持。
总之,该研究进一步拓展了IRAKM在脑保护功能,为经典方及补阳还五汤的药理机制研究提供新的靶标分子,为充分理解的作用机制提供了线索。
