敲减CDC7对膀胱癌T24细胞增殖、迁移、侵袭能力的影响
2020-06-17张琪,卓栋
张 琪,卓 栋
(皖南医学院第一附属医院弋矶山医院 泌尿外科,安徽 芜湖 241001)
膀胱癌是泌尿系统中仅次于前列腺癌的第二常见的肿瘤[1],发病率居男性恶性肿瘤第6位, 女性恶性肿瘤第11位[2],也是人类癌症相关死亡的第八大原因[3]。有相关研究表明膀胱癌复发的高危因素包括性别、肿瘤体积、病灶数量等[4-5]。但目前还没有可靠的参数来明确肿瘤复发的风险,在抑制肿瘤行为和判断预后方面比较困难[6],因此探索膀胱癌的发病机制,寻找并获得早期治疗的新方向十分重要。
细胞分裂周期7 (CDC7)蛋白是一种丝氨酸/苏氨酸激酶,其在DNA复制的起始和G1/S相变调控中起关键作用[7],在某些细胞类型中,CDC7可促进细胞周期中初始阶段的发生[8]。本研究通过对膀胱癌T24细胞敲减CDC7基因后进行CCK8实验、划痕实验、Transwell实验,探讨敲减CDC7对T24细胞的增殖、侵袭、迁移能力的影响,以判断其在膀胱癌发生发展中的作用,初步探讨其是否可成为膀胱癌治疗的新方向。
1 材料和方法
1.1细胞与试剂从中国科学院细胞库购入人膀胱癌T24细胞株。1640培养基、胎牛血清从Hyiclone公司购买。FastKing cDNA第一链合成试剂盒、qRT-PCR试剂盒购自天根公司,引物购于锐博公司,转染试剂LIPO3000购于Invitrogen公司。Transwell小室于美国Corning公司购买。CCK-8购于贝博公司。
1.2实时定量聚合酶链反应(qRT-PCR)收集皖南医学院弋矶山医院泌尿外科正常膀胱组织10例及新鲜膀胱癌组织10例。所有患者术前均未行特殊治疗,所有癌灶标本经病理科证实为膀胱癌,在离体后尽快置于-80 ℃冰柜中保存。充分研磨组织,按照Trizol试剂说明书提取组织总RNA,选择经检测纯度较高的RNA用于后续实验。根据FastKing cDNA第一链合成试剂盒进行逆转录,反应条件为:第一步42 ℃,3 min;第二步42 ℃,15 min;95 ℃,3 min。SYBR Green反应体系为20 μL,反应条件为:95 ℃ 15 min,1个循环;95 ℃ 10 s,60 ℃ 30 s,40个循环。利用ABI7500实时定量PCR仪检测CDC7的表达量。利用2-△△Ct法计算CDC7的相对表达量。
1.3细胞培养与转染将T24细胞接种于内含10%胎牛血清的1640培养基,在37 ℃、饱和湿度及含有5%CO2的培养箱中繁育。根据情况进行适当换液及传代,取对数生长期的状态良好的细胞用于后期实验,以每孔(2~3)×105细胞接种于6孔板中,当细胞生长30%~50%时,用siCDC7转染T24细胞作为实验组,siNC转染T24细胞作为对照组。
1.4CCK8实验用siCDC7及siNC分别转染T24细胞作为实验组和对照组,以每孔3×103细胞数种植到 96 孔板中,实验组和对照组分别设3个复孔。在0、24、48、72 h后向每孔加入10 μL CCK8试剂,放置培养箱孵育3 h后,在酶标仪450 nm的波长范围检测光密度值(OD值)。重复检测3次,检测敲减CDC7后细胞的增殖能力有何变化。
1.5细胞划痕实验将转染24 h后的两组细胞分别以每孔5×105细胞数种植于6孔板,待其几乎长满时,用10 μL枪头在6孔板内垂直画线,用PBS洗涤2遍后加入含1%血清的1640培养基,继续培养24 h后于倒置的显微镜下观察拍照。
1.6Transwell实验将Transwell小室置于24孔板中,向下室缓慢加入500 μL含20%胎牛血清的1640培养基。Matrigel基质胶按说明书稀释后平铺入Transwell小室中,收集转染24 h后的细胞,以无血清1640培养基重悬,每孔5×105·mL-1的细胞悬液200 μL接种于上室。培养24 h后,用少量PBS清洗小室膜,然后用4%多聚甲醛固定30 min,用0.1%结晶紫染料染色20 min,蒸馏水冲洗数次。于倒置的显微镜下观察,计数出穿过Transwell小室微孔膜的细胞个数。各组均选择相对平均的5个视野,分别计数出细胞个数,最后得出平均值。
1.7统计学方法采用GraphPad软件、SPSS软件进行作图及统计分析。满足正态分布的资料用均数±标准差描述,组间比较采用独立样本t检验;不满足正态分布的资料采用中位数(下四分位数,上四分位数)描述,组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1CDC7在正常膀胱组织和膀胱癌组织中的表达把CDC7在正常膀胱组织中的表达量作为1,qRT-PCR结果表明,CDC7在膀胱癌组织中的表达量为4.08±0.89,表明与正常膀胱组织相比,CDC7在膀胱癌组织中表达量增高明显(P<0.05)(图1)。
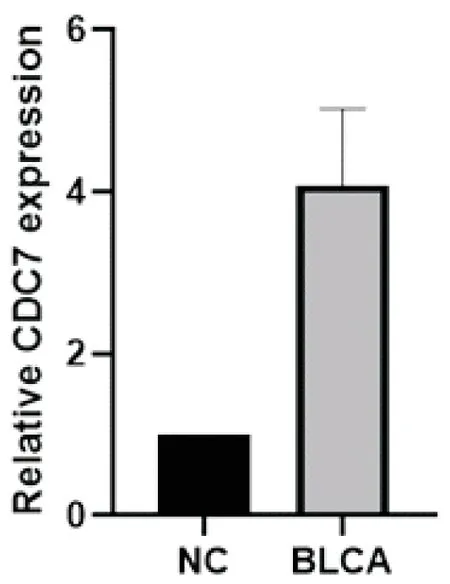
图1 CDC7在正常膀胱组织及膀胱癌组织中的表达
2.2细胞转染siCDC7及siNC分别转染T24细胞,转染24 h后,qRT-PCR检测转染效率,可见CDC7的敲减效率高,差异有统计学意义(P<0.05)(图2)。
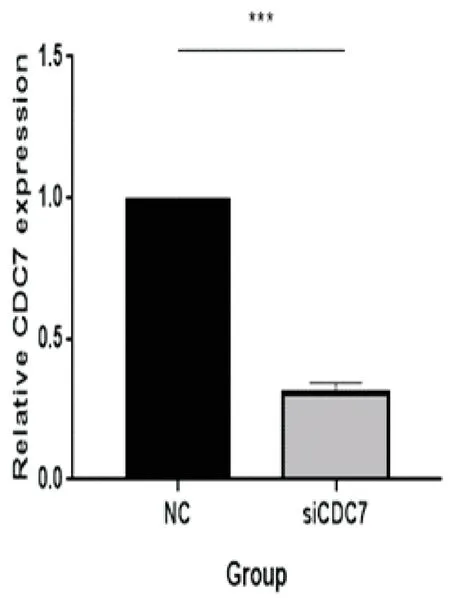
图2 siRNA转染T24细胞
2.3敲减CDC7对膀胱癌T24细胞增殖的影响CCK8结果显示实验组每个时间段的细胞生长数目较对照组明显减少,差异有统计学意义(P<0.05),表明CDC7敲低后可有效抑制T24细胞的增殖能力(图3)。

图3 敲减CDC7抑制T24细胞的增殖
2.4敲减CDC7对膀胱癌T24细胞迁移的影响将划线0 h、24 h后两组细胞的画线区域的细胞间距进行比较,发现实验组细胞的划痕宽度缩短较对照组减少,中间空白面积较大,实验组细胞的愈合率为[14.78(14.17,15.98)]%,对照组细胞的愈合率为[30.68(30.15,34.58)]%,差异有统计学意义(P<0.05),表明敲减CDC7后T24细胞愈合能力降低明显,细胞的迁移能力受到抑制(图4)。

图4 敲减CDC7抑制T24细胞的迁移(×100)
2.5敲减CDC7对膀胱癌T24细胞侵袭的影响被结晶紫染色的细胞数目,即代表穿过小室微孔膜的细胞数目,我们计数穿过Transwell小室微孔膜的细胞数,发现实验组细胞较对照组细胞数目明显减少(P<0.05),表明实验组细胞的侵袭能力减弱(图 5、图6)。

图5 敲减CDC7抑制T24细胞的侵袭(×100)

图6 两组穿过小室膜的细胞数目
3 讨 论
膀胱癌的发生发展是一个多因素、多步骤的复杂过程,有易复发和易转移的特点。约1/3的初发膀胱癌会发生局部进展和远处转移[8]。近些年新兴的分子靶向疗法为癌症的治疗带来了新的曙光,找到有效的致瘤靶点是目前的研究热点。
在正常细胞中CDC7的抑制或消耗可触发DNA的起始激活点,导致G1期可逆性的停滞[9],而癌细胞中CDC7的抑制诱导了p53非依赖性细胞凋亡[10]。有研究表明CDC7在卵巢癌[11]、肺癌[12]、结直肠癌[13]、乳腺癌[14]中均有异常表达。此外,CDC7的过表达还可通过多种途径增强肿瘤细胞的耐受性[15]。
在本研究中,qRT-PCR实验结果表明,CDC7在膀胱癌组织中的表达量要明显高于正常膀胱组织。进一步进行体外细胞功能实验,敲减CDC7后检测膀胱癌T24细胞的增殖能力、侵袭能力和迁移能力。实验结果表明敲减CDC7后可使膀胱癌T24细胞的增殖能力、侵袭能力、迁移能力均受到明显抑制。由此可见,CDC7在膀胱癌的发生发展中起着重要的作用,它有可能成为膀胱癌治疗的一个新方向,值得进一步研究。但由于本研究只使用了单一的细胞系,实验方向较为单一,还需要进一步实验验证其在膀胱癌中的临床意义和诊断价值。
