黄腐酚对胆管癌QBC939细胞生长和凋亡的影响及其机制研究
2020-06-17张坚红谢元康胡泽明谢斌辉
张坚红,谢元康,胡泽明,林 旋,何 晓,谢斌辉
(赣南医学院 1.第一附属医院肝胆胰外科;2.2017级硕士研究生;3.2018级硕士研究生,江西 赣州 341000)
胆管癌(Cholangiocarcinoma, CCA)是较为少见的恶性肿瘤,其发病率约占消化道肿瘤的3%。CCA发病率逐年来一直在上升,预后极差,5年生存率不超过10%[1]。其根治率低,且对化疗、放疗均不敏感,总体治疗效果差[1-2]。所以我们迫切需要研究新的抗肿瘤药物及其分子作用靶点来改善CCA患者的临床疗效。黄腐酚(xanthohumol, XN)是一种啤酒花中特有的异戊二烯基黄酮类化合物,啤酒花是众所周知的酿酒原料,并且作为民间药物被长期使用[3]。近年来黄腐酚因其广泛的生物学功能而备受关注。研究证实黄腐酚对前列腺癌、甲状腺癌、胰腺癌细胞等有明显的生长抑制作用[4-6],但具体作用机制尚不明确。本研究为进一步探讨黄腐酚对人胆管癌细胞生长抑制作用及其机制,现报道如下。
1 材料和方法
1.1试剂和抗体黄腐酚(X0379,纯度≥96%)购自Sigma公司。RPMI1640细胞培养基、胎牛血清购自Gibco公司。CCK-8试剂盒购自Dojindo公司。AnnexinⅤ-FITC/PI凋亡试剂盒购自BioVision公司。兔抗人Notch1(Notch intracellular domain,NICD)、NF-κB p65、cleaved Caspase-3、β-tubulin、PCNA抗体购自CST公司。Alexa Fluor 488标记羊抗兔IgG(H+L)、HRP标记羊抗兔IgG(H+L)二抗购自Beyotime公司。BCA蛋白检测试剂盒、ECL试剂盒购自Pierce公司。
1.2细胞培养人胆管癌QBC939细胞株从ATCC公司购得。采用含10%胎牛血清、100 units·mL-1青霉素、100 μg·mL-1链霉素的RPMI1640培养基在37 ℃、5%CO2饱和湿度培养箱培养。
1.3CCK-8法检测细胞存活率应用CCK-8试剂盒检测不同浓度(0 μM、10 μM、20 μM、30 μM)的XN作用后的细胞活力。QBC939细胞每孔约5×103个接种于96孔培养板中培养。培养24小时后,每组分别加入0 μM、10 μM、20 μM、30 μM XN,继续孵育24小时,弃去旧培养基,每孔加入10 μL的CCK-8溶液和100μL培养基,继续孵育3小时,立即上酶标仪,于450 nm检测吸光度(Absorbance,A)。细胞存活率Survival rate(%)=(Asample-Ablank)/(Acontrol-Ablank)×100%。
1.4流式细胞仪检测细胞凋亡率用AnnexinⅤ-FITC/PI凋亡试剂盒检测细胞凋亡率。QBC939细胞接种于6孔板中培养,每孔约5×105个细胞。培养过夜后,分别加入不同浓度的XN溶液(10 μM、20 μM、30 μM)或DMSO,作用24小时。常规消化收集细胞,PBS洗涤。用500 μL 1×Binding buffer重悬细胞,加入5 μL Annexin Ⅴ-FITC和10 μL PI,室温下避光孵育5分钟后,流式细胞仪(Becton Dickinson FACS Calibur)检测细胞凋亡。
1.5免疫荧光检测cleavedCaspase-3蛋白表达QBC939细胞接种于6孔板中培养,每孔约3×105个细胞。培养过夜后,加入20 μM XN或DMSO,作用24小时。取出细胞,PBS洗涤,4%多聚甲醛室温固定30分钟,0.2%Triton X-100透膜,5%BSA封闭,加入兔抗人cleaved Caspase-3抗体37 ℃作用2小时,Alexa Fluor 488标记羊抗兔IgG(H+L)二抗37 ℃避光孵育30分钟,封片,共聚焦显微镜(Olympus Fluoview FV1000)拍片。
1.6Westernblot检测相关蛋白表达胆管癌QBC939细胞接种于6孔板中培养,每孔约3×105个细胞。培养过夜后加入不同浓度XN溶液(10 μM、20 μM、30 μM)或DMSO作用24小时后,收集细胞。按照细胞核蛋白与细胞浆蛋白抽提试剂盒(Beyotime)的步骤提取细胞核蛋白与细胞浆蛋白。用BCA法测蛋白浓度。用8%~12% SDS-PAGE电泳分离蛋白,再电泳转移至PVDF膜上。5% BSA封闭,滴加一抗(兔抗人Notch1、NF-κB p65、cleaved Caspase-3),加HRP标记羊抗兔IgG二抗,ECL显色,X线胶片曝光。
1.7统计方法所有实验均重复3次。应用SPSS 22.0软件对数据进行统计学处理。数据以均数±标准差表示,均数差别的显著性检验采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1XN对胆管癌细胞活力的影响在本实验中,首先研究了XN对胆管癌细胞活力的影响。胆管癌QBC939细胞经不同浓度XN(0 μM、10 μM、20 μM、30 μM)处理24小时后,采用CCK-8法检测细胞的活力。如图1所示,随着XN浓度的增大,细胞的存活率从100%降至52.77%(统计量F为470.93,各XN处理组存活率与对照组相比P均小于0.05,差异均有统计学意义)。
2.2XN对胆管癌细胞凋亡率的影响磷酯酰丝氨酸(phosphatidylserine,PS),主要分布在细胞膜内侧。在细胞发生凋亡的早期,细胞都会把磷酯酰丝氨酸外翻到细胞表面,Annexin V能选择性结合PS。而碘化比啶(PI)能透过细胞膜完整性丧失的凋亡晚期细胞。细胞凋亡率为结合Annexin V和PI的细胞之和。如图2所示,用不同浓度(10 μM、20 μM和30 μM)的XN处理胆管癌QBC939细胞后,各组的细胞总凋亡率分别为6.72%、28.33%、40.52%(统计量F为1305.10,各XN处理组细胞凋亡率与对照组相比P均<0.05,差异均有统计学意义)。
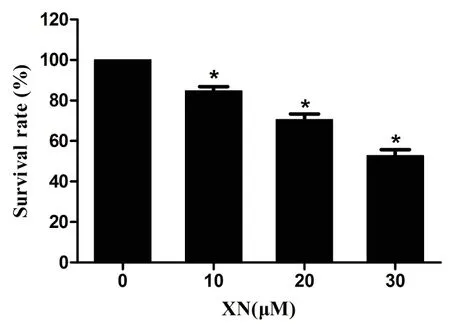
图1 XN对胆管癌细胞活力的影响

图2 XN对胆管癌细胞凋亡率的影响
A.流式细胞仪图片;B.各组的凋亡率。凋亡率等于右上象限和右下象限之和。与对照组比较,n=3,*P<0.05。
2.3XN对胆管癌细胞Caspase-3蛋白的影响我们先用免疫荧光的方法检测了细胞凋亡重要分子Caspase-3的表达。Alexa Fluor激发峰值为495 nm,发射峰值为519 nm,与Caspase-3一抗结合后在共聚焦显微镜下可显示绿色荧光。20 μM XN作用胆管细胞后,用免疫荧光法检测到细胞胞浆内的Caspase-3裂解活性片段明显增多(图3A)。我们再次用Western blot检测了Caspase-3的表达。Western blot结果显示,与对照组相比,XN处理组活化的Caspase-3表达显著增强(图3B)。
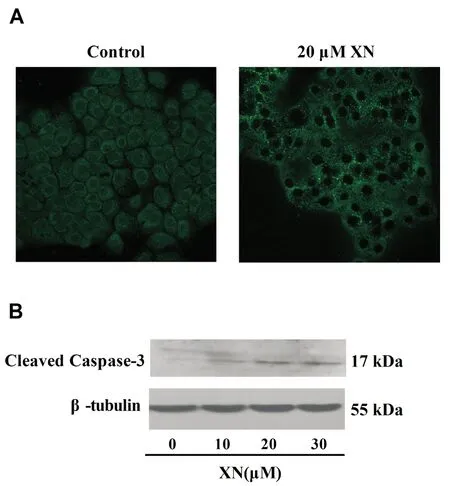
图3 XN对胆管癌细胞Caspase-3蛋白的影响
A.免疫荧光检测cleaved Caspase-3表达;B.Western blot检测cleaved Caspase-3表达。
2.4XN对胆管癌细胞Notch1、NF-κB蛋白的影响为进一步研究黄腐酚对胆管癌QBC939细胞的作用机制,我们采用Western blot检测了Notch1、NF-κB p65蛋白的表达。如图4所示,黄腐酚能显著地抑制胞浆内Notch1的表达。黄腐酚作用后的胆管癌细胞核内的NF-κB p65亚基明显减少。

图4 XN对胆管癌细胞Notch1、NF-κB蛋白的影响
3 讨 论
在本实验中,我们首先通过细胞增殖实验研究了黄腐酚对胆管癌QBC939细胞的生长抑制作用。接着,我们进一步证实了黄腐酚对QBC939细胞的凋亡诱导作用。在我们的实验中观察到,处理组的细胞存活率较对照组明显降低,以及处理组的细胞凋亡率较对照组相比明显升高。细胞凋亡作为细胞死亡的一种重要形式,是一种在基因控制下的主动死亡过程,它对维持机体正常发展和体内平衡有着重要作用,目前许多抗肿瘤药物是通过诱导细胞凋亡从而达到治疗肿瘤的目的[7-8]。其中,Caspase-3是凋亡的执行者[7]。我们首先用免疫荧光的方法检测到黄腐酚作用后的细胞内活化的Caspase-3明显增多。Western blot结果显示黄腐酚作用后的细胞内活化的Caspase-3裂解片段明显增多,这进一步验证了黄腐酚的凋亡诱导作用。
Notch信号通路是一条保守的信号通路,广泛存在于无脊椎动物和脊椎动物中[9]。经典的Notch信号通路包括受体及相应配体﹑核连接蛋白和下游靶基因。在哺乳动物中Notch有四个同源受体,分别为 Notch-1,Notch-2,Notch-3,Notch-4。大量研究证实Notch基因对细胞的分化、发育、增殖和凋亡有重要的调控作用[9-10]。STEFFEN ZENDER等研究发现Notch信号过表达能促进胆管癌细胞增殖﹑迁移﹑上皮细胞间皮化及抗肿瘤药免疫[10]。Notch信号通路成为癌症研究的热点之一。近些年,国内外基于Notch信号通路癌症相关研究不断深入。在本研究中,我们发现黄腐酚作用后的胆管癌细胞胞浆内Notch1表达明显下降,从而发挥其对胆管癌细胞的生长抑制和凋亡诱导作用。
为进一步研究黄腐酚对胆管癌细胞的作用机制,我们检测了NF-κB p65亚基的表达。Western blot结果显示黄腐酚作用后的胆管癌细胞核内的NF-κB p65明显减少。这说明黄腐酚可抑制NF-κB的p65亚基向核内转移,减弱其DNA的结合活性和转录活性,从而抑制肿瘤细胞生长。NF-κB作为细胞中重要的转录因子,参与调控细胞的分化、凋亡、以及细胞迁移、侵袭等重要生理过程。异常活化的NF-κB能够促进肿瘤的形成和导致肿瘤的恶性程度加剧[11]。而且研究证实活化的Notch能够激活NF-κB信号通路,促进肿瘤细胞的生长[11-12]。所以我们研究结果表明,黄腐酚有可能是通过抑制Notch1-NF-κB通路来发挥抗胆管癌的作用。然而,对于黄腐酚抑制Notch1-NF-κB通路的具体机制,还需进一步研究。
