天丹通络胶囊对急性脑梗死大鼠神经功能缺损评分及海马区Nogo-A和LPA蛋白表达的影响
2020-06-17陈红梅秦碧勇尤志
陈红梅 ,秦碧勇 ,尤志
(1.湖北医药学院附属人民医院,湖北 十堰 442000; 2.湖北省武汉市江夏第一人民医院,湖北 武汉 430200)
急性脑梗死为常见脑血管疾病,有很高的发病率和死亡率,正在成为公共卫生的主要挑战[1]。目前,重组组织纤溶酶原是治疗急性脑梗死临床最有效的药物,但有时间窗限制,不良反应较多[2]。氧自由基、神经元凋亡、兴奋性氨基酸的毒性及脑组织代谢异常引起的损伤与急性脑梗死的发生和发展有关,氧化应激是缺血-再灌注损伤的主要发病机制,且是导致脑梗死的重要原因[3]。溶血磷脂酸(LPA)是一种新发现的细胞间磷脂类信号分子,常作为体内凝血或血栓形成启动的分子标志物,其可诱导血小板形态改变,促进血小板聚集和活化,而活化的血小板可释放 LPA[4]。勿动蛋白 -A(Nogo-A)由中枢神经系统(CNS)少突胶质细胞及一些神经元产生,存在于髓鞘的内外环和少突胶质细胞的表面,与神经元的存活和发育密切相关,Nogo-A及LPA的产生与氧化应激密切相关[5]。天丹通络胶囊主要功效为活血通络、熄风化痰,用于中风中经络、风痰瘀血痹阻脉络症,见半身不遂、偏身麻木、口舌歪斜、语言蹇塞,脑梗死急性期、恢复早期见上述证候[6];具有抗氧化、抗炎、抗细胞凋亡和神经保护作用,其抗氧化效力是α-生育酚的500倍;毒性低和不良反应少,是心血管和神经系统疾病的有效治疗药物[7]。本研究中探讨了天丹通络胶囊对急性脑梗死大鼠神经功能缺损评分及海马区Nogo-A及LPA蛋白表达的影响,为急性脑梗死的治疗提供理论依据。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:PRO-200型组织均质器(德国默克公司),VR-98型紫外分光光度计(美国Thermo Fisher Scientific公司),ABIPRISM®7300型RT-qPCR系统(美国Applied Biosystems公司);EC3型成像系统(美国Upland公司)。
试药:天丹通络胶囊(山东凤凰制药股份有限公司,国药准字Z20010029,批号为C14001035399,规格为每粒 0.4 g);TRIzol®(Invitrogen,Thermo Fisher Scientific公司,批号为 65412);PrimeScript RT 试剂盒(Invitrogen,Thermo Fisher Scientific公司,批号为63541);放射免疫沉淀测定裂解缓冲液(Pierce Rockford IL,批号为52489);BCA 蛋白定量试剂盒(Thermo Fisher Scientific,Inc,批号为 20154);10%聚丙烯酰胺凝胶电泳膜(polyacrylamide gel electrophoresis,SDS-PAGE,Sigma,批号为12547);聚偏二氟乙烯膜(美国赛默飞世公司,批号为 AZ5486);TBS-T(含有 0.05%Tween-20,碧云天科技公司;批号为 1247);Nogo-A,LPA 抗体(Cell Signaling Technology,Inc,目录号为 2225S 和 65841,稀释度为1∶1 000);β-肌动蛋白抗体(武汉博斯特生物技术有限公司,目录号为 BM0627,稀释度为1∶300);辣根过氧化物酶偶联的山羊抗兔二抗(武汉博斯特生物技术有限公司,目录号为GA1014,稀释度为1∶5000);ECL溶液(EMD Millipore,Billerica,MA,批号为 2015633)。
动物:SPF级SD大鼠80只,7~8周,体质量250~280 g,由苏州大学医学部实验动物中心提供[许可证号为 SCXK(苏)2019-0012,合格证号为 SCXK(苏)2018-0013]。该研究经医院动物伦理委员会批准。
1.2 动物分组、造模与给药
所有大鼠根据体质量随机分为对照组(A组)、模型组(B 组)、天丹通络胶囊低剂量组(C1组,40.0 mg /kg)、天丹通络胶囊高剂量组(C2组,80.0 mg /kg),每组20只,雌雄各半。各组大鼠用水合氯醛(400 mg/kg)麻醉并置背卧位,直肠温度维持在(37.0 ± 0.5)℃,手术暴露右颈总动脉,颈内动脉和颈外动脉,然后将颈外动脉分离并结扎。B组、C1组、C2组将4-0尼龙缝合线通过颈外动脉残端插入颈内动脉,并轻轻推进以闭塞大脑中动脉。闭塞90 min后,小心地移除缝合线以恢复血流,闭合颈部切口,将大鼠放回温暖的笼子中。C1组及C2组于造模成功第1天开始给予相应剂量药物灌胃(天丹通络胶囊内容物,灌胃体积为每100 g体质量1.0 mL),持续给药3个月,A组和B组大鼠给予等体积生理盐水。
1.3 大鼠神经运动功能评价
神经系统检查:治疗7 d及14 d后,以盲法进行神经系统检查。使用0~5分制的神经功能缺损评分进行评估。0分,无神经功能障碍症状;1分,前爪无法完全伸展;2分,走路时向内旋转;3分,走路时向内倾斜;4分,无法自发行走和失去知觉;5分,完全无法行走。
双侧贴纸去除试验:动物术后14 d,用2片边长10 mm的正方形黏性纸将大鼠2个前肢掌面粘住(黏性程度以正常大鼠10 s内将黏性纸咬掉为佳),将大鼠置测试圆筒中,大鼠会本能地将纸片咬掉。观察并记录大鼠去除两侧纸片的总时间,若120 s内未去除纸片,记为120 s[8]。
平衡木行走试验:动物术后14 d进行。平衡木为105 cm×4 cm×3 cm木条,两端固定使木条离地80 cm。起始点为陡峭平台,终点为一平台。记录大鼠四肢均通过整个平衡木的时间;超过120 s未通过整个平衡杆记为120 s,大鼠从平衡杆跌落记为超过120 s未通过。测试前大鼠每天训练1次,共训练2 d[9]。
1.4 大鼠脑梗死结构观察
大体标本观察:造模后1 h直接取脑,观察创伤区病理改变。鼠脑经-80℃冰箱速冻后,切取厚2 mm创伤区冠状脑片,观察冠状剖面脑组织病理变化。
HE染色观察:造模后1 d灌注取脑,常规制作厚6 μm石蜡切片,按照产品说明书行HE染色,10倍及200倍显微镜下观察创伤区病理变化。
1.5 大鼠海马组织Nogo-A及LPA基因水平检测
从海马标本中总共获得100 g组织,添加1 mL TRIzol®并与组织均质器混合搅拌,根据制造商的规程提取总RNA。使用VR-98型紫外分光光度计检测总RNA浓度和纯度,并使用PrimeScript RT试剂盒进行反转录合成cDNA。转录合成的cDNA产物储存在-20℃下供以后使用。Nogo-A,LPA,GAPDH引物由苏州泓迅生物科技股份有限公司提供。GAPDH被用作参考基因,各引物序列如下。Nogo-A:正向5′-CCCGTGTCGACGATGTAGCGCTAGA-3′,反 向 5′-TCGTAGCTATGCGATACGTACACAAC-3′;LPA:正向 5′-CTAGTAGCTAGAAAGTCGCCTAAACGTG-3, 反 向 5′-CTAGTCAATGCTAGCTTCGTTGTGACCCGTAGTAGCTGA-3;GADPH:正向 5′-CTAGAGGGGAAATCCTATCGATGACATAGTCAG-3, 反 向 5′-CTGACGTAGCTTGAACTGATGCTAGCTTCGTTGTCTGATGCTGAT-3。使用 RT-qPCR系统检测Nogo-A和LPA mRNA的表达。RT-qPCR扩增反应的总体积为25 μL,热循环仪条件如下:50℃ 2 min,95℃ Taq酶活化 10 min,95 ℃ 15 s,然后60 ℃ 1 min,共 40 个循环。2-ΔΔCq方法用于证明 Nogo-A和LPA的相对表达。
1.6 大鼠脑梗死海马组织Nogo-A和LPA蛋白检测
使用放射免疫沉淀测定裂解缓冲液提取海马组织总蛋白样品,并使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白质(每泳道100 ng蛋白质)通过10%聚丙烯酰胺凝胶电泳膜分离,使用湿化学法转移到聚偏二氟乙烯膜上,并在室温下与5%脱脂奶粉一起搅拌并封闭2 h;将膜用TBS-T洗涤3次,然后与Nogo-A及LPA抗体或β-肌动蛋白抗体在4℃下过夜。用TBS-T洗涤后,将膜与辣根过氧化物酶偶联的山羊抗兔二抗一起在室温下孵育1 h;此后,使用ECL溶液进行化学发光,并使用EC3成像系统对蛋白质条带进行可视化,并通过灰度定量使用Image J软件(美国国立卫生研究院)进行分析。重复操作3遍。
1.7 统计学处理
2 结果
2.1 大鼠神经运动功能评分
治疗7,14 d后,B组神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间明显高于A组(P<0.05);C1组及 C2组上述指标均明显低于 B组(P<0.05),且随着给药剂量的增加,7d和14 d神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间均逐渐降低(P<0.05)。详见表1。
表1 各组大鼠神经运动功能的比较(±s,n=20)
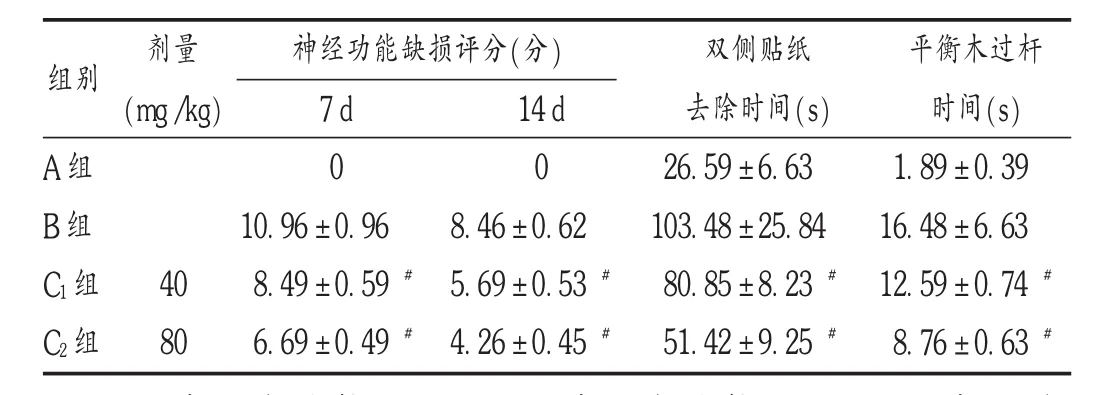
表1 各组大鼠神经运动功能的比较(±s,n=20)
注:与 A 组比较, P <0.05;与 B 组比较,#P <0.05;与 C1组比较, P <0.05。下表同。
组别剂量(m g/k g)神经功能缺损评分(分)A组B组C 1组C 2组4 0 8 0 7 d 0 1 0.9 6 ±0.9 6 8.4 9 ± 0.5 9 #6.6 9 ± 0.4 9 #1 4 d 0 8.4 6±0.6 2 5.6 9 ± 0.5 3 #4.2 6 ± 0.4 5 #双侧贴纸去除时间(s)2 6.5 9 ± 6.6 3 1 0 3.4 8 ±2 5.8 4 8 0.8 5 ± 8.2 3 #5 1.4 2 ± 9.2 5 #平衡木过杆时间(s)1.8 9 ±0.3 9 1 6.4 8 ±6.6 3 1 2.5 9 ±0.7 4 #8.7 6 ±0.6 3 #
2.2 大鼠脑梗死海马结构
结果见图1。可见,A组海马组织神经细胞正常,B组海马组织见大量坏死神经元,呈缺血样病理改变,空泡样变性坏死数量较多;C2组海马组织神经细胞坏死有明显改善;C1组神经元疏松紊乱,但坏死神经元细胞减少。
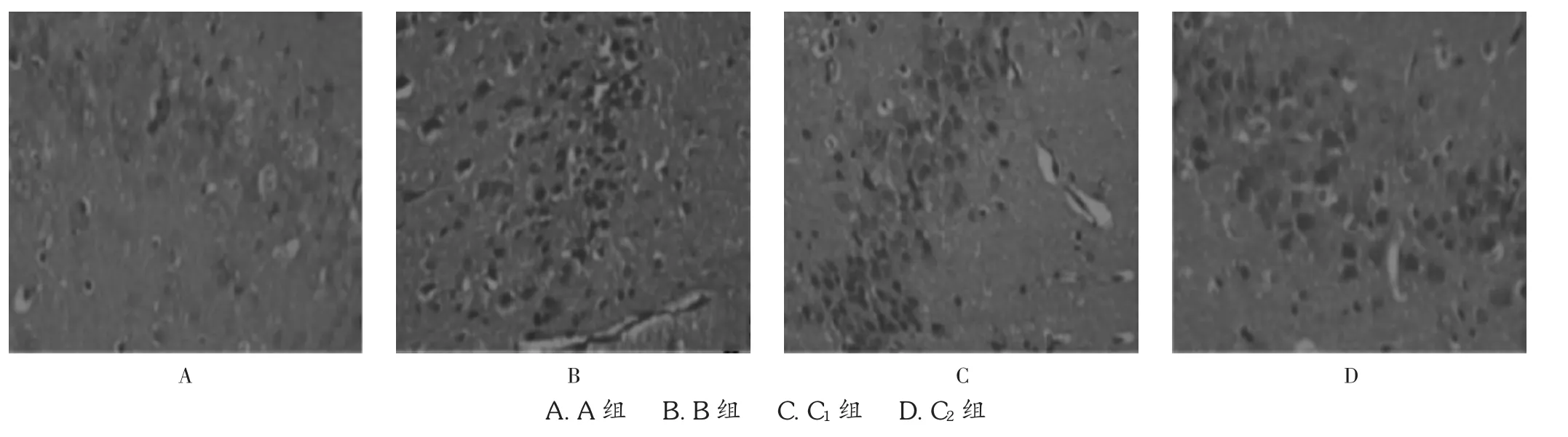
图1 天丹通络胶囊对大鼠海马结构的影响(HE,×200)
2.3 大鼠海马Nogo-A及LPA的mRNA和蛋白表达
B组海马Nogo-A和LPA的mRNA表达水平明显高于 A 组(P <0.05);C1组及 C2组海马 Nogo-A 和LPA mRNA表达水平明显均低于A组(P<0.05),且随着天丹通络胶囊给药剂量的增加而逐渐降低(P<0.05)。B组海马Nogo-A和LPA蛋白表达水平明显高于A组(P<0.05);C1组及 C2组海马 Nogo-A 和 LPA 蛋白表达水平明显低于模型组(P<0.05),且随着给药剂量的增加而逐渐降低(P<0.05)。详见表2及图2。
表2 天丹通络胶囊对急性脑梗死大鼠海马Nogo-A及LPA的mRNA和蛋白表达水平的影响(±s,n=20)

表2 天丹通络胶囊对急性脑梗死大鼠海马Nogo-A及LPA的mRNA和蛋白表达水平的影响(±s,n=20)
组别剂量(m g/k g)N o g o-A m R N A L P A m R N A N o g o-A蛋白L P A蛋白A组B组C 1组C 2组4 0 8 0 1.5 2 ±0.4 1 6.9 6 ±0.3 9 5.4 1 ±0.5 4 #2.2 6 ±0.4 9 #1.6 9 ± 0.4 8 5.9 9 ± 0.5 9 4.1 2 ± 0.5 9 #2.1 5 ± 0.5 1 #0.8 9 ±0.3 6 6.6 2 ±0.3 9 5.9 6 ±0.4 8 #2.1 4 ±0.5 3 #1.2 9 ±0.4 7 6.4 8 ±0.5 9 4.9 9 ±0.4 2 #2.2 6 ±0.6 9 #
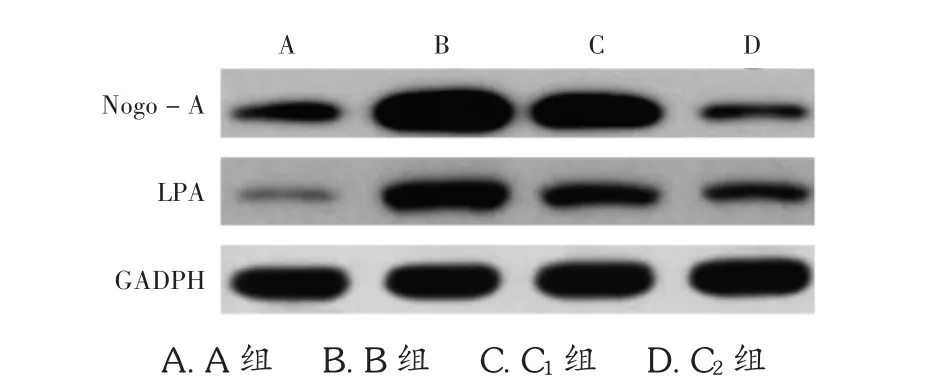
图2 天丹通络胶囊对急性脑梗死大鼠海马Nogo-A和LPA蛋白表达水平的影响
3 讨论
急性脑梗死的病理基础为脑组织发生急性缺血,局灶性脑微血管内皮细胞受损,血脑屏障功能丧失,脑细胞发生细胞凋亡和坏死。天丹通络胶囊有抑制脑水肿、抗氧化应激损伤和调节神经营养因子如脑源性神经营养因子(BDNF)和神经生长因子(NGF)表达的作用[10]。本研究结果显示,B组7 d和14 d神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间明显高于A组,表明大鼠急性脑梗死模型建立成功,而天丹通络胶囊可明显降低7 d和14 d神经功能缺损评分、双侧贴纸去除时间、平衡木过杆时间,表明天丹通络胶囊对急性脑梗死大鼠神经功能缺损有保护作用。
药理学研究显示,天丹通络胶囊可抑制大鼠血小板聚集,促进已聚集的血小板解聚;可延长凝血酶原、凝血酶和白陶土部分凝血活酶时间,使大鼠凝血时间延长;缩短大鼠优球蛋白溶解时间;改善肌肉注射地塞米松磷酸钠引起的激素性血瘀大鼠全血黏度;可延长电流刺激所致大鼠动脉血栓形成的时间;降低结扎颈总动脉所致的急性脑缺血大鼠脑血管的通透性和脑组织的含水量;减轻电热阻断大鼠大脑中动脉所致脑缺血病变的程度[11]。本研究结果显示,B组脑梗死组织见大量坏死神经元,呈缺血样病理改变,空泡样变性坏死数量较多;C2组脑组织神经细胞坏死有明显改善;C1组神经元疏松紊乱,但坏死神经元细胞减少,表明天丹通络胶囊能明显减少神经元细胞坏死。
脑梗死急性期,缺血区域中央带的神经元在几分钟内会发生不可逆坏死,出现相应的神经功能缺损症状,导致神经元凋亡和生物学功能丧失。故细胞凋亡在急性脑梗死的发生和发展中起重要作用。研究表明,Nogo-A可与凋亡途径中的某些保守成分,即半胱天冬酶(Caspase)反应[12],可直接促进 Caspase 活化。Caspase 也是细胞凋亡途径的中心环节。Nogo-A还可促进哺乳动物中 Caspase-1,Caspase-3,Caspase-6,Caspase-7,Caspase-8,Caspase-10的活化。Nogo-A在神经细胞表面相互作用,并参与受体和线粒体的凋亡途径。基于此,抑制Nogo-A的激活可能是脑梗死的重要治疗靶点。LPA在毛细血管附近的星形胶质细胞足突和室管膜细胞中组成性表达,通过充当血脑屏障(BBB)和血脑脊液屏障的关键成分来调节脑脊液稳态[13]。在缺氧和局部缺血中,血脑屏障的破坏和血管通透性的增加与大脑中LPA的上调有关。LPA在脑缺血中上调,并与血脑屏障破坏、水肿形成和出血性转化密切相关。在急性脑缺血中,血脑屏障破坏与LPA的表达上调相关,可能加剧神经元损伤和治疗后的出血性转化。活化的LPA可直接破坏神经血管基质,如紧密连接蛋白(ZO-1,claudin-5,occcludin)和基底层(胶原蛋白Ⅳ,层黏连蛋白和纤连蛋白),并导致血脑屏障分解最终出血和水肿。动物实验表明,降低了活性LPA的上调,血脑屏障出血减少,进而减少脑梗死的发生[14]。本研究结果显示,天丹通络胶囊明显降低了脑梗死海马区Nogo-A及LPA的mRNA和蛋白表达水平。表明天丹通络胶囊可能通过抑制脑梗死海马区Nogo-A及LPA的mRNA和蛋白表达水平,进而抑制神经元细胞的坏死与凋亡。
综上所述,天丹通络胶囊对急性脑梗死大鼠神经功能缺损有防护作用;其作用机制可能与天丹通络胶囊通过抑制脑梗死海马区Nogo-A及LPA的mRNA和蛋白表达水平,进而抑制了神经元细胞的坏死与凋亡有关。
