注射剂仿制药一致性评价现状与分析
2020-06-17常丽梅李晓林
常丽梅 ,李晓林 ,张 辉 ,朱 明 ,林 凯
(1.海南省药品审核认证管理中心,海南 海口 570216; 2.中国药科大学药学院,江苏 南京 211198)
注射剂是指原料药物或与适宜的辅料制成的供注入体内的无菌制剂,可分为注射液、注射用无菌粉末与注射用浓溶液等[1]。注射剂一般直接或经溶解、稀释后注入血管、组织或器官,是临床使用风险较高的剂型,故对其安全性、有效性和质量要求更严格[2]。2012年,我国《国家药品安全“十二五”规划》[3]提出分期分批对仿制药进行质量和疗效一致性评价(以下简称一致性评价)。通过逐步摸索,已逐渐形成一致性评价工作开展路径,最初主要以口服固体制剂为主。2016年,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》[4],明确了评价对象和时限。随着国家药品监督管理局(NMPA)公布的2018年底前须完成仿制药一致性评价品种(“289品种”)目录[5],标志着仿制药一致性评价工作全面启动。为推进化学药品注射剂仿制药一致性评价工作,2017年12月22日,国家药品监督管理局药品审评中心(CDE)首次公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》意见[6]。2019年10月15日,NMPA再次就《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》[7]公开征求意见,标志着化学药品注射剂仿制药一致性评价正式启动。但从CDE承办的一致性评价受理情况来看,注射剂仿制药一致性评价于2018年已开始开展。本研究中首先从参比制剂公布、申报情况和获批情况3个方面对注射剂仿制药一致性评价的开展情况进行了汇总,总结当前注射剂仿制药一致性评价工作的常见问题,探讨了注射剂仿制药的发展趋势。
1 现状[8]
1.1 注射剂仿制药参比制剂大批量公布
截至2019年9月30日,NMPA及CDE公布了24批化学药品仿制药参比制剂目录(其中第23批与第24批目录为征求意见稿)。从第21批开始(2019年3月28日发布)[9],目录名单中包含了注射剂品种,且一次性公布了244个注射剂品规的参比制剂,在随后公布的3批目录中也含有大量注射剂品种,24批目录涉及注射剂628个品规(259个品种)。
参比制剂的确定是仿制药一致性评价的首要和重要工作,大批量注射剂参比制剂的公布作为受理审评非常重要的标准,为注射剂仿制药一致性评价工作的开展起到了充分的支撑作用。对于个别已公布或暂未公布参比制剂的产品,由于其生产厂家不再进行市场供应,导致参比制剂仍无法获得,一定程度上限制了这些产品一致性评价工作的开展。
1.2 注射剂仿制药一致性评价申报数量可观
2017年12月22日,CDE发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,从2018年开始,陆续有厂家进行注射剂仿制药一致性评价的申报。截至2019年9月30日,CDE共承办了439个注射剂仿制药一致性评价的受理申请,涉及95个厂家(集团内不同分厂按不同厂家统计),共计123个品种。可见,近2年来,注射剂仿制药一致性评价工作已大规模开展。通过对受理相关信息进行梳理发现,仅7个制药集团(18个厂家)的受理号就已达受理总量的44.65%,出现了较大的厂家集中度。详见表1。
1.3 已通过一致性评价注射剂品种屈指可数
截至2019年9月30日,《中国上市药品目录集》[10]收录的注射剂仿制药有13条,含9个品种12个品规,收录类别有“按化学药品新注册分类[11]批准的仿制药”“通过质量和疗效一致性评价的药品”,且仅注射用阿奇霉素1个品种按“通过质量和疗效一致性评价的药品”收录(见表2)。可见,注射剂仿制药一致性评价注册申报数量可观,但已获批通过并收录于《中国上市药品目录集》的却很少。
2 常见问题
2.1 部分产品的剂型选择合理性不足
仿制药一致性评价是对已上市仿制药进行质量提升的过程,也是对某些已上市产品的存在是否合理的重新评估。在口服固体制剂的一致性评价工作中,以“289品种”为例,显然已有部分品种由于立题依据缺乏科学性和无参比制剂可对照而放弃开展一致性评价。同样,注射剂仿制药一致性评价也存在部分立题依据合理性不足的品种,主要是某些“三改”品种(改规格、改剂型、改盐基注射剂),如将稳定性较好的品种从注射液改为冻干粉针剂、将小容量注射液改为大容量注射液后导致稳定性明显下降等。对于这些品种,将难以开展一致性评价,开展再评价工作也应慎重评估,其基本考虑参见《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》。
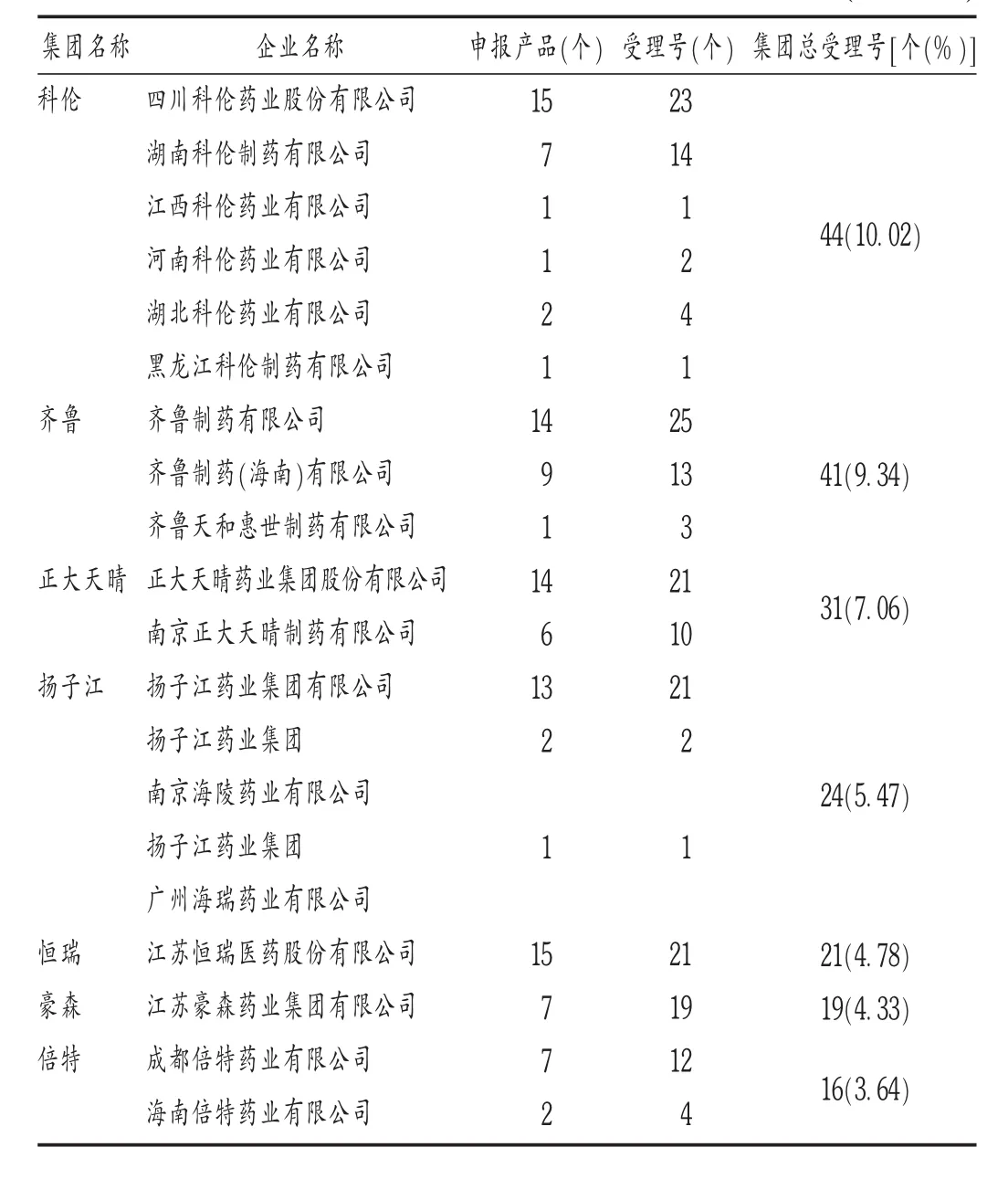
表1 集团排名前7注射剂仿制药一致性评价申报厂家(n=439)
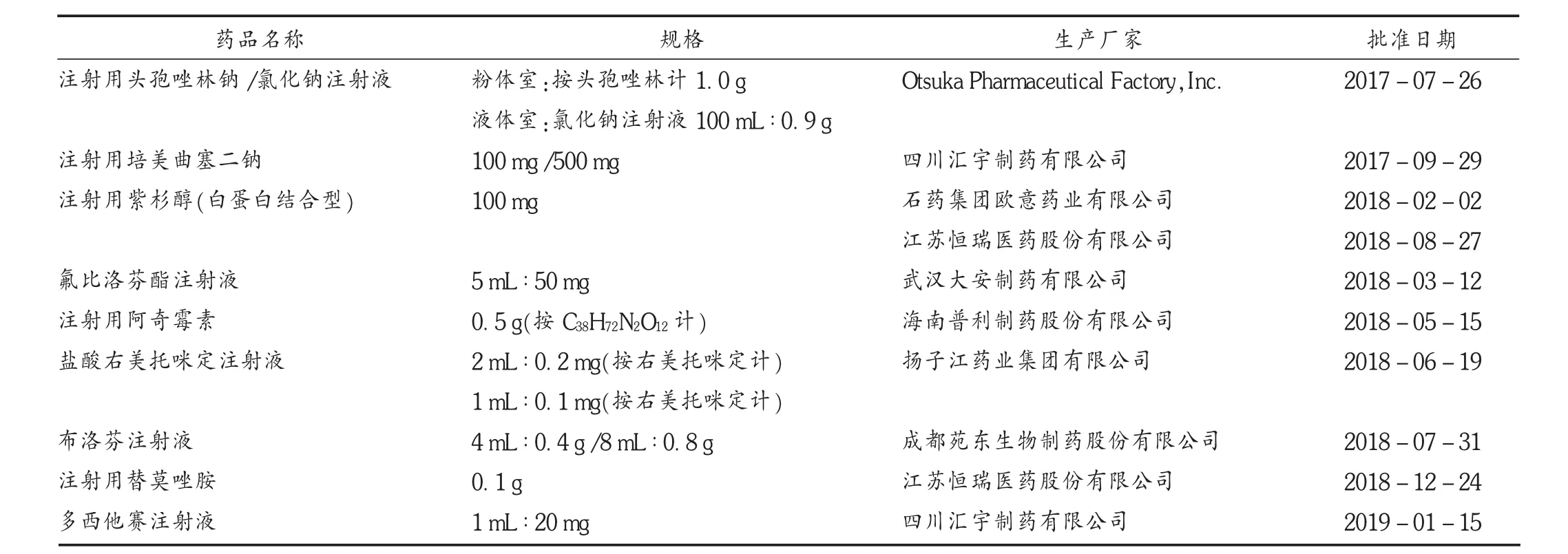
表2 中国上市药品目录集收录的注射剂仿制药
2.2 处方与参比制剂不一致但论述不足
注射剂仿制药中辅料种类和用量通常应与参比制剂相同,抑菌剂、缓冲剂、pH调节剂、抗氧剂、金属离子络合剂若与参比制剂不同,需标注不同之处,阐述其理由,并证明不同之处不影响产品的安全性和有效性[7]。在注射剂仿制药一致性评价中,可能会因参比制剂辅料无法获得而采用不同的处方,那么需重点评估不同之处对产品安全性和有效性的影响;若不存在辅料获得性方面的问题,只因与参比制剂采用相同处方无法达到与参比制剂相同的质量而更换或随意增加辅料将不被接受。另外,也不建议在参比制剂处方的基础上通过增加抗氧剂等处方改变来提高产品质量与稳定性。
对于注射剂中使用的原辅料,不仅要符合《中国药典》等国家标准,还应结合原辅料来源和制备工艺,以及注射剂处方工艺、用法用量等,对可能影响制剂关键质量属性、制备工艺过程甚至安全性的关键原辅料进行合理内控,应特别关注溶液澄清度与颜色、有关物质、元素杂质、毒性杂质、微生物限度、细菌内毒素等检查项目。
2.3 生产工艺研究不充分
2.3.1 生产工艺与生产条件不匹配
根据灭菌工艺的不同,注射剂的生产工艺可分为终端灭菌工艺和非终端灭菌工艺,常见问题为在非终端灭菌工艺生产线生产终端灭菌产品。基于以往的认识,从生产条件来看,在非终端灭菌工艺生产线生产终端灭菌产品,对终端灭菌产品要求更严格,似乎并无不妥;但对该生产线的其他产品而言,由于终端灭菌产品的物料和工艺过程控制相对宽松,将给生产环境和该生产线的非终端灭菌产品的生产带来风险。故应根据产品的工艺和质量要求,配备相应条件的生产环境,并通过对生产环境和条件的控制,确保产品的质量持续符合要求。
2.3.2 商业化规模的生产工艺研究不充分
由于注射剂的高风险性,其商业化生产规模的工艺研究更重要。注册批次须在商业化生产线上生产,若注册批次规模小于商业化生产规模,即使生产线相同,批量的增加也会造成各工序生产时间延长,甚至引起一些关键工艺参数如原辅料溶解时间、过滤过程控制参数、灭菌装载情况等的改变,导致产品杂质或微生物的增加,故应充分评估批量增加对产品质量影响的风险,并以商业化生产规模进行样品生产,确定商业化规模的生产工艺及参数设计空间。
2.3.3 灭菌工艺选择和灭菌验证科学性有待提升
1)无菌保证水平是注射剂仿制药一致性评价的核心内容,应尽一切努力提高无菌保证水平,严格按照灭菌决策树选择灭菌/无菌工艺,不可为了商业目的而降低。通常,通过科学的工艺设计可提高灭菌工艺的无菌保证水平,如氨基酸注射液通过对药液溶解氧和顶空含氧量及灭菌前微生物污染限度的控制,可实现残存概率法终端灭菌工艺,提高无菌保证水平。
2)热原(细菌内毒素)也是直接关系注射剂品种的一项重要质控指标,活性炭作为去除热原的有效手段,曾在我国注射剂的生产中广泛使用,但该工艺有明显的缺点,如活性炭中的可溶性杂质进入药液后无法去除,生产车间洁净区和空调净化系统易被污染,存在引入不溶性微粒、元素杂质的可能性给注射剂的应用带来风险[12],目前已被制药工业发达国家淘汰。为了有效控制热原(细菌内毒素),注射剂的生产需加强对原辅料、直接接触药品的包装材料、生产设备、生产环境等进行控制。
3)灭菌/无菌工艺验证是申报资料中的重要资料,常见问题有未提供充分的资料说明产品不进行热穿透试验的合理性;满载热分布、热穿透试验及微生物挑战试验未使用产品;未分析灭菌前后药液pH变化的原因等。注射剂灭菌工艺或无菌工艺的选择可参照欧盟药品管理局(EMA)最新发布的《药品、活性物质、辅料和内包材灭菌指导原则》[13]并进行充分的灭菌/无菌工艺研究和科学的灭菌/无菌工艺验证。此外,还需重点关注直接接触药品包装材料的除热原验证(包括内毒素挑战、除热原关键参数控制、商业化生产控制措施)、包装系统密封性验证、保持时间(含化学和微生物)验证等。
2.4 无法保证产品质量与参比制剂一致
对于某些注射剂产品,在一致性评价工作开展过程中,与参比制剂进行质量对比后发现,自制仿制药的质量确实无法与参比制剂达到一致,较常见的有头孢菌素类产品,表现为杂质水平比参比制剂高,澄清度与溶液颜色差于参比制剂等。其解决措施可能需要进一步提升原料药的质量,如对注射用头孢曲松钠进行一致性评价时,应以原料的结晶工艺及工艺控制为切入点,再以产品湿品的头孢曲松含量和水分含量为指标对工艺进行优化,保证生产过程的一致性[14];或深入研究辅料不同型号、不同晶型的影响,充分进行药物与包材的相容性研究,如胶塞的材质和型号选择等。
2.5 配伍稳定性与临床使用结合不足
注射用无菌粉末需用适宜的注射用溶剂配制后使用,以及注射用浓溶液需要在临床使用前采用适宜稀释剂稀释后使用,因配制后的药液可能无法立即使用,静脉滴注需一定时间,故需进行使用过程中的配伍稳定性研究。该研究内容是当前注射剂仿制药一致性评价中的难点之一。注射剂的配伍稳定性研究应按药品说明书的临床使用方法设计,通过合理的风险评估结合试验研究数据支撑临床的合理使用,包括不同的配伍溶剂和配伍浓度。对于稳定性差的产品,临床配伍稳定性研究应至少包括2批自制样品(建议其中1批为近效期样品)[7]。此外,还需开展使用药液与不同材质输液用器具的相容性,必要时在药品说明书中指定输液用器具。同时,进行配伍稳定性研究时要关注检测方法的准确性和对特定杂质的检测,如葡萄糖注射液的配伍研究应关注杂质5-羟基糠醛等。2.6 特殊安全性研究重视不足
注射剂应开展过敏性、溶血性和局部刺激性等特殊安全性试验。对于开展一致性评价的注射剂,有的产品在最初注册申报时已开展过特殊安全性试验,但药物的原形及其代谢物、辅料、有关物质及理化性质(如pH、渗透压等)均有可能引起刺激性和/或过敏性和/或溶血性等安全问题的发生[15],故若在一致性评价研究过程中发生了处方或工艺变更,需重新开展特殊安全性试验。通过对比自制仿制药与参比制剂特殊安全性试验的差异,有助于发现自制仿制药药学研究方面的问题,如处方组成、辅料用量、杂质限度等,以进一步加强药学质量控制[16]。
3 讨论
3.1 注射剂仿制药一致性评价的重大意义
我国仿制药市场中,化学药品注射剂所占份额高,对群众健康影响大。自2017年以来,我国所进行的仿制药一致性评价主要针对固体制剂,而注射剂仿制药一致性评价对整个行业和制药企业都有较大影响。化学药品新注册分类实施前批准上市的注射剂,未严格要求仿制药与原研药品质量和疗效一致,存在参比制剂选择不当、灭菌条件选择不合理、原辅料的质量要求较低、包材选择和相容性研究不全面、注射剂的质量和参比制剂存在差异、质量标准需要提高等问题,这些均需要改进和提高。注射剂一致性评价的技术要求现已逐渐与国际接轨,开展注射剂仿制药一致性评价工作,可明显提高国内制药企业的工艺水平和仿制药品质量,更好地提升我国制药行业整体水平,保障公众用药安全有效,增强国际竞争力,更有利于健康中国战略目标的实现。
3.2 注射剂仿制药的质量控制应科学合理
注射剂仿制药一致性评价技术要求总体上与仿制药现行审评技术要求一致,即仿制药应与原研药品的质量和疗效一致。“质量源于设计”的科学研发理念支撑仿制药的研发和一致性评价,通过制订合理的控制策略,确保仿制药实现与原研药品质量和疗效的一致性。随着仿制药“4+7带量采购”“全国集采”政策的推行,仿制药的成本控制成为企业的主要竞争力。故运用风险评估手段,对仿制药进行科学合理的质量研究和控制,而非仅仅过度提升产品质量标准,过度研究和过度提升质量都将造成成本过高,降低市场竞争力。
3.3 注射剂未来发展趋势
注射剂因其给药特点,各国药品监管部门均将注射剂视为风险程度最高的品种。一致性评价将全面提升我国仿制药的质量,保证与原研药品质量和疗效的一致。开展注射剂仿制药一致性评价,将会建立和健全注射剂仿制研发的风险质控体系,全面提升我国注射剂仿制药的质量水平,增强企业的国际竞争力。通过对注射剂仿制药一致性评价的严格要求,已通过一致性评价的产品将可替代原研药品在临床的使用。由2018年至2019年的注射剂仿制药一致性评价申报情况可见,未来注射剂的产业集中度将大幅提升,国内市场有可能被较大的几个制药集团占据。而随着一致性评价后产品质量的提升,国内企业参与国外市场竞争的能力也将显著增加。
