夯实拓展巧应变 积累活用善探究(二)
——回顾“自招”应考“强基”
2020-06-17浙江绍兴鲁迅中学张向东特级教师
■浙江绍兴鲁迅中学 张向东(特级教师)
例5甜蜜素(化学名称为环己基氨基磺酸钠,结构式为是食品生产中常用的一种添加剂,虽然其甜度是蔗糖的30~40 倍,但是无营养的,且过量时是有毒的(它在肠菌作用下,会分解产生环己胺而导致人慢性中毒)。它的制法较多,其中常用的三种方法分别是:①先由环己胺与氨基磺酸NH2SO3H 反应,产物再与氢氧化钠作用;②环己胺与氨基磺酸钠直接作用;③苯基氨基磺酸钠与H2加成,条件是钌作催化剂,温度低于60℃。请回答下列问题:
(1)第一种方法,原料之一氨基磺酸有多种制法,常用的有两种:一是制取少量时,,此时要求两种气体必须是高纯度且完全____。二是制取较多量时,用“发烟硫酸”与尿素在75~80℃条件下反应。①该反应的化学方程式为____,____。②粗产品经_____(填操作名称)得纯产品;该产品不宜用水,而用10% ~12% 的____酸作溶剂。③常用_____漏斗,进行____(填操作名称)过滤。④洗涤时,先用纯____(写分子式),后用50%的硫酸,再用冷的甲醇。⑤“发烟硫酸”法,通常用SO3的质量百分含量来表示其组成。将0.1185g“发烟硫酸”试样溶于水,用0.125mol·L-1的NaOH标准液滴定,若用去该标准液20.00mL恰好中和,则试样中SO3的质量百分含量是____。试样通常盛于_____瓶中,移取时,常用到____(填序号)。
A.移液管B.量筒C.洗耳球D.容量瓶
(2)第二种方法,生成物中还有____(气体)产生。
(3)第三种方法,由于____价格昂贵,而导致其生产成本较高。
参考答案:(1)无水 ①CO(NH2)2+②重结晶 硫 ③砂芯 减压 ④H2SO4⑤15.00% 锥形 AC(2)NH3(3)催化剂钌
精准突破及关键点:一是环己基氨基磺酸钠、NH2CONHSO3H、NH2SO3H 等的转化、衍变。二是制法的有关要求、操作和所用仪器等,如两种气体必须是高纯度且完全无水、钌是昂贵的金属、减压过滤用砂芯漏斗,以及滴定操作移取试样时常用到移液管、洗耳球等。三是“发烟硫酸”及其SO3的质量百分含量的测定和计算,要抓住物质的量的关系进行运算。
例62019年诺贝尔化学奖颁给了三位科学家(其中一位已97岁高龄),以表彰他们在锂离子电池领域的突出贡献。锂离子电池的电解质有时用LiPF6溶于碳酸丙烯酯等,请回答下列问题:
(1)用LiPF6溶于碳酸丙烯脂时不能有水分,因为LiPF6与水会发生反应_____。
(2)碳酸丙烯酯的键线式是____,它常用1,2-丙二醇与光气来合成,但光气剧毒且产生的HCl对设备有腐蚀作用。现常采用1,2-丙二醇与CO2或____(写名称)来合成。也可以用环氧丙烷与_____(写结构式)通过_____(写反应类型)环合或酯交换等方法来合成。
参考答案:(1)+2HF(2)
精准突破及关键点:(1)LiPF6遇水会水解。(2)1,2-丙二醇与CO2或尿素是通过脱水、脱氨环合的,环氧丙烷与CO2是通过加成环合的。
例7已知反应Cl2,试回答下列问题:
(1)将稀氨水滴入硝酸银溶液中,先生成白色沉淀,马上转化为亮棕色沉淀A,A 与HF作用生成B和水。
①将B的水溶液在低电流密度时电解,可制取与B 具有相同元素组成的D,B 电解生成D 等的化学方程式是____。
②D 晶体的结构示意图如图2所示,则其中含有的化学键是_____(填序号)。
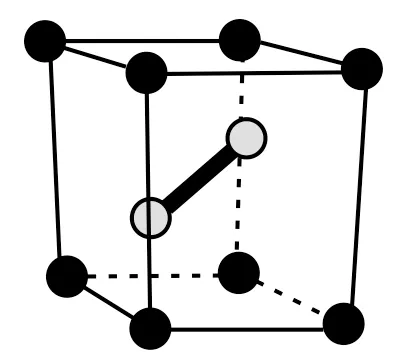
图2
a.金属键 b.共价键
c.离子键 d.范德华力
③D 在乙醇或B 溶液中稳定,但遇水则生成黑色颗粒、HF和_____(写分子式)。
④D 的另一种制法是用紫外光照射B,其化学方程式是_____。
(2)若F-中混有Cl-,则宜用____(写名称)溶液除去Cl-。
参考答案:(1)①4Ag2F↓+O2↑+4HF ②ac ③O2④(2)氟化银
精准突破及关键点:一是D(Ag2F)的晶体结构,F-个数为个银在体心,化学式为Ag2F(与AgF 的水溶液电解产物分析一致),其中为金属键,AgF 中存在离子键(Ag2F的导电性介于Ag与AgF之间)。二是电解AgF 的不同产物,Ag2O+,由于电解AgF 时,阳极是水失电子产生O2↑+4HF),则阴极Ag+必得电子,生成价的银即D(D的元素组成与B的相同),发生反应。进而推断出总反应。三是银元素的不同价态及银的不同氟化物。。要用AgF 除去F-中混有的Cl-,而不能用AgNO3,否则引入阴离子杂质。四是反应。
例8含4个碳原子的石油裂化产品之一为A,其涉及的有关转化如图3所示。已知:Ⅰ.在高温时,氯气与丙酸反应,主要生成2-氯丙酸;Ⅱ.E 为含氯有机物。试回答下列问题:
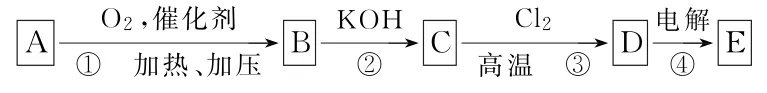
图3
(1)④的阳极产物是CO2和____(写结构简式),其中阴极产物是_____(写名称)。
(2)对于E 来说,若在KOH 的水溶液中并加热条件下,则生成_____(写名称),后者控制氧化可生成具有不成熟水果味的药物中间体____(写结构简式);若在KOH 的乙醇溶液中并加热条件下,则生成____(写名称),甚至乙炔,其键角是____。
(3)转化④中阳极气体产物与A 进一步分解得到的某一气体产物,在一定条件下可绿色合成B,则常温、常压下其Kp=____;也可用CO 与____(写名称)在一定条件下绿色合成B,涉及的化学方程式有____,___。
参考答案:(1)ClCH2CH2Cl 氢氧化钾、氢气(2)乙二醇 OHCCOOH 氯乙烯 180°(3)(l)(l)(均在一定条件下)
精准突破及关键点:一是一氯乙酸钾电解的方程式及两极产物,2ClCH2COOK+H2↑。二是ClCH2CH2Cl的水解反应与消去反应的区别(溶剂不同,脱去一个甚至两个“HCl”)。三是用三种不同的方法制取CH3COOH 的比较[丁烷在一定条件下直接氧化法,即4CH3COOH(l)+2H2O(l);甲烷与CO2、CO与甲醇在不同条件下的绿色(100%)合成]。四是乙二醇在不同条件下氧化或分步氧化,可以生成乙二醛、乙醛酸(具有不成熟水果味的药物中间体)、乙二酸等。
例9农副产品如玉米芯、稻糠、花生壳、大麦壳、高粱秆等用热盐酸处理后,先生成戊糖,然后失水环化得到糠醛,再在催化剂(ZnO、Cr2O3)存在下加热至400 ℃,转化成呋喃,流程如图4所示,试回答下列问题:

图4
(1)糠醛的官能团有碳碳双键、醛基、____(写名称)。
(2)糠醛转化成呋喃即脱去了_____(写分子式)。
(3)糠醛与苯酚在一定条件下发生缩聚反应,合成酚醛树脂,该反应的化学方程式为____。
(4)以Al2O3为催化剂,可使五元环重要有机化工原料或药物中间体——呋喃、吡咯(含N)和噻吩(含S)的环系互变,如图5所示。

图5
①噻吩的分子式是_____。
②呋喃转变为吡咯的化学方程式为____,吡咯中N 原子是____杂化。
③写出甲基吡咯的同分异构体(保持吡咯环不变):___。
参考答案:(1)醚键(2)CO(3)(4)①C4H4S ②SP2③、、(5)
精准突破及关键点:(1)糠醛环中还有氧原子,即醚键。(2)糠醛与呋喃的结构、组成(糠醛侧链中脱去了CO)。(3)模仿甲醛与苯酚的缩聚,可知糠醛侧链中的氧与苯酚中的邻位的两个H 结合成H2O,其余部分结合成高聚物。(4)①C显+4价,S 显-2 价,分子式为C4H4S。②呋喃转变为吡咯时,其中的O 与NH3中的两个H 结合成H2O,因N 常为+3价,N 上连有一个H 和两个C,有一个末成对电子与其他四个C形成大π键,即发生等性的SP2杂化,而非SP3杂化。③吡咯环上有三种不同化学环境的H,故甲基吡咯的同分异构体(保持吡咯环不变)有三种。(5)先运用已知a推导出1,5-己二烯与2molHCl作用生成2,5-二氯己烷,再水解生成2,5-己二醇,后催化氧化(脱H)生成2,5-己二酮。再根据已知b推导出在一定条件下(无水、酸性),2,5-己二酮脱水生成2,5-二甲基呋喃,后与氨反应生成2,5-二甲基吡咯。
例10已知:Ⅰ.X 为二元化合物,其中常见金属元素(M)与常见非金属元素(R)的质量比约为16∶1。Ⅱ.MCl2溶液常呈浅绿色,M为常见金属。Ⅲ.Z有多种制法:等。有关X的制取流程如图6所示。
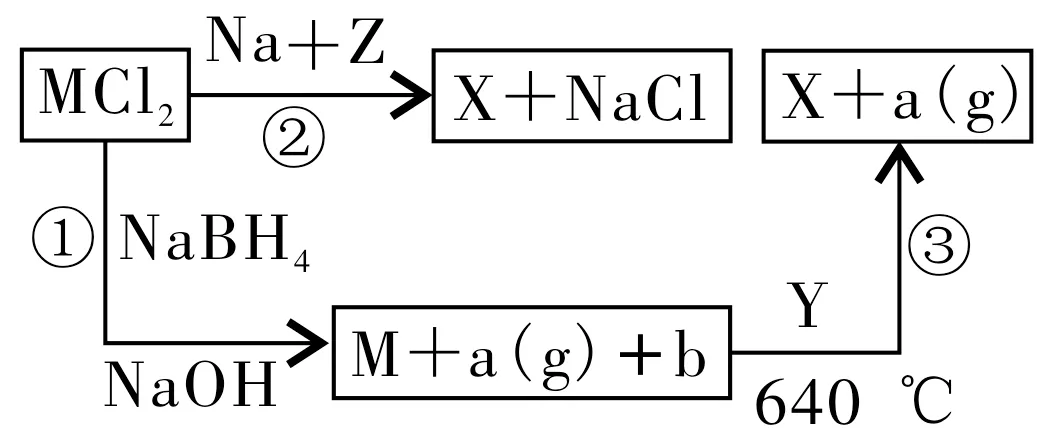
图6
(1)反应①的另一产物b是_____(写离子符号),Z的化学式是_____。
(2)反应②的化学方程式为_____,其中得失电子的数目为_____e-。
(3)从结构上分析CH3ORO 可用_____(写名称)代替。
(4)X 的制取也可用MCl3与A(由两个与两个组成)在一定条件下反应制取,试写出A 的常见结构简式:___。中的
(5)检测常用HRO2,其原理是_____。
参考答案:(1)(2)24NaCl 23(3)硝基甲烷(4)见图7。
精准突破及关键点:根据MCl2溶液常呈浅绿色,M 为常见金属,以及后面的转化,可推断出M 为Fe,Z为NaN3,R 为N,X 为Fe4N(Fe与N 的质量比约为16∶1,氮呈-3 价,铁可看成价)。涉及的几个反应有2NaNH2+N2O3Fe4N+24NaCl。Y 为氨,640℃时发生反应。A 为双氰胺,FeCl3与A 作用也可生成X(反应复杂)。与HNO2反应生成氮气(和α-羟基羧酸),通过氮气的体积来确定,反应方程式为
