21例性发育异常临床诊治分析
2020-06-16赵秋仪和秀魁罗喜平邓群娣李海萍
赵秋仪,和秀魁,罗喜平,邓群娣,李海萍,何 裕
(1.广州医科大学;2.广州医科大学附属广东省妇幼保健院,广东 广州 511436)
性发育异常又称性分化异常,是指一类性染色体、性腺或性激素的性别表现不典型的先天性异常[1]。而广义上DSD可定义为染色体、性腺、表型、性心理的不一致[2]。DSD临床发病率大概为1/(4500-5000),较为罕见疾病[3]。目前,DSD病因仍然不是十分清楚,有着各种临床特征和表现方式,给临床医生诊断带来巨大挑战。本文收集了2013年1月至2019年8月本院妇科、小儿外科收治DSD共21例,对其进行回顾性分析,以进一步提高对DSD认识和临床诊治。
1 资料与方法
1.1 一般资料
收集2013年1月至2019年8月在我院妇科、小儿外科住院治疗21例DSD患者。首次就诊年龄2~33岁,平均(15.0±10.3)岁。入院前社会性别为女性17例(81.0%),男性4例(19.0%)。XO/XY性腺发育不全2例,真两性畸形2例,克氏综合征1例, XY单纯性腺发育不全3例,先天性肾上腺皮质增生(congenital adrenal cortical hyperplasia,CAH)6例,完全型雄激素不敏感综合征(complete androgen insensitivity syndrome,CAIS)7例。
1.2 方法
回顾归纳、总结患者的临床资料,包括年龄、社会性别、主诉、现病史、既往史、母亲妊娠期服药史、家族史、专科检查、辅助检查、手术情况、术后病理结果。
1.3 统计处理

2 结果
2.1 入院情况
21例DSD患者主诉如下:青春期后无月经来潮13例(61.9%),其中伴有周期性下腹胀痛2例,分别为XY单纯性腺发育不全、CAH患者。外生殖器发育异常就诊8例(38.1%)。1例XO/XY性腺发育不全患者为双胞胎之一,另一双胞胎为男性。3例CAIS患者诉姨妈无月经来潮,无子嗣,其中2例患者妹妹青春期后无月经来潮。余无特殊,母亲均无妊娠期服药史。
2.2 第二性征及外生殖器
17例女性患者(4例为青春期前儿童未纳入)乳房发育:无明显发育、Ⅰ级、Ⅱ级、Ⅳ级均分别2例(分别占15.4%),Ⅴ级5例(38.5%);腋毛发育:无腋毛9例(69.2%),腋毛正常2例(15.4%),未查2例。阴毛发育:无阴毛6例(46.1%),阴毛稀疏3例(23.1%),阴毛女性分布4例(30.8%)。1例青春期前阴毛浓密。外生殖器发育大部分为幼稚型外阴,少数病例伴有阴蒂肥大或者短小的类阴茎体。1例女性患者尿道口不明显,未见阴道口。肛查中13例有结果,大多数提示盆腔空虚;1例可扪及盆腔实性包块,大小约8×7 cm;2例可扪子宫。
4例男性患者外生殖器发育差,可见类阴茎体及阴囊袋,阴茎不同程度下弯,伴阴囊空虚或单侧阴囊可扪及类睾丸组织。3例患者尿道开口均异常,位置分别位于龟头近冠状沟、阴茎阴囊交界处、阴茎根部。1例男型患者双侧睾丸发育偏小。(见表1)
2.3 辅助检查
2.3.1染色体检查 染色体结果可见表1。2例XO/XY性腺发育不全SRY基因均阳性,其中1例Y染色体上AFa、A2Fb区域存在,AZFc区缺失。CAH中有2例基因检测提示CYP21A2复合型基因突变。
2.3.2激素及影像学检查 X0/XY性腺发育不全患者促性腺激素水平升高,黄体生成素平均(43.8±27.6)IU/L、卵泡刺激素平均(11.6±7.7)IU/L,雌二醇和睾酮水平降低。妇科超声均未见明显子宫回声。真两性畸形中1例超声提示一侧腹股沟型隐睾声像,1例盆腔CT提示膀胱后方梭形囊性肿物,右侧阴囊内见一睾丸影。XY性腺发育不全患者呈高促性腺激素性腺功能减退,大部分雌二醇及睾酮处于低水平。黄体生成素平均(76.7±12.5)IU/L、卵泡刺激素平均(24.3±6.0)IU/L,雌激素平均(47.8±13.6)nmol/L,睾酮平均(2.2±2.1nmol/L)nmol/L。妇科超声见始基子宫、幼稚子宫,均未见明显卵巢组织,其中2例见一侧盆腔实性占位,大小分别为32×31 cm、79×78 cm。性激素异常患者伴不同程度雄激素水平升高。其中CAH患者睾酮平均(6.1±3.7)nmol/L,雄烯二酮(31.2±5.4)nmol/L,3例血清17-α羟孕酮平均为(205.3±114.9) nmol/L。7例CAIS患者睾酮平均(20.0±7.8)nmol/L。部分CAH患者影像学提示双侧肾上腺增大,CAIS患者MRI盆腔均未见子宫声像,部分患者腹股沟区、髂窝区见睾丸声像。
2.4 治疗情况
21例患者中11例均行“腹腔镜下双侧性腺切除术”,术中大部分患者未见子宫及双侧附件,性腺多为条索状性腺或者睾丸样组织。部分患者术中已发现有生殖细胞肿瘤。XY单纯性腺发育不全均伴有生殖细胞肿瘤,其中1例术后诊断为卵巢无性细胞瘤IIIC期,予PVB方案化疗。另外1例术后诊断右侧性腺母细胞瘤IA期,予BVP方案化疗。3例CAIS术后病理提示性腺肿瘤组织。上述11例患者术后予人工周期或补佳乐治疗。21例患者中2例行“腹腔镜探查术+性腺活检术”,均为真两性畸形患者,术中一侧见卵巢样组织,另一侧见睾丸样组织,术后均按男性抚养。其中1例两性畸形患者间隔3年行“尿道下裂一期成形术+腹腔镜下左侧性腺切除术+右侧性腺下降术”。1例CAIS患者外院已行双侧隐睾切除术,因术后性生活不满意行“腹腔镜下乙状结肠代阴道成形术中转开腹手术”,术前阴道深约4 cm,术后约12 cm。5例行“阴蒂形成术”,均为先天性肾上腺皮质增生患者,期间予口服氢化可的松治疗。具体见表2。
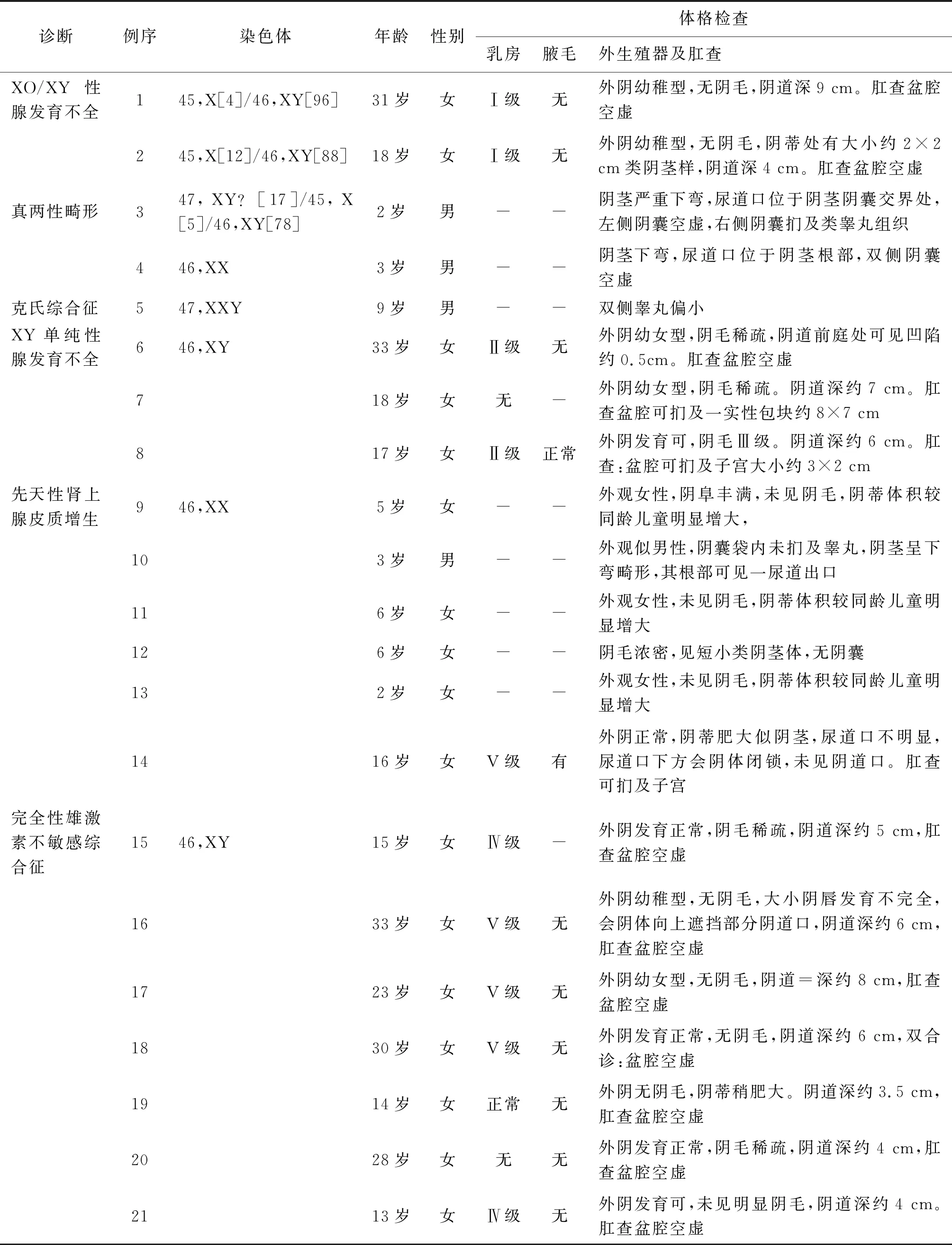
表1 21例DSD临床表现

表2 手术所见及术后病理
3 讨论
正常的性分化发育是一个有序而复杂的过程,在这过程中性染色体、性腺和性激素异常将导致性发育异常发生。目前国外将DSD分为三大类,分别是染色体异常型DSD、46,XY型DSD、46XX型DSD。国内大多数使用北京协和医院葛秦生教授提出的分类法,根据性发育过程中三个最关键的环节按病因分为性染色体异常、性腺发育异常和性激素异常三大类[4]。本文21例DSD患者中性染色体异常有5例、性腺发育异常3例、性激素异常13例。DSD患者首次就诊年龄差异较大,本文20例患者首次就诊年龄在2岁-33岁。真两性畸形、CAH等患者可能会在出生后不久由于外生殖器异常而就诊。而单纯性性腺发育不全或者CAIS患者由于外生殖器呈女型表现,多数因青春期后无月经来潮就诊,在这种情况下,有可能直到20岁、30岁才确诊DSD。因此,患者就诊时间与其临床表现、外生殖器异常有关。此外,患者就诊意识缺乏也会到时诊疗时间推迟。
DSD的的临床表型具有高度异质性,病因和临床表现没有截然的对应关系[5]。本文中12例以青春期无月经来潮而就诊患者有不一样病因,以完全性雄激素不敏感综合征为主,其次为XY性腺发育不全。患者因胚胎时期未受雌激素影响外生殖器为女性表现,但发育幼稚,有不同程度的乳房发育,大多数患者无腋毛阴毛,少部分阴毛稀疏。对于原发性闭经患者需与MRKH综合征、阴道闭锁等生殖道畸形,下丘脑、垂体性疾病,卵巢疾病等相鉴别,此类患者性染色体为正常。本文中2例X0/XY性腺发育不全患者46,XY核型细胞系计数较高,其外生殖器都呈幼女型,内生殖器均见条索状性腺组织,SRY基因均阳性,其中1例Y染色体上AZFc区缺失。多数研究认为X0/XY性腺发育不全表型与外周血中核型不同的两个细胞系所占的比例无关,甚至与性腺中两种细胞系的比例也无明显关系,而AZF大片段的缺失可能导致Y染色体不稳定,从而导致Y染色体丢失[6],未形成正常性腺而表现为原始条索状状,导致外生殖器呈幼女型。外生殖器发育异常或者模糊的患者在胚胎期受不同程度雄激素影响,出生时有不同程度男性化。先天性肾上腺皮质增生是新生儿阶段导致外阴性别模糊最常见的原因,发病率为1/5000[2]。本文5例就诊时表现为不同程度男性化,有阴蒂异常肥大、小阴茎或者异常尿道开口。而2例真两性畸形患者均为发育不良男性外生殖器,其尿道开口异常,内生殖器多样,无子宫,或者有幼稚子宫、输卵管,卵巢睾丸均存在。有文献报道真两性畸形最常见的性腺是卵睾丸,而睾丸通常位于右侧,卵巢位于左侧[7]。因此,DSD临床表现显著差异,主要为内外生殖器发育异常、第二性征发育异常以及性腺功能异常的伴随症状,部分患者随着年龄增加,出现进行性男性化体征而就诊[8]。
DSD患者体格检查有助于早期诊断,重点检查外生殖器及内分泌疾病的特殊体征。对于青春期后第二性征未发育、发育延迟,女性男性化、外生殖器模糊、小阴茎、女性阴蒂肥大、尿道下裂、隐睾的患者,应进一步行实验室检查(性激素检查、肾上腺轴功能评估、GnRH或HCG激发试验、类固醇激素等)、超声、MRI、染色体核型及基因学检测来明确诊断。
DSD患者治疗包括性别决定后外生殖器整形、内分泌治疗、性腺处理及心理治理等。性发育异常中国专家共识中提出性别决定是DSD患者治疗中的最重要一环,只有决定性别后才能进行相应的外生殖器整形,并且性别决定需要多学科诊疗团队、家长和/患者本人共同参与和讨论[2]。本文中有5例CAH确定性别为女性后均行阴蒂形成术,切除肥大阴蒂或短类小阴茎。对于外生殖器整形手术具体时机仍存在争议,无明确共识[9],而本文手术平均年龄4.4岁。一旦确定了患儿的认定性别,可以择期行手术治疗矫正生殖器畸形[2]。外生殖器整形最终目的是恢复生殖器功能,并且预防性别焦虑和性别冲突给患者所带来的心理问题,更好融入社会。
目前DSD患者性腺切除指征如下:早期生殖细胞癌、性腺分泌的激素对选择的性别有相反作用(如完全性雄激素不敏感综合征)、随访依从性差、位置异常睾丸或存在Y 染色体物质的条索状性腺[2]。有文献报道性腺恶变发生率,45,X/46,XY性腺发育不全为10-20%,雄激素不敏感综合征为6-9%,XY单纯性腺发育不全为30-60%,是最容易恶变病种[5],并且随着年龄增加风险增加,30岁时恶变风险约为30%[10],若合并Wilms’肿瘤抑制基因(Wilms’tumor suppressor gene,WT1)突变的46,XY性腺发育患者性腺肿瘤发生率可达40%-60%[11]。本文11例行腹腔镜下双侧性腺切除术患者中有5例已发生生殖细胞肿瘤,年龄在15-33岁,平均年龄27.2岁。其中2例XY单纯性腺发育不全分别为无性细胞瘤、性腺母细胞瘤,术后均需补充化疗。3例CAIS术后病理可见肿瘤细胞。对于选择女性的患者其睾丸或者条索状性腺应该切除避免性腺肿瘤发生,但切除时间仍存争议,大多数建议确诊后尽早行性腺切除。完全型雄激素受体不敏感者的性腺恶变风险极低,在青春期后延迟切除此类患儿性腺的观点已经被广泛接受[2],以便女性的第二性征更好的发育。真两性畸形发育不全睾丸发生恶性肿瘤较为少见,46,XX的肿瘤发生率为4%,46,XY肿瘤发生率为10%,手术时可保留与社会性别相同的正常性腺[12]。在性别决定及性腺处理后DSD患者需行内分泌治疗,其目的是维护男女性器官发育,第二性征发育及骨骼生长,改善并维持其基本的生理功能,从而促进患者心理健康。对于男性DSD患者有小阴茎、部分性完全性雄激素不敏感综合征等可补充雄激素。由于雌激素合成不足、性腺发育不良或性腺切除术而缺乏内源性雌激素的DSD女性可补充雌激素[13]。本文11例在腹腔镜下双侧性腺切除的患者术后有子宫均行人工周期治疗,而无子宫予补佳乐维持女性第二性征。
综上,性发育异常病因及发病机制复杂,临床表现及体征高异质性,诊断及治疗上需要多学科团队协作解决患者的实际医疗需要以及相关社会心理问题[13]。DSD早发现早诊断对于决定性别后外生殖整形治疗及性腺处理有着重要意义,对于预防患者日后生理功能损害及心理伤害有重要价值。
