霍山石斛多糖理化性质与生物活性的年动态变化研究
2020-06-16秦丹阳尚贞子钱明雪李强明罗建平
秦丹阳,尚贞子,钱明雪,李强明,罗建平
(合肥工业大学食品与生物工程学院,安徽合肥 230009)
霍山石斛(DendrobiumhuoshanenseC. Z. Tang et S. J. Cheng)又称米斛,为兰科石斛属多年生草本植物,主产于安徽大别山地区,其药用、食用历史悠久,《神农本草经》记载其“久服厚肠胃”[1-2]。霍山石斛含有多糖、氨基酸、维生素、蛋白质、类黄酮、石斛酚、生物碱等多种成分,其中多糖是霍山石斛的主要活性成分,具有抗氧化、抗肿瘤、降血糖、保肝护胃、增强免疫等功效[3-7]。作为食品原料[8],霍山石斛的不同采收期将严重影响原料的品质,进而影响基于霍山石斛活性成分的功能性食品的开发与生产。丁亚平等[9]曾对不同生长年限霍山石斛茎的生物量及矿物质、游离氨基酸、多糖、生物碱含量进行了测定,但关于霍山石斛营养成分特别是活性成分理化性质与生物活性的年变化情况迄今尚不清楚,因而霍山石斛在用于功能性食品原料时的采收时间确定缺乏数据支撑。
本研究将以霍山石斛多糖为对象,分析其理化性质、免疫调节活性及抗食管癌活性的年动态变化规律,以期为霍山石斛功能性食品开发与生产确定霍山石斛原料的适合采收期提供科学依据。
1 材料与方法
1.1 材料与仪器
霍山石斛 自2017年4月至2018年3月,每月中旬采摘1 kg三年生霍山石斛植株,采摘地为霍山县天下泽雨生物科技发展有限公司霍山石斛种植基地;SPF级昆明小鼠(6~8周,20±2 g) 安徽医科大学实验动物中心,实验动物生产许可证号:SCXK(皖)2017-001;人食道癌EC-109细胞 中国科学院细胞库;葡聚糖标品 美国Sigma公司;胎牛血清、青霉素链霉素 美国GIBCO公司;RPMI-1640培养基 美国Thermo Fisher公司;Alamar Blue 试剂盒 上海贝博生物试剂公司;α-淀粉酶 上海阿拉丁试剂有限公司;三氟乙酸 上海医药化学试剂有限公司;其余试剂 均为分析纯,购买于国药集团化学试剂有限公司。
DGF30/7-I电热鼓风干燥箱 南京实验仪器厂;V1100可见光分光光度计 上海美谱达仪器有限公司;CT15RT高速冷冻离心机 上海天美科学仪器有限公司;MDF-U73V超低温冰箱、MLS-3750高压灭菌锅 日本SANYO公司;SW-CJ-1FD超净工作台 苏州净化设备有限公司;XSZ-3G普通光学显微镜 重庆光电仪器有限公司;1260 Infinity高效液相色谱仪 美国安捷伦科技有限公司;Nicolet 67傅里叶红外光谱仪 美国Thermo Nicolet公司;Varioskan Flash全波长酶标仪 美国Thermo Fisher公司;TU-1901紫外可见分光光度计 北京谱析通用仪器有限责任公司;LGJ-18S原位真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 霍山石斛多糖的提取及含量测定 霍山石斛茎于60 ℃下烘干至恒重后粉碎过80目筛,保存备用。称取适量霍山石斛茎粉末,按1∶20 g/mL的料液比加入无水乙醇,室温下搅拌浸提4 h,抽滤,分离滤渣和滤液。滤渣重复浸提4次,风干后,按1∶40 g/mL的料液比加入蒸馏水,于70 ℃下搅拌提取1 h,用医用脱脂纱布过滤,滤渣重复提取3次,合并滤液。向滤液中加入α-淀粉酶(30 U/g无水乙醇浸提后的滤渣),60 ℃下水浴搅拌酶解1 h,酶解液经60 ℃减压浓缩后离心(10000×g,15 min),收集上清。上清液用终浓度为80%的乙醇进行醇沉,4 ℃下静置24 h后过滤收集沉淀,沉淀加水复溶后离心(10000×g,15 min),取上清液再次醇沉,沉淀经过滤、复溶、离心后真空冷冻干燥(-50 ℃,20 Pa,48 h)得霍山石斛多糖[10]。利用苯酚硫酸法[11],根据葡萄糖标准溶液(浓度为0.00、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL)所绘制的标准曲线方程y=0.0804x+0.0015(R2=0.9992)求得不同月份霍山石斛的多糖含量。
1.2.2 霍山石斛多糖理化性质测定
1.2.2.1 红外光谱扫描 称取2.0 mg左右的霍山石斛多糖经充分干燥后,加入少许干燥的KBr粉末混合研磨,压成薄片,置于傅里叶红外光谱扫描仪上进行4000~500 cm-1范围内的扫描分析。
1.2.2.2 分子量测定 采用高效凝胶渗透色谱法[12]测定多糖的分子量。测试分析条件为:Agilent 1260 Infinity系统,TSK G5000 PWxl(7.8×300 mm)色谱柱;流动相:双蒸水;流速:0.5 mL/min;进样量:20 μL;柱温:30 ℃;示差折光检测器检测,检测器温度:30 ℃。霍山石斛多糖样品浓度为1 mg/mL,经0.22 μm滤膜过滤。多糖的相对分子质量Mw根据系列葡聚糖标准品(分子量分别为5.0×103、2.5×104、8.0×104、1.5×105、4.2×105、6.7×105Da,浓度1.0 mg/mL)所绘制的标准曲线y=-0.3122x+10.39(R2=0.9976)求得。
1.2.2.3 特性黏度测定 利用乌氏黏度计测定并计算[13]多糖样品(1 mg/mL)相对于蒸馏水的特性黏度。
1.2.2.4 乙酰基含量测定 按Hestrin[14]的方法,将强碱条件下游离出来的乙酰基与羟胺反应生成乙酰肟羟酸,再与Fe3+生成可溶性红色络合物羟肟酸铁,该红色络合物在550 nm处有一定的吸收,采用分光光度法进行测定(标准曲线为y=0.629x+0.0003,R2=0.9995)。
1.2.2.5 单糖组成及摩尔比测定 根据《中华人民共和国药典》2015版中对铁皮石斛项下的规定检测霍山石斛多糖中甘露糖和葡萄糖的摩尔比[15]。糖液(1 mg/mL)用3.0 mol/L的盐酸溶液于110 ℃下水解1 h,用0.5 mol/L的1-苯基-3-甲基-5-比唑啉酮(1-phenyl-3-methyl-5-pyrazalone,PMP)甲醇溶液于70 ℃下衍生化100 min。取上清液注入液相色谱仪进行检测。色谱条件:填充剂为十八烷基硅烷键合硅胶,流动相为乙腈-0.02 mol/L乙酸铵溶液(20∶80,V/V);检测波长为250 nm。
1.2.3 霍山石斛多糖生物活性测定
1.2.3.1 肠黏膜免疫调节活性测定 参照Hong等[16]的方法,将6~8周的昆明小鼠处死,取出小肠,解剖出Peyer’s结并浸于冷的完全培养液(RPMI 1640培养基含1%双抗和5%胎牛血清)中。轻轻研磨Peyer’s结并经200目纱布过滤得到细胞悬液,用台盼蓝染色活细胞计数法调整细胞浓度至2×106cell/mL。向96孔细胞培养板中每孔加入180 μL细胞悬液及20 μL不同月份的霍山石斛多糖溶液(终浓度为50 μg/mL)。将96孔板置于5% CO2、37 ℃的CO2培养箱中培养5 d。培养结束后,离心取上清(条件培养基)备用。
小鼠处死后取出胫骨和股骨,用完全培养液吹洗胫骨和股骨至其变为白色,收集洗出的悬液,于4 ℃、210×g条件下离心10 min得骨髓细胞。采用台盼蓝染色活细胞计数法调整细胞浓度至2.5×105个/mL,于96孔细胞培养板中每孔加入100 μL骨髓细胞悬液及50 μL的完全培养液和50 μL的条件培养基,再将培养板置于5% CO2、37 ℃的培养箱中培养6 d。培养结束前5 h,向每孔中加入20 μL Alamar Blue试剂,继续培养至结束,最后于激发波长544 nm、发射波长590 nm条件下测定荧光强度。
1.2.3.2 霍山石斛多糖体外抑制人食道癌细胞(EC-109)活性 参照吕品[17]的方法,取对数生长期的EC-109细胞,调节细胞浓度为5×104cell/mL,向96孔板中每孔加入90 μL细胞悬液,并置于5% CO2、37 ℃的培养箱中培养。待细胞贴壁后每孔分别加入10 μL不同月份的霍山石斛多糖(终浓度为150 mg/mL),空白对照组为培养基,阳性对照组为5-氟尿嘧啶(5-FU,终浓度为5 μg/mL)。培养24 h后每孔中加入5 mg/mL的MTT溶液20 μL继续培养4 h,吸出上清,每孔加入150 μL二甲基亚砜,混匀后,在492 nm波长下测定OD值,计算抑制率。
1.3 数据处理
实验数据均以M±SD的形式表示,采用Origin 8.6软件绘制图表,利用SPSS 17.0软件进行数据统计处理,应用One-way ANOVA的方法分析比较各组实验数据间的显著性差异。
2 结果与分析
2.1 霍山石斛多糖含量分析
图1表明霍山石斛干燥茎的多糖含量存在一定的季节性规律,在3~5月份逐步升高,5~9月逐渐下降,5月时为30.38%达到全年最高,出现这种现象的原因可能是霍山石斛采收于安徽省大别山地区,该地处于北纬30 °10′~32 °30′、东经112 °40′~117 °10′,属北亚热带温暖湿润季风气候区,其3~5月的温度、湿度和光照适宜,霍山石斛光合作用旺盛,多糖大量积累;进入5月后,温度升高且迎来雨季,霍山石斛光合作用减弱,多糖含量开始降低[18-20]。
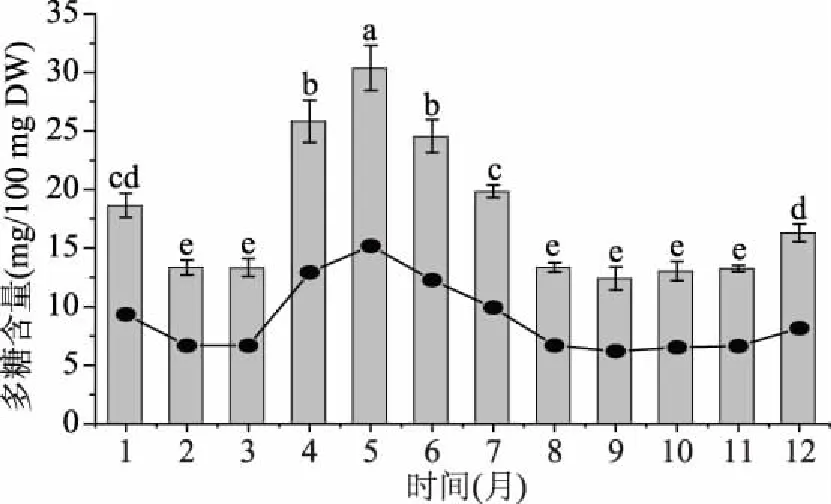
图1 不同月份霍山石斛干燥茎的多糖含量变化Fig.1 Polysaccharides content in dry stems ofDendrobium huoshanense harvested in different months注:不同小写字母表示差异显著(P<0.05);图5~图6同。
2.2 霍山石斛多糖的理化性质分析
2.2.1 红外光谱特征分析 红外扫描光谱(图2)表明,12个月份的霍山石斛多糖均在3200~3500 cm-1范围内有一个-OH的伸缩振动吸收峰,在2900 cm-1附近有一个C-H的伸缩振动吸收峰,在2890 cm-1附近有一个C-H的变角振动吸收峰,在960、1037、1070、1149 cm-1附近具有吡喃环构型的组峰,在842、896 cm-1附近分别显示了葡萄糖和甘露糖的吸收峰,在1725 cm-1附近有乙酰基的吸收峰[21-22]。这些吸收峰的存在表明霍山石斛多糖的特征基团稳定,不随生长季节的变化而改变。
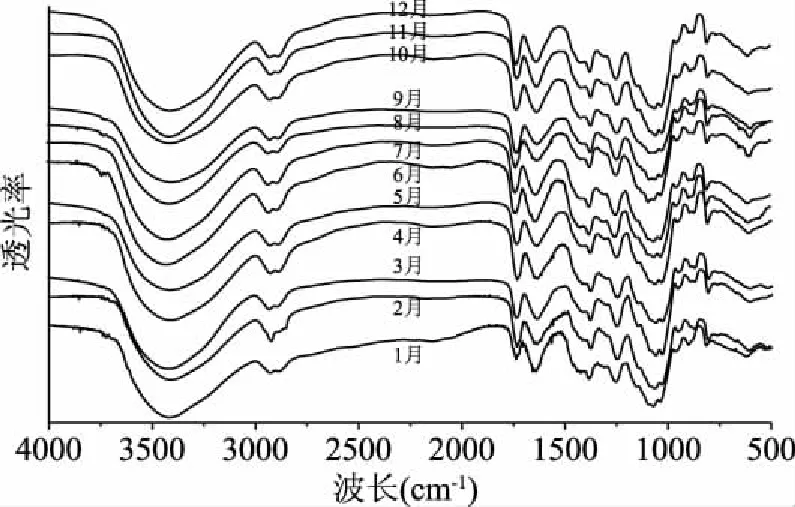
图2 不同月份霍山石斛多糖的傅里叶红外光谱扫描分析Fig.2 FT-IR for polysaccharides ofDendrobium huoshanense harvested in different months
2.2.2 分子量及黏度分析 HPGPC分析(图3,表1)表明,霍山石斛多糖在1~4月及10~12月主要由两个组分构成,组分1的分子量在96.44~537.93 kDa之间,组分2的分子量在27.39~99.68 kDa之间,而在5~9月份(夏季)只存在高分子量的组分1,低分子量的组分2基本消失。由此可以推测霍山石斛茎中存在两类分子量不同的多糖,一类随生长周期变化而存在或者被消耗,另一类则始终存在于霍山石斛中[23]。
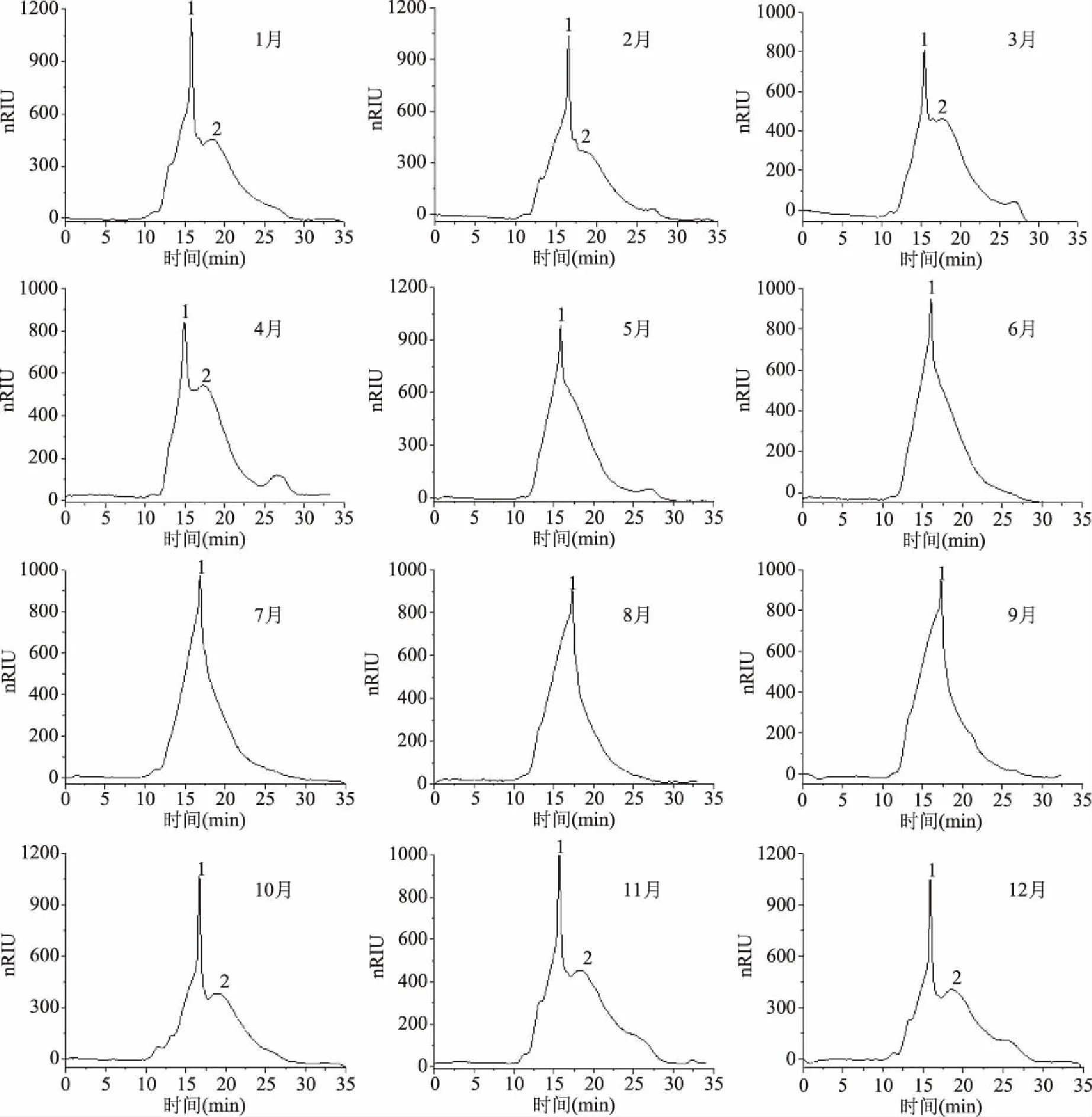
图3 不同月份霍山石斛多糖的HPGPC色谱图Fig.3 HPGPC chromatograms of polysaccharides in Dendrobium huoshanense harvested in different months注:1:高分子量多糖组分;2:低分子量多糖组分。

表1 霍山石斛多糖的理化性质年内变化Table 1 Annual changes in physicochemical properties of Dendrobium huoshanense polysaccharides
一般认为多糖的特征黏度和它的分子量相关[24-25]。表1显示不同月份霍山石斛多糖的黏度和多糖两个组分及其分子量存在一定的相关性,在1~4月份当霍山石斛多糖两个组分同时存在时,黏度较低;5~9月份时霍山石斛多糖只含有组分1,其黏度较高,且黏度值变化与组分1分子量的变化趋势相似。
2.2.3 乙酰基含量分析 有研究表明,多糖的药理功效与其乙酰基密切相关[26-29]。由表1可知,不同月份霍山石斛多糖的乙酰基含量变化范围在4.20%~5.62%之间,平均含量为5.03%,其中在2~5月及9月至翌年1月呈下降趋势,5~9月呈上升趋势,总体趋势为秋冬季多糖乙酰基含量高于春夏季。
2.2.4 单糖组成分析 霍山石斛多糖主要由甘露糖和葡萄糖构成(图4),其摩尔比在2.83∶1~5.84∶1之间,变化趋势与乙酰基含量相似,1~4月及8~12月呈下降趋势,4~8月呈上升趋势(表1)。

图4 霍山石斛多糖单糖组成分析Fig.4 Monosaccharide composition analysis ofDendrobium huoshanense polysaccharides注:A:D-甘露糖标品、D-葡萄糖标品及盐酸氨基葡萄糖的HPLC图(1:D-甘露糖,2:PMP,3:盐酸氨基葡萄糖,4:D-葡萄糖);B:不同月份霍山石斛多糖的HPLC图。
2.3 霍山石斛多糖的生物活性分析
2.3.1 肠黏膜免疫调节活性分析 由图5可知,霍山石斛多糖可以通过促进肠Peyer’s结中免疫细胞分泌细胞因子刺激骨髓淋巴细胞的增殖,表现出免疫调节活性,且气温较低的季节(秋、冬、春季)多糖促骨髓淋巴细胞的增殖效果高于气温高的夏季。与空白对照组相比,1~4月及9~12月的霍山石斛多糖免疫调节活性显著,而5~8月的多糖活性基本消失。与多糖理化性质的关联分析可发现,霍山石斛多糖的肠黏膜免疫调节活性与多糖的低分子量组分是否存在密切相关,当低分子量组分存在时,多糖的活性较为显著;同时多糖的肠黏膜免疫调节活性与乙酰基含量也有关,当乙酰基含量较低时多糖的活性较低。

图5 不同月份霍山石斛多糖对Peyer’s结细胞的肠粘膜免疫活性影响Fig.5 Intestinal mucosal immunomodulatoryactivity of polysaccharides isolated fromDendrobium huoshanense harvested in different months
2.3.2 体外抑制人食道癌细胞(EC 109)活性分析 由图6可知,不同月份的霍山石斛多糖对人食道癌细胞的生长都有一定的抑制作用,在1~4月份霍山石斛多糖的抑制作用相似,5月份时抑制率下降至全年最低为31.61%,随后多糖的抑制作用逐步增强,9月份抑制率达到全年最高为39.65%,10~12月多糖的抑制率有所降低,与1~4月份的作用接近。根据表1的多糖单糖组成摩尔比变化,可发现6~9月霍山石斛多糖的甘露糖与葡萄糖摩尔比升高时其对人食道癌细胞生长的抑制作用增强。总体上看,秋冬季的多糖抑制效果好于春夏季。

图6 不同月份霍山石斛多糖对食道癌细胞的抑制作用Fig.6 Inhibitory effect of polysaccharides isolated fromDendrobium huoshanense harvested indifferent months on EC 109 cell growth
3 结论
霍山石斛多糖的理化性质及生物活性的年动态变化分析表明,霍山石斛多糖主要由甘露糖和葡萄糖组成的两组分子量不同的多糖组分所构成,其中高分子量组分在霍山石斛茎中一直存在,低分子量组分则随霍山石斛的生长在5~9月份消失,与此同时多糖的特性黏度及甘露糖与葡萄糖的摩尔比升高,而4~6月份霍山石斛的多糖含量较高时乙酰基含量较低;霍山石斛多糖的不同组分及乙酰基含量和单糖组成摩尔比对其生物活性有显著的影响,当乙酰基含量降低或低分子量组分消失时多糖的肠黏膜免疫调节活性较低,当甘露糖和葡萄糖的摩尔比上升时多糖对食管癌细胞生长的抑制作用增强。综合上述霍山石斛多糖理化性质变化与生物活性变化的关系,可以确定用于功能性食品开发和生产的霍山石斛原料以秋冬季采收为宜。
