丹参酮IIA对BN大鼠脉络膜新生血管HIF-1α 和VEGF表达的影响
2020-06-16郝雪莲亢泽峰陈水龄刘健
郝雪莲,亢泽峰,陈水龄,刘健
年龄相关性黄斑变性 (age-related macular degeneration,AMD),以中心性视力下降、中心暗影和视物变形为主要症状[1]。本病临床上分为非新生血管型(即非渗出性或干性)以及新生血管型(即渗出性或湿性)。晚期多为严重型AMD,即黄斑中心区及中心凹地图样萎缩,或者有脉络膜新生血管形成。其从脉络膜向视网膜生长,可以突破Bruch’s膜,并在视网膜色素上皮和(或)视网膜下增殖[2]。由于新生血管的高渗透性易引起黄斑区反复出血、渗出,进而引起瘢痕机化导致患者丧失中心视力甚至致盲。缺氧是诱导血管内皮生长因子 (vascular endothelial growth factor,VEGF)高表达的重要刺激因素,缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)相关信号传导通路是脉络膜新生血管 (choroidal neovascularization,CNV) 形成过程中的重要通路之一,是调控VEGF高表达的主要信号通路。本病可归属于中医“视直如曲”“视瞻昏渺”“视瞻有色”等病的范畴[2]。中医治疗采用活血化瘀方法比较常见,其中常用有丹参、红花、三七等[3]。丹参针剂有丹参酮IIA磺酸钠注射液,其主要成分为丹参酮IIA。本研究通过半导体激光532 nm倍频Ng:YAG激光诱导Brown Norway(BN)大鼠眼底CNV动物模型,观察了中药单体丹参酮IIA对BN大鼠视网膜脉络膜新生血管HIF-1α 和VEGF表达的影响。
1 材料与方法
1.1 材料
1.1.1实验动物7~8周龄雄性BN大鼠60只,SPF级,体重在180~200 g(购自北京维通利华实验动物技术有限公司)。动物许可证号:SCXK (京)2018-0006。
1.1.2主要仪器 半导体激光532 nm倍频Ng:YAG激光(法国Quantel Medical公司),共焦激光眼底血管造影仪(德国海德堡),BIO-RAD全自动荧光定量PCR仪(CFX96)。
1.1.3主要试剂和药物10%水合氯醛溶液(国药集团),荧光素钠注射液 (美国Alcon),TRIzol(CWBIO),PCR试剂盒(Vazyme),丹参酮IIA磺酸钠注射液(上海第一生化药业),雷珠单抗眼用注射液(美国诺华制药)。
1.2 方法
1.2.1分组 将60只BN大鼠随机分为6组,每组分10只。A组,常规饲养;B组,0.9%生理盐水8 ml腹腔内注射;C组,右眼眼内注射雷珠单抗眼用注射液(5μl)1次;D组,腹腔注射丹参酮IIA磺酸钠注射液(10 mg/kg);E组,腹腔注射丹参酮IIA磺酸钠注射液(20 mg/kg);F组,腹腔注射丹参酮IIA磺酸钠注射液(40 mg/kg)[5]。
1.2.2造模方法 除A组外,其他组称重全麻后剪掉胡须,复方托吡卡胺滴眼液1滴充分散大瞳孔,滴3次,盐酸丙美卡因滴眼液、玻璃酸钠滴眼液1滴后,固定好大鼠,鼠眼抵触角膜并放置大小:1.8 cm×1.8 cm,厚度:0.15 mm盖玻片观察大鼠眼底,启动532 nm半导体激光于眼后极部距离视盘2~3 PD处光凝8~10个点,光斑直径50 μm,曝光时间0.05 s,功率300 mW[4]。
1.2.3给药方法A组,不给药;B组,腹腔注射8ml生理盐水;C组,腹腔麻醉BN大鼠,在右眼角巩膜后1~2 mm之间垂直进针,有落空感后立刻改变进针方向平行于眼轴进针2~3 mm,微量注样器注入5 μl雷珠单抗;D-F组,用丹参酮IIA磺酸钠注射液(10 mg/2 ml) 和灭菌注射用水分别配制低剂量(1.25 mg/ml)、中剂量(2.5 mg/ml)和高剂量(5 mg/ml)的丹参酮IIA磺酸钠溶液。(大鼠腹腔注射给药容积:5~10 ml/kg)按照大鼠体重取配置好的丹参酮溶液,给予D组,腹腔注射丹参酮IIA磺酸钠注射液(10 mg/kg);E组,腹腔注射丹参酮IIA磺酸钠注射液(20 mg/kg);F组,腹腔注射丹参酮IIA磺酸钠注射液(40 mg/kg),总剂量控制在0.6~0.8 ml。
1.2.4取材麻醉BN大鼠,快速取眼球。取3 cm×3 cm无菌塑料薄膜铺在无菌盐水纱布上。在纱布上快速移除眼前节后夹到无菌塑料薄膜上,剪开成四瓣,隧道刀刮下Bruch’s膜-视网膜-脉络膜复合体,弃巩膜。卷起无菌塑料膜使复合体滑入1.5 ml无Nase酶EP管中,加Trizol液1 ml,置便捷式液氮罐中,收齐样品后转入-80℃超低温冰箱备用。
1.3 眼底造影检查
各组随机选取6只,分别于造模后第7 d、14 d和21 d时称重、剪掉胡须,腹腔注射10%水合氯醛溶液(300 mg/kg)麻醉、配置10%荧光素钠注射液(120 mg/kg)和1.25%吲哚菁绿注射液(36 mg/kg)混合后按体重尾静脉注射上述混合液,行早期和晚期荧光素眼底血管造影(FFA)和吲哚青绿血管造影观察(ICGA)。使用Image-Pro Plus 6.2软件测量荧光照片平均光密度值。
1.4 RT-qPCR法检测HIF-1α 和VEGF表达
实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR):按照Trizol说明书提取总RNA,所用引物序列(表1)。检测提取浓度高进行cDNA合成。qPCR设置反应条件:95℃×3 min→95℃×15 s→58℃×30 s,39个循环,进行目的基因扩增,扩增完毕后开始分析结果,以GAPDH为内参照基因,比较对照组,得到目的基因表达的相对定量值,进行统计学分析。
1.5 统计学方法
采用SPSS20.0系统软件进行统计处理。计量资料用均值±标准差()表示,多组比较采用单因素方差分析,各组间两两比较用LSD-t检验。计数资料用百分率表示,组间采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FFA和ICGA表现
各组造模后7 d时FFA和ICGA表现(图1)。造影早期可见点状高荧光。造影中晚期见花环状荧光渗漏。相应的ICGA晚期图片可见荧光充盈,光斑周边强荧光,中心呈现弱荧光。
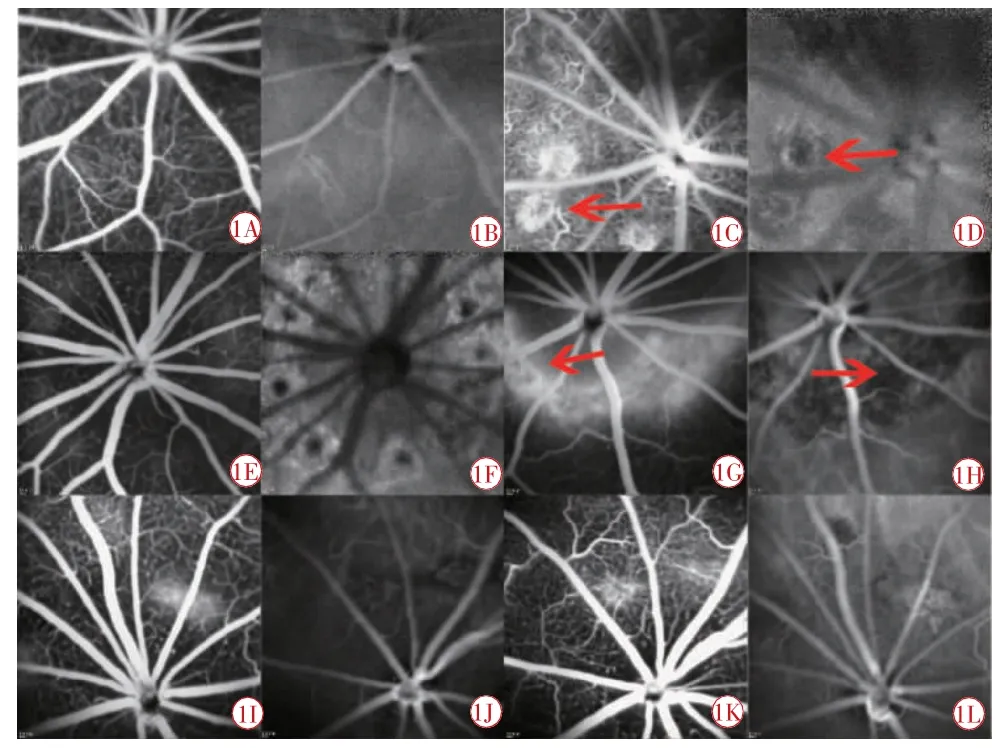
图1 各组FFA和ICGA图。1A A组FFA图;1B A组ICGA图;1C B组晚期FFA图,箭头表示花环状荧光渗漏;1D B组晚期ICGA图,箭头表示荧光充盈,周边呈强荧光,中心呈弱荧光;1E C组FFA图荧光渗漏不明显;1F C组ICGA图,周边荧光强,中心弱;1G D组FFA图,箭头表示造影晚期花环状荧光渗漏;1H D组ICGA图,箭头表示强荧光渗漏点;1I E组早期点状FFA图;1J E组早期点状荧光渗漏ICGA图;1K E组晚期网状FFA荧光渗漏;1L E组晚期网状ICGA荧光渗漏。FFA:眼底血管荧光造影;ICGA:吲哚菁绿脉络膜造影
2.2 CNV形成率
大鼠激光光凝后不同时间点各组CNV形成率如下:7 d、14 d、21 d分别为68.7%、77.3%、75.2%,7 d时CNV形成率增高,14 d时CNV形成率达高峰值,21d趋向稳定。7 d时各组间CNV形成率比较(χ2=4.524,P=0.340);14 d时各组间CNV形成率比较(χ2=2.814,P=0.589);21 d时各组间CNV形成率比较(χ2=1.894,P=0.755);7d、14d、21d比较(χ2=3.149,P=0.207);7 d和14 d比较 (χ2=2.858,P=0.09);7 d和21 d比较(χ2=1.564,P=0.211);14 d和21 d比较(χ2=0.194,P=0.659),差异均无统计学意义(表2)。
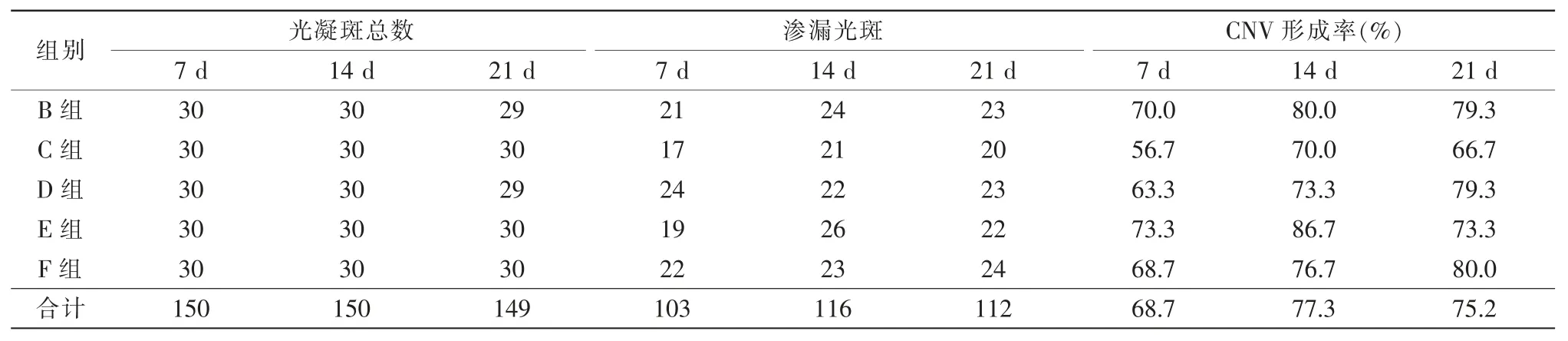
表2 激光光凝后不同时间点各组CNV发生率的变化
2.3 FFA荧光渗漏AOD值
荧光渗漏平均光密度值比较:3个时间点各组间荧光渗漏平均光密度值比较,(F7d=33.697、F14d=47.894、F21d=59.382,均P=0.000);7 d时,模型组与雷珠单抗组(t=15.100,P=0.000)、丹参酮低剂量组(t=2.956,P=0.025)、中剂量组(t=2.760,P=0.033),与高剂量组(t=1.579,P=0.165),均有统计学意义。雷珠单抗组与丹参酮低剂量组(t=5.170,P=0.002)、中剂量组(t=7.793,P=0.000)、高剂量组(t=11.390,P=0.000)比较,均有统计学意义;丹参酮3个剂量组两两比较,均无统计学意义(P>0.05),14 d、21 d各组激光斑荧光渗漏趋势同7 d组(表3)。
表3 各组FFA荧光渗漏AOD值比较(±s)
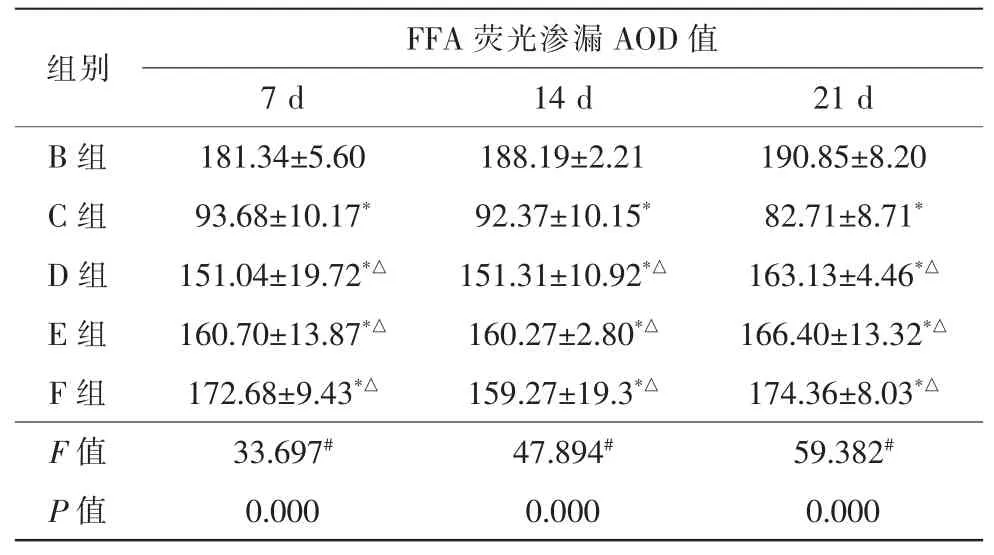
表3 各组FFA荧光渗漏AOD值比较(±s)
注:B组模型组;C组雷珠单抗组;D组丹参酮低剂量组;E组丹参酮中剂量组;F组丹参酮高剂量组。# 同一时间点多组比较,P<0.05;*与模型组(B组)比较,P<0.05;△与雷珠单抗组(C组)比较,P<0.05
2.4 RT-qPCR检测VEGF、HIF-1αmRNA相对表达量
对照组目的基因与内参GAPDH相对表达量进行校正,得到对照组目的基因mRNA相对表达量1时,得到模型组与各治疗组目的基因mRNA相对表达量。
VEGF mRNA:3个时间点各组间VEGF mRNA因子相对表达量比较(F7d=40.775、F14d=17.223、F21d=20.591,均P=0.000);其中21 d时,模型组与雷珠单抗组(t=10.940,P=0.000)、丹参酮低剂量组(t=6.525,t=0.003)比较,均有统计学意义;雷珠单抗组与丹参酮低剂量组(t=4.883,P=0.008)比较,有统计学意义;丹参酮低剂量组与中剂量组、高剂量组与中剂量组、高剂量组与低剂量组比较均无统计学差异(P>0.05)(表4)。
HIF-1α mRNA:3个时间点各组间HIF-1α mRNA因子相对表达量比较(F7d=19.544,F14d=221.593、F21d=67.754,均P=0.000);7 d、14 d、21 d时各组间HIF-1α mRNA相对表达量趋势相似,与上述VEGF mRNA相对表达量21 d时趋势一致(表4)。
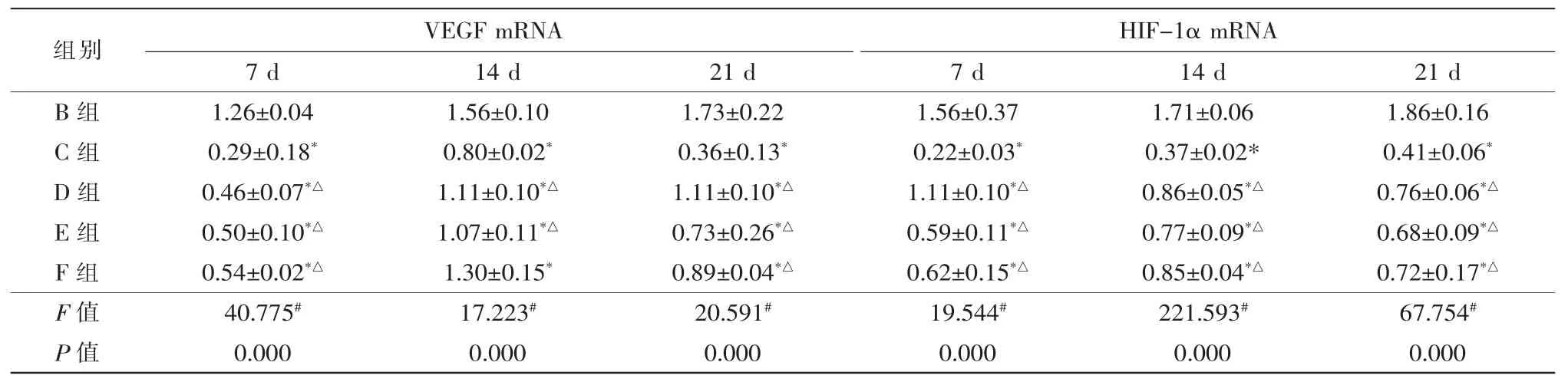
表4 RT-qPCR检测VEGF、HIF-1α mRNA相对表达量
3 讨论
脉络膜新生血管(CNV)是源自脉络膜毛细血管的增殖性血管,也是眼底新生血管的主要表现形式之一。CNV是多种缺血缺氧性眼底疾病的共同终末病理环节,如年龄相关性黄斑变性、中心性渗出性脉络膜视网膜病变(central exudative chorioretinopathy,CEC)、病理性近视(pathological myopia,PM)等,因其病理性血管管壁的高度通透性,极易导致局部出血和渗出产生,继而引起组织机化和瘢痕形成,是目前严重影响老年和青年人群不可逆性视力严重损害及致盲的主要原因[6]。
目前,普遍认为局部组织缺氧和炎症反应的发生是脉络膜新生血管CNV形成的主要原因,其中缺氧环境是其形成的启动因素,低氧环境诱发的缺氧诱导因子-1 (hypoxia-inducible factor-1,HIF-1)促发的相关信号通路[7]的级联反应,是最终导致CNV形成的核心通路之一。HIF-1由HIF-1α 和HIF-1β 两个亚基组成,HIF-1α 是功能亚基,调节HIF-1的活性及功能,而HIF-1β 可能与HIF-1的稳定及其二聚体形成有关联。常氧条件下,HIF-1α 发生羟基化,随后被胞质中的蛋白水解酶水解成为小分子片段,失去其生物学功能;然而缺氧环境中可以诱导HIF-1α 的表达,过度表达的HIF-1α进入细胞核与HIF-1β 结合形成转录因子HIF-1,HIF-1与VEGF基因的5’ 端和3’ 端结合,诱导VEGF基因的表达,促进新生血管内皮细胞的大量增殖和迁移,促使新生血管形成[8]。近年研究显示HIF-1α 介导的血管新生可能受其上游AKT途径的调节[9],AKT在磷脂酰肌醇3-激酶(PI3K)条件下磷酸化,形成具有活性功能的AKT激酶,进一步激活雷帕霉素靶蛋白(mTOR),进而刺激HIF-1α 的表达,在调控VEGF表达、脉络膜新生血管CNV形成的过程中发挥着重要的作用。
VEGF是已知促进CNV生成的最关键因子,VEGFs(VEGF家族及其受体)通过激活内皮细胞的有丝分裂与迁徙,诱导毛细血管形成来促进新生血管的生成[10]。在缺氧等条件诱导HIF-1α 表达增加时,其靶基因表达量也明显增加[11-12]。
通过抑制VEGF在视网膜内皮细胞中的新生血管生成作用来减轻湿性AMD症状的有效方法是玻璃体腔内注射VEGF抗体。然而,由于注射的高成本和侵入性,这种治疗并不总是负担得起的。亢泽峰等应用加减驻景方治疗缺血性眼病进行了大量体外研究[13-14]、体内研究[15-17]、临床观察[18-19]和理论阐述[20],证明了加减驻景方对VEGF因子的抑制作用。加减驻景方临床上用其治疗缺血眼病取得了良好疗效,能有效改善眼底病变,提高部分视功能。方中加减药丹参有活血化瘀,增加血、氧供应之功效。丹参主要成分为丹参酮IIA,丹参酮IIA能明显抑制肿瘤新生血管生成,减少VEGF产生[21-23]。其机制可能是通过降低HIF-1和NF-κB信号通路活化而引起级联反应。基于此种假说课题组拟以动物模型为研究载体,从分子免疫、基因研究揭示中药单体丹参酮IIA对CNV的作用机制,为临床用药提供实验依据,为优化复方、新药开发奠定基础。
本实验选用氪激光光凝眼底诱导BN大鼠脉络膜新生血管动物模型作为研究对象,源于大鼠诱导的CNV发生率较高,大约为60%~70%,在光凝后短时间内(1周内)即可发生,而且光凝斑的荧光渗漏在10~14 d达到高峰,便于进行干预性研究;本次研究发现7 d、14 d、21 d各组大鼠激光光凝后CNV形成率分别为68.7%、77.3%、75.2%,表现出7 d CNV形成率明显升高,14 d达到顶峰,21 d趋于平稳。此方法诱导CNV技术比较成熟稳定,且诱导CNV的条件可标准化,价格相对便宜,便于基因操作,可用于观察单一基因过表达或高表达对CNV形成的影响[24]。
在各时间点,雷珠单抗能有效的抑制VEGF和HIF-1α 蛋白表达,且作用优于中药单体(丹参酮IIA)组。但是中药单体组不同剂量在一定的程度上可抑制VEGF和HIF-1α 蛋白的表达,从而抑制CNV动物模型的CNV形成。但是抑制VEGF和HIF-1α程度不随中药单体剂量增加而降低。
综上所述,中药单体丹参酮IIA磺酸钠注射液可有效抑制CNV动物模型视网膜-脉络膜中VEGF和HIF-1α 蛋白表达,从而减少CNV,具有廉价,副作用少,给药方式安全,依从性高等优点。
