生物固碳途径研究进展
2020-06-16江会锋刘玉万杨巧玉
江会锋, 刘玉万, 杨巧玉,2
(1.中国科学院 天津工业生物技术研究所 系统微生物工程重点实验室,天津 300308;2.中国科学院大学, 北京 100049)
二氧化碳的生物固定是地球生命圈赖于生存的根本。光合生物利用太阳能通过光合作用把CO2转化为碳水化合物,为整个生命体系提供了物质和能量基础,每年能够产生2 000多亿吨的生物质。目前已发现的天然生物固碳途径有6条,分别为卡尔文循环、Wood-Ljungdahl途径、3-羟基丙酸双循环途径、还原性(逆向)TCA循环途径、二羧酸/4-羟基丁酸循环途径和3-羟基丙酸/4-羟基丁酸循环途径,主要通过羧化酶或还原酶进行生物固碳。然而自然界存在的固碳途径中,其核心固碳羧化酶或还原酶存在催化速度慢、催化反应复杂、严格厌氧等诸多问题,因此天然固碳途径的改造优化难度较大。随着合成生物学的快速发展,新酶新途径的设计水平显著提升。新设计的生物固碳酶可以部分解决天然固碳酶存在的缺陷,使得人工生物固碳途径效率显著提升,具有广阔的发展潜力,是当前合成生物学研究的热点。未来通过新酶改造与优化,进一步提升人工生物固碳效率,将有望创造全新的人工生物固碳路线,革新地球碳循环模式。本文通过对比分析天然固碳途径和人工固碳途径中涉及的羧化酶和还原酶的酶学数据,探讨了人工生物固碳研究的未来发展趋势。
1 天然固碳途径中的羧化酶和还原酶
卡尔文循环是自然界中最主要的生物固碳途径,其核心是Rubisco羧化酶 (核酮糖-1,5-二磷酸羧化酶)[1]。近年来,围绕着卡尔文循环途径改造优化做了大量工作,主要包括定向进化提高Rubisco酶的活性[2-4]、碳浓缩机制的人工设计[5-7]及异源表达卡尔文循环途径[8]等。然而相比于其他羧化酶(表1),Rubisco酶活性相对较弱[9],而且空气中广泛存在的O2还会和CO2竞争该酶的活性中心发生氧化反应,如在C3植物中氧化反应占到Rubisco酶总催化反应的20%~30%[10],因此Rubisco酶人工改造设计难度较大。

表1 几种重要羧化酶的动力学参数
注:“-”表示暂无相关数据

Wood-Ljungdahl途径是自然界存在的六条固碳途径中唯一基于还原酶的固碳路径[22]。首先,CO2被甲酸脱氢酶还原为甲酸,甲酸再被ATP活化后与四氢叶酸结合生成甲酰基四氢叶酸,然后发生连续多次还原反应。还原后的甲基四氢叶酸在CO脱氢酶/乙酰辅酶A合成酶复合体催化下与另外一分子CO2和辅酶A生成乙酰辅酶A。该途径的实质是2个CO2分子(或者1个CO2分子和1个CO分子)合成一个乙酰辅酶A。该途径需要严格的缺氧条件,对金属离子(Mo或W、Co、 Ni、Fe)要求高,并且广泛使用辅酶(四氢蝶呤和钴胺素)[23]。至今,该途径依然没有实现完全的异源表达。
2 利用固碳羧化酶的人工途径设计
自然界存在的五条羧化酶固碳途径中,二羧酸/4-羟基丁酸循环的磷酸烯醇式丙酮酸羧化酶活性最高。因此近年来,多个基于羧化酶的人工固碳途径设计,都是以高效的磷酸烯醇式丙酮酸羧化酶为主。Arren等[24]以自然界固碳效率最高的磷酸烯醇式丙酮酸羧化酶为基础,计算获得了非天然的合成固碳途径——丙二辅酶A/草酰乙酸/乙醛酸途径(MOG)(图1)。Bouzon等[25]同样利用磷酸烯醇式丙酮酸羧化酶实现了CO2转化为甲醛,最后甲醛与四氢叶酸结合进入中心代谢。

图1 设计的丙二酰辅酶A-草酰乙酸-乙醛酸途径(MOG途径)[24]Fig.1 Designed malonyl-CoA-oxaloacetate-glyoxylate pathway(MOG pathway)[24]
James C. Liao团队Yu等利用磷酸烯醇式丙酮酸羧化酶,构建了苹果酰辅酶A-甘油酸途径(MCG)[26](图2a),成功实现了1分子磷酸烯醇式丙酮酸固定1分子CO2生成2分子乙酰辅酶A。该途径与卡尔文循环途径结合后,仅需要Rubisco酶固定1.5个CO2,5.5个ATP就能够生成1分子乙酰辅酶A(天然卡尔文循环Rubisco酶需固定3个CO2,7个ATP才生成1分子乙酰辅酶A),不仅降低了Rubisco酶的催化负担,还提高了能量效率。另外结合乙醇酸脱氢酶,苹果酰辅酶A-甘油酸途径还能够减少光呼吸的碳损失,苹果酰辅酶A-甘油酸途径能够理论实现光呼吸路径的100%碳得率(图2b),对光合生物改造具有重要意义。
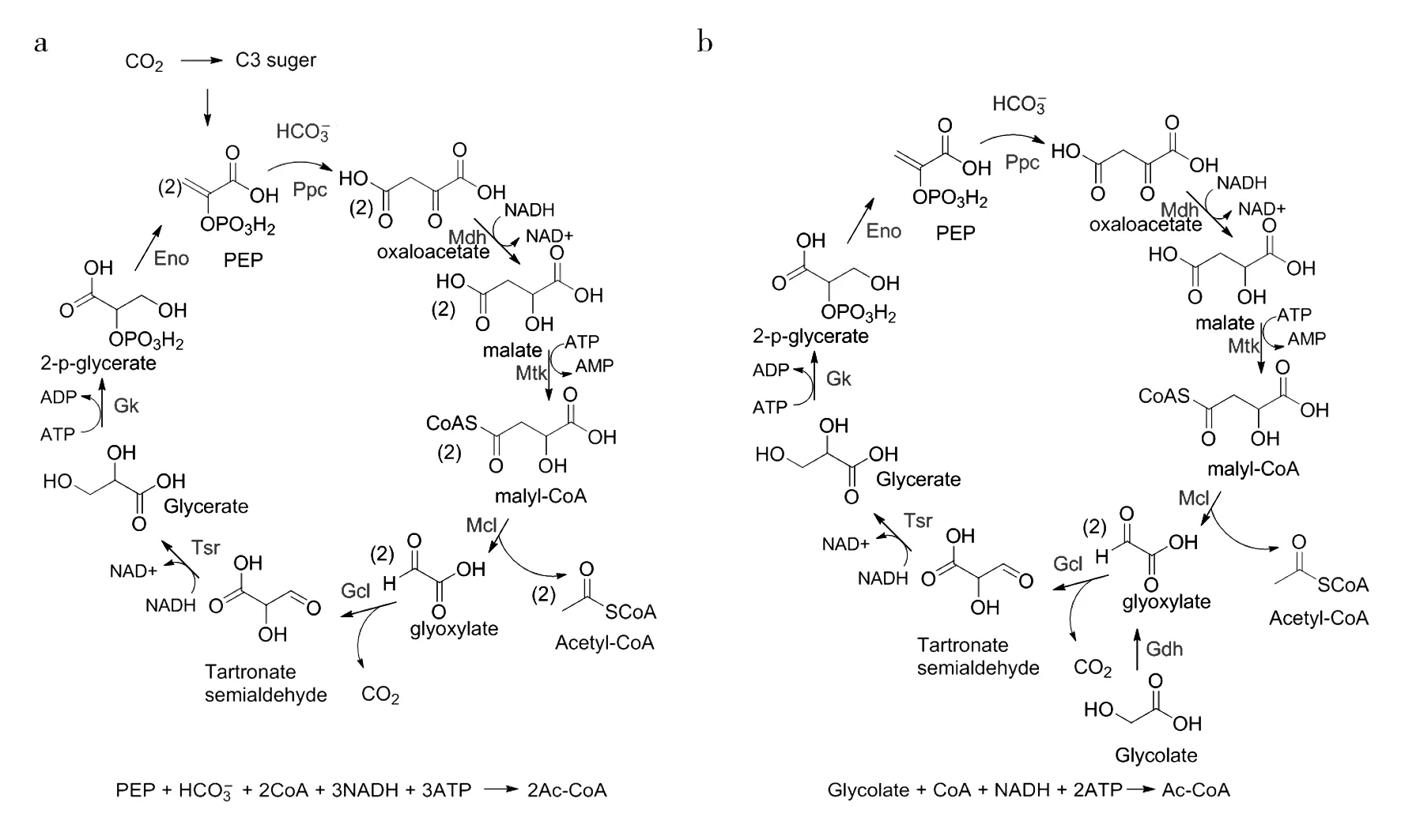
图2 设计的苹果酰辅酶A-甘油酸路径(MCG)(a)[26]和结合乙醇酸脱氢酶的 MCG途径(b)Fig.2 Designed malyl-CoA-glycerate pathway (MCG) (a)[26]and MCG pathway binding to glycolate dehydrogenase(b)
此外,Tobias J. Erb研究组Schwander等构建了基于还原羧化酶的巴豆酰辅酶A/乙基丙二酰基辅酶A/羟基丁酰基辅酶A循环途径[27](CETCH途径)(图3),该途径所用的丁烯酰辅酶A还原羧化酶,在物种Streptomycescoelicolor的动力学参数:Kcat=32.9/s, Kcat/Km=1 642.6 L·mmol-1·s-1。通过酶改造优化后,CETCH途径纯蛋白酶体外固定CO2的效率为5 nmol·mg-1·min-1,能够与天然的CBB循环固碳效率相当。尽管体外实验证明CETCH循环可以达到与卡尔文循环相当的固碳速率,但是CETCH循环产物乙醛酸的还原度较低,因此该循环与已有代谢途径的结合相对较难[28]。
3 基于固碳还原酶的人工途径设计
CO2可以通过甲酸脱氢酶逐步还原为甲酸、甲醛甚至甲醇。甲酸脱氢酶可以将CO2直接还原为甲酸。甲酸脱氢酶主要有两类:一类是基于NADH的甲酸脱氢酶,一类是含有金属的甲酸脱氢酶。用辅酶NADH的甲酸脱氢酶活性往往不高,但是最近报道的来源于Clostridiumljungdahlii的基于NADH的甲酸脱氢酶[29],其活性较高,Kcat/Km可达39.2 L·mmol-1·s-1。金属依赖的甲酸脱氢酶活性中心往往含有钼或钨,对氧敏感且需要辅酶,其活性要高于利用NADH辅酶的甲酸脱氢酶,如来源于Desulfovibriodesulfuricans的甲酸脱氢酶[30],Kcat/Km可达2 968.2 L·mmol-1·s-1。甲酸属于相对较强的酸(pKa=3.75),往往以甲酸负离子的形式存在,自身缩合反应可能性较低。虽然有报道称在马铃薯块茎中存在甲酸缩合为乙醛酸的反应[31],但是其真实性还需要进一步验证。甲醇也无法进行直接缩合利用,通常被氧化甲醛或者甲酸进入中心代谢[28]。因此自然界存在的甲酸或甲醇同化途径大多都是转化成了甲醛。

图3 设计的巴豆酰辅酶A/乙基丙二酰辅酶A/羟基丁酰辅酶A循环(CETCH循环)[27]Fig.3 Designed crotonyl-CoA/ethylmalonyl-CoA/hydroxybutyryl-CoA cycle(CETCH cycle)[27]

甲酸除了通过辅酶四氢叶酸还原为甲醛(亚甲基四氢叶酸),还可以直接被还原为甲醛。存在于甲基营养菌的核酮糖单磷酸循环(RuMP途径)能够同化甲醛分子进入中心代谢[35],同化甲醛的关键酶6-磷酸己酮糖合成酶(HPS)对甲醛的亲和性特别高,Km可达59 μmol/L,反应速率也较高。Meyer等[36]通过不断驯化,成功实现了甲醇为碳源的条件下,大肠埃希菌利用核酮糖单磷酸循环生长。另外结合核酮糖单磷酸循环和非氧化糖降解途径,甲醇缩合循环(MCC)又被成功设计[37](图5),此途径可将2分子甲醛和辅酶A转化为1分子乙酰辅酶A,没有碳损失且不需要ATP。但是此途径中存在同一底物被两个酶利用,且酶活性不同,容易造成整个系统不稳定。

图4 设计的修饰丝氨酸循环[34]Fig.4 Designed modified serine cycle[34]

图5 设计的甲醇缩合循环(MCC)[37] Fig.5 Designed Methanol Condensation Cycle (MCC)[37]
除了改造优化天然生物固碳途径,全新人工设计的固碳利用途径也取得了巨大成功。例如Siegel等通过新酶设计,成功地创建了催化甲醛聚合为1,3-二羟基丙酮的聚糖酶[38](图6a)。此途径具有路线短、化学驱动力大、对氧不敏感和与中心代谢无交叉等优点。但是该途径也存在聚糖酶的反应活性较低,Kcat/Km为4.7 L·mmol-1·s-1;在较低甲醛浓度条件下主要产生羟基乙醛副产物等问题[39]。本课题组[40]前期基于化学合成原理,从头设计了羟基乙醛合酶和乙酰磷酸合酶。结合磷酸乙酰基转移酶(PTA),创建了一条从甲醛经3步反应合成乙酰辅酶A的非天然途径(Synthetic Acetyl-CoA pathway,SACA途径)(图6b),利用体外酶催化、体内同位素标记、细胞生长等实验,证明了SACA途径无论在体外还是体内,都可以有效地将一碳转化成乙酰辅酶A。乙酰辅酶A既是绝大多数生物制造产品的前体,又是细胞生命中能量与物质代谢的枢纽,在生命代谢网络中发挥举足轻重的作用。不同于已知的自然生物途径,从原料到乙酰辅酶A往往需要经过8~10步以上的反应,人工设计的SACA途径只需要3步反应。该途径具有化学驱动力大、不需要能量输入、与中心代谢正交和没有碳损失等优点,是迄今为止最短的乙酰辅酶A生物合成途径。目前人工设计的SACA途径中羟基乙醛合成酶活性还较低,Kcat/Km为9.6 L·mmol-1·s-1。进一步酶改造优化后,该途径将具有巨大的应用潜力。

图6 设计的聚糖路线(a)[38]和设计的合成乙酰辅酶A路线(b)[40]Fig.6 Designed glycan route(a)[38] and Designed synthetic acetyl-CoA route(b)[40]
4 展 望
综上所述,在深入解析自然已知固碳酶催化性质和固碳途径的代谢原理后,一方面可以利用自然进化产生的这些高效固碳羧化酶或还原酶,通过代谢工程改造优化,创建更高效的人工固碳酶和途径;另一方面通过解析生物固碳酶的催化机理,然后利用新酶设计创建全新的人工固碳酶和固碳途径,将有可能突破自然生物固碳途径的各种条件限制,从而实现高效的人工生物固碳,建立全新的生物固碳模式。另外,自然生物固定CO2的能量主要来自于光合作用,然而自然光合作用的太阳能能量利用效率不到0.1%。相比而言,人工光伏发电已经可以把太阳能的利用效率提高到20%左右。随着光伏器件及电催化剂的发展,可以将太阳能产电与生物固碳相结合,创建高效的人工生物固碳元件和固碳途径,突破自然固碳酶的局限,大幅提升CO2生物转化利用效率,为以CO2原料的工业生物制造奠定基础。
