珠兰鲜叶提取液对白菜种子萌发的化感效应
2020-06-16韩修文孙玲万志兵胡凌峰付琳玉
韩修文,孙玲 万志兵,胡凌峰,付琳玉
(安徽黄山学院生命与环境科学学院,黄山 245041)
珠 兰(Chloranthus spicatus(Thunb.)Makino),又名金粟兰,系金粟兰科金粟兰属,在我国多分布于云南、四川、贵州等区域,主要生于山坡、沟谷密林下,海拔150~990 m,但野生珠兰较为少见,现各地多为栽培[1]。珠兰可用于提取珠兰油和浸提珠兰浸膏等香料[2],也是传统的傣药植物[3],全株可入药,具跌打损伤、消肿镇痛、疮疖肿毒等功效[4],珠兰也可被作为茶用经济植物,其熏制的珠兰花茶畅销国内外,是中国四大著名茶花之一[5]。随着各地的栽培范围的增加,其生物资源价值逐渐得到开发利用。
农林间作是中国最重要的混农林业形式之一,并且中国农林间作的规模和模式都处于世界领先地位[6],农林间作复合生态系统对于生态系统的调控以及农林业的可持续发展具重要作用[7],物种间化感作用对于群落的组成和分布具有一定影响,在间作中不同物种间通过化感作用可提高产量或抑制杂草生长等[8]。化感作用即植物通过挥发、雨雾淋溶、根的分泌、植物组织腐败后释放物[9]等方式向环境中释放次化感物质从而对一定生长范围内其他植物体生长产生直接或间接影响[10-11],其作用程度受土壤、气候、水分、病虫害、化感物质及数量等影响[12]。化感物质可分为14 类[13],主要包括酚类、萜类、含氮化合物、聚乙炔及香豆素等次生物质,随研究深入相继发现了倍半烯内酯、树脂糖苷等复合结构物质[9]。化感作用可以通过影响植物种子萌发、幼苗生长、成株的开花与结实等影响周围植物生长情况[14],并在一定程度上影响群落组成,森林更新及演替过程[15]。许多物种间都存在不同程度的化感作用,如喜旱莲子草、白车轴草和小飞蓬叶片水浸液各浓度梯度抑制小麦种子萌发[16],新银合欢水提液对白灰毛豆幼苗生长均表现为随浓度升高而增强的抑制作用[17],沙芥水不同部位浸提液对白菜种子萌发和幼苗生长均有抑制作用且随提取液浓度升高抑制作用增强[18];低浓度的三七水提液可以促进玉米种子萌发和幼苗生长,三七与耐受性较强的玉米间作可提高玉米产量[11];在小麦与大豆间套种植时,由于化感作用存在使其根系还原力提高30%左右,吸磷能力也显著提高[12]。根据不同物种间的化感作用来进行合理间作配置,是农林间作的一项重要举措[10]。
目前国内对珠兰花的研究主要为其茶用价值,药用价值及栽培技术,关于珠兰化感作用相关研究较少,但对其同科植物研究表明,使用多种柱色谱技术从金粟兰科金粟兰属狭叶金粟兰地上部分甲醇提取物的醋酸乙酯萃取部位分离得到8 个化合物,分别鉴定为1-乙酰氧基2,3,4,5-四羟基-5-对甲氧基苯基戊烷(1)、(E)-5-(4-甲氧基苯基)-4-烯-1,2,3-三羟基戊醇(2)、异嗪皮啶(3)、(-)-二氢脱氢二松柏醇(4)、(±)-赤式-愈创木酚基甘油-4'-二氢松柏醇醚(5)、(-)-rosiridol(6)、(4S)-对薄荷烯4,7-二醇(7)、地芰普内酯(8)[19];陈超、曾慧婷等[20]对几种金粟兰属植物进行了较为系统的化学成分研究,从中共分离鉴定了上百个化合物,其中近半数为新化合物且多为倍半萜和二萜类成分,这些结果对于珠兰花化感研究有一定的参考,通过间作合理配置可利用植物间化感作用提高珠兰产量,且珠兰喜温暖潮湿忌烈日直晒,通过与其他植物间作也可提高春冬季林内生境温度减少冻害,夏季其他植物可起遮阴作用避免珠兰受阳光直射。实验主要通过珠兰鲜叶不同溶剂及浓度梯度提取液对白菜种子萌发及幼苗生长情况的影响,探究珠兰鲜叶中化感物质的化感效应,为珠兰生物资源开发利用和农林间作合理配置提供理论基础。
1 材料与方法
1.1 材料
2018 年6 月于黄山市珠兰花培育基地采集珠兰花鲜叶,清洗晾干后置于冰箱备用。实验种子为上海青,由杭州科丰种子有限公司生产,其纯度96%,净度98%,含水量≤7%,发芽率≥85%,选取健康种子于1%次氯酸钠溶液中消毒30 min,再用蒸馏水冲洗3 次备用。实验所用甲醇、乙醚、乙酸乙酯均为分析纯。
所用仪器主要有电子天平(感量0.000 1 g)、游标卡尺(精确度为0.1 mm)、分液漏斗、移液枪、光照培养箱、烘箱、去离子水装置等。
1.2 方法
参考朱成磊[21]的实验方法并做一定修改,将洗净晾干的珠兰鲜叶(70 g)放进钵体研磨,用400 mL 80%甲醇溶液浸24 h 后收集上清液保存,在滤渣中加入400 mL 乙醚溶液浸提24 h,收集上清液保存。将两次上清液混合后过滤,将滤液放置于35 ℃烘箱中挥干,挥干后加入去离子水定容至70 mL,得到1.0 g·mL-1的母液。
将母液加入分液漏斗中,加入400 mL 甲醇溶液浸提18 h 后收集上清液于35 ℃条件下挥干,再加入去离子水定容至70 mL 配成浓度为1.0 g·mL-1的溶液,称为甲醇相态液,再分别加入无菌水稀释配置0.2,0.4,0.6,0.8,1.0 g·mL-1各梯度各20 mL。
操作方法同上,得到乙醚相态液及乙酸乙酯相态液,各相态液稀释同样浓度梯度后加入试管中置于4 ℃冰箱保存。
在培养皿(Φ=9 cm)的底部铺上2 层滤纸,向每个皿内分别加入珠兰的各相态溶液6 mL,并以相同体积去离子水为对照组。每个处理3 个重复,每个重复100 粒白菜种子,将培养皿置于25 ℃恒温光照培养箱中,18 h 光照与6 h 黑暗条件交替培养,72 h 后统计发芽数(长出子叶为准),测量根长、茎长及鲜重,计算发芽率、发芽势、发芽率化感指数、发芽势化感指数、根长化感指数、茎长化感指数、鲜重化感指数等。
1.3 性状测定
从播种72 h 后统计发芽数(长出子叶为准),计算种子发芽率。
种子发芽率(%)=发芽终期(72 h)正常发芽种子总数/供试种子总数×100[22]。
种子发芽势(%)=日平均发芽数达到最高日正常发芽的种子总数/供试种子总数×100[10]。
根长化感指数、芽长化感指数、鲜重化感指数:播种72 h 后,以每株幼苗平均根长、茎长、鲜重计算。
化感指数RI=处理值/对照值-1,RI>0 则表示促进作用,RI<0 则表示抑制作用,绝对值越大则表示化感作用越强。
实验采用Excel 2010 记录数据及Word 2010 绘制表格,用SPSS 17.0 进行方差分析,LSD 法进行多重检验。
2 结果与分析
2.1 珠兰鲜叶不同溶剂及浓度梯度提取液对种子萌发影响
2.1.1 对种子发芽率影响
种子发芽率可作为评判种子质量的重要指标之一。由表1,表2 可知,珠兰鲜叶甲醇相态液对白菜种子发芽率具抑制作用,且其抑制作用随甲醇相态液浓度升高而增加。当甲醇相态液浓度处于0.2~0.4 g·mL-1时,其抑制程度急剧增加,0.2 g·mL-1甲醇相态液处理组与0.4 g·mL-1甲醇相态液处理组发芽率分别达到25.33%、5.00%,化感指数分别达到-0.694、-0.940,两处理组发芽率存在极显著性差异,并且0.2 g·mL-1甲醇相态液处理组与对照组差异极显著,0.4 g·mL-1甲醇相态液处理组与对照组之间差异极显著。当甲醇相态液浓度≥0.6 g·mL-1时,各甲醇相态液处理组发芽率分别达到1.67%、0.67%、0.00%,化感指数分别-0.980、-0.992、-1.00 0,与对照组及0.2 g·mL-1甲醇相态液处理组差异极显著,说明从浓度为0.2 g·mL-1起抑制作用随提取液浓度升高加强,当甲醇相态液浓度为1.0 g·mL-1时,其抑制作用极强,无种子展开子叶,说明不同浓度梯度甲醇相态液对白菜种子发芽情况具抑制作用,且抑制程度随浓度升高越来越强烈。
当珠兰鲜叶乙醚相态液浓度≤0.4 g·mL-1时,对白菜种子发芽率具抑制作用且抑制作用随乙醚相态液浓度升高而逐渐加强,各乙醚相态液处理组发芽率分别达到69.33%,58.00%,化感指数达到-0.161,-0.298,与对照组之间差异不显著。当甲醇相态液浓度为0.6 g·mL-1时,其发芽率达到39.00%,化感指数达到-0.528,其发芽率与对照组及其余处理组之间差异极显著。当乙醚相态液浓度>0.6 g·mL-1时,各处理组发芽率分别为10.00%,9.67%,化感指数达到-0.879,-0.883,与对照组均存在极显著差异,以上说明随浓度升高对白菜种子发芽率具抑制作用且低浓度抑制作用不显著,高浓度抑制作用极显著。
珠兰鲜叶不同梯度乙酸乙酯相态液对白菜种子发芽率整体趋势表现为逐渐增强的抑制作用。当乙酸乙酯相态液浓度为0.2 g·mL-1时,其发芽率为66.33%,化感指数达到-0.198,与对照组差异不显著。当乙酸乙酯相态液浓度为0.4 g·mL-1和0.6 g·mL-1时,其发芽率分别达到54.67%和44.00%,化感指数达到-0.339 和-0.468,与对照组差异极显著,当乙酸乙酯相态液浓度为0.8 g·mL-1和1.0 g·mL-1时,发芽率分别为32.33%,14.67%,与对照组均存在极显著性差异,化感指数达到-0.609 和-0.823,以上说明不同浓度梯度乙酸乙酯相态液随浓度升高对白菜种子发芽率具抑制作用,且随浓度升高抑制程度越来越显著。
2.1.2 对种子发芽势影响
种子的发芽势反映种子发芽的整齐度。实验中,种子发芽率按发芽终期(72 h)时种子发芽情况计算,此时恰好是日平均发芽数达到最高日正常发芽时,因此白菜种子发芽率与发芽势绝对值相等。
珠兰鲜叶甲醇相态液不同浓度较于对照组对种子的发芽势均具抑制作用,且抑制程度与甲醇相态液浓度呈正相关关系。在处理组中,当甲醇相态液浓度处于0.2~0.4 g·mL-1时,其抑制程度急剧增加,0.2 g·mL-1与0.4 g·mL-1甲醇相态液处理组发芽势分别为25.33%、5.00%,化感指数分别为-0.694、-0.940,两者差异极显著,并且0.2 g·mL-1甲醇相态液处理组与对照组相比差异极显著,0.4 g·mL-1甲醇相态液处理组与对照组之间也存在极显著差异。当甲醇相态液浓度≥0.6 g·mL-1时,各处理组发芽势分别达到1.67%、0.67%、0,化感指数分别-0.980、-0.992、-1.000,与对照组及0.2 g·mL-1甲醇相态液处理组差异极显著,各处理组之间差异不显著,说明从甲醇相态液浓度为0.2 g·mL-1起抑制作用随甲醇相态液浓度升高加强,当甲醇相态液浓度为1.0 g·mL-1时,其抑制作用极强。以上说明在种子萌发初期,珠兰鲜叶甲醇相态液浓度对种子发芽势具抑制作用。
当珠兰鲜叶乙醚相态液浓度≤0.4 g·mL-1时,随浓度升高对白菜种子发芽势具抑制作用且抑制作用加强,各乙醚相态液处理组发芽率分别为69.33%,58.00%,化感指数达到-0.161,-0.298,与对照组差异不显著。当甲醇相态液浓度为0.6 g·mL-1时,其发芽率达到39.00%,化感指数达到-0.528,与对照组及其余处理组差异极显著。当乙醚相态液浓度为0.8 g·mL-1和1.0 g·mL-1时,各处理组发芽率分别为10.00%,9.67%,化感指数达到-0.879,-0.883,与对照组差异极显著,以上说明随浓度升高对白菜种子发芽势具抑制作用且低浓度抑制作用不显著,高浓度抑制极显著,因此低浓度提取液下,种子发芽整齐度优于高浓度下种子的发芽整齐度。
珠兰鲜叶不同梯度乙酸乙酯相态液对白菜种子发芽势整体趋势表现为逐渐增强的抑制作用。当乙酸乙酯相态液浓度为0.2 g·mL-1时,其发芽率为66.33%,化感指数达到-0.198,与对照组差异不显著。当乙酸乙酯相态液浓度为0.4 g·mL-1和0.6 g·mL-1时,其发芽率分别达到54.67%和44.00%,化感指数达到-0.339 和-0.468,与对照组差异极显著,当乙酸乙酯相态液浓度为0.8 g·mL-1和1.0 g·mL-1时,发芽率分别为32.33%,14.67%,化感指数达到-0,609 和-0.823,与对照组及其他处理组存在极显著差异。以上说明不同梯度乙酸乙酯相态液随浓度升高对白菜种子发芽势具抑制作用,且随浓度升高,种子发芽的整齐度降低。
2.2 珠兰鲜叶不同溶剂及浓度梯度提取液对幼苗生长影响
2.2.1 对幼苗根长影响
由表1,表2 可知,珠兰鲜叶甲醇相态液对白菜种子根长具抑制作用,且其抑制作用随甲醇相态液浓度升高而增强。当甲醇相态液处理组浓度为0.2 g·mL-1时,抑制指数达到-0.750,根长达到4.28 mm,与对照组存在极显著差异,与其他处理组差异不显著,各处理组之间差异均不显著。
珠兰鲜叶乙醚相态液对白菜种子根长具抑制作用,当乙醚相态液浓度<1.0 g·mL-1时抑制程度随提取液浓度升高而加强,当乙醚相态液浓度为1.0 g·mL-1时抑制程度减弱。当乙醚相态液处理组浓度为0.2 g·mL-1时,根长达到12.53 mm,与对照组存在显著差异。当乙醚相态液处理组浓度为0.6 g·mL-1时,根长达到8.75 mm,与对照组存在极显著差异,乙醚相态液浓度>0.6 g·mL-1的各处理组与对照组均存在极显著差异,各处理组之间差异不显著。
珠兰鲜叶不同浓度梯度乙酸乙酯相态液对白菜种子发芽整体趋势表现为逐渐增强的抑制作用。当乙酸乙酯相态液浓度为0.2 g·mL-1时,化感指数达到-0.259,根长为12.67 mm,与对照组存在极显著差异。当乙酸乙酯相态液浓度>0.2 g·mL-1时抑制程度继续随浓度升高而增强,所有乙酸乙酯相态液处理组均与对照组均存在极显著差异。
2.2.2 对幼苗茎长影响
由表1 和表2 可知,珠兰鲜叶甲醇相态液对白菜幼苗茎长具抑制作用,且其抑制作用随珠兰鲜叶甲醇相态液浓度升高而增加。当甲醇相态液浓度为0.2 g·mL-1时,与对照组存在极显著差异,当甲醇相态液浓度>0.2 g·mL-1时抑制作用随提取液浓度升高而增强,当甲醇相态液浓度达到1.0 g·mL-1时茎长为0,化感指数为-1.000,幼苗无茎生长。各甲醇相态液处理组与对照组均存在极显著差异,各处理组间差异不显著。
珠兰鲜叶乙醚相态液对白菜种子茎长具抑制作用,当乙醚相态液浓度为0.4 g·mL-1时抑制作用减弱,当乙醚相态液浓度>0.4 g·mL-1时抑制作用随提取液浓度升高而加强,乙醚相态液浓度为1.0 g·mL-1时抑制作用减弱。当乙醚相态液提取液浓度为0.6 g·mL-1时与对照组差异显著,乙醚相态液浓度为≥0.8 g·mL-1时与对照组存在极显著差异。乙醚对幼苗茎长的抑制作用表现为上升的波状曲线,在浓度为0.4 g·mL-1与浓度为1.0 g·mL-1时抑制作用均减弱。
珠兰鲜叶不同浓度梯度乙酸乙酯相态液对白菜种子茎长表现出抑制作用。当乙酸乙酯相态液浓度分别为0.4 g·mL-1和0.6 g·mL-1时,茎长分别为4.17 mm和4.54 mm,即在乙酸乙酯相态液浓度为0.6 g·mL-1时抑制作用减弱。当乙酸乙酯相态液浓度为1.0 g·mL-1时,化感指数达到-0.621,与对照组差异极显著,抑制作用表现为随浓度升高而增强,各乙酸乙酯相态液处理组与对照组差异均不显著,且各处理组之间差异不显著。

表1 珠兰鲜叶提取液对白菜种子萌发及幼苗生长影响Table 1 Effects of fresh leaves extract of Chloranthus spicatus(Thunb.)Makino on seed germination and seedling growth of Chinese cabbage
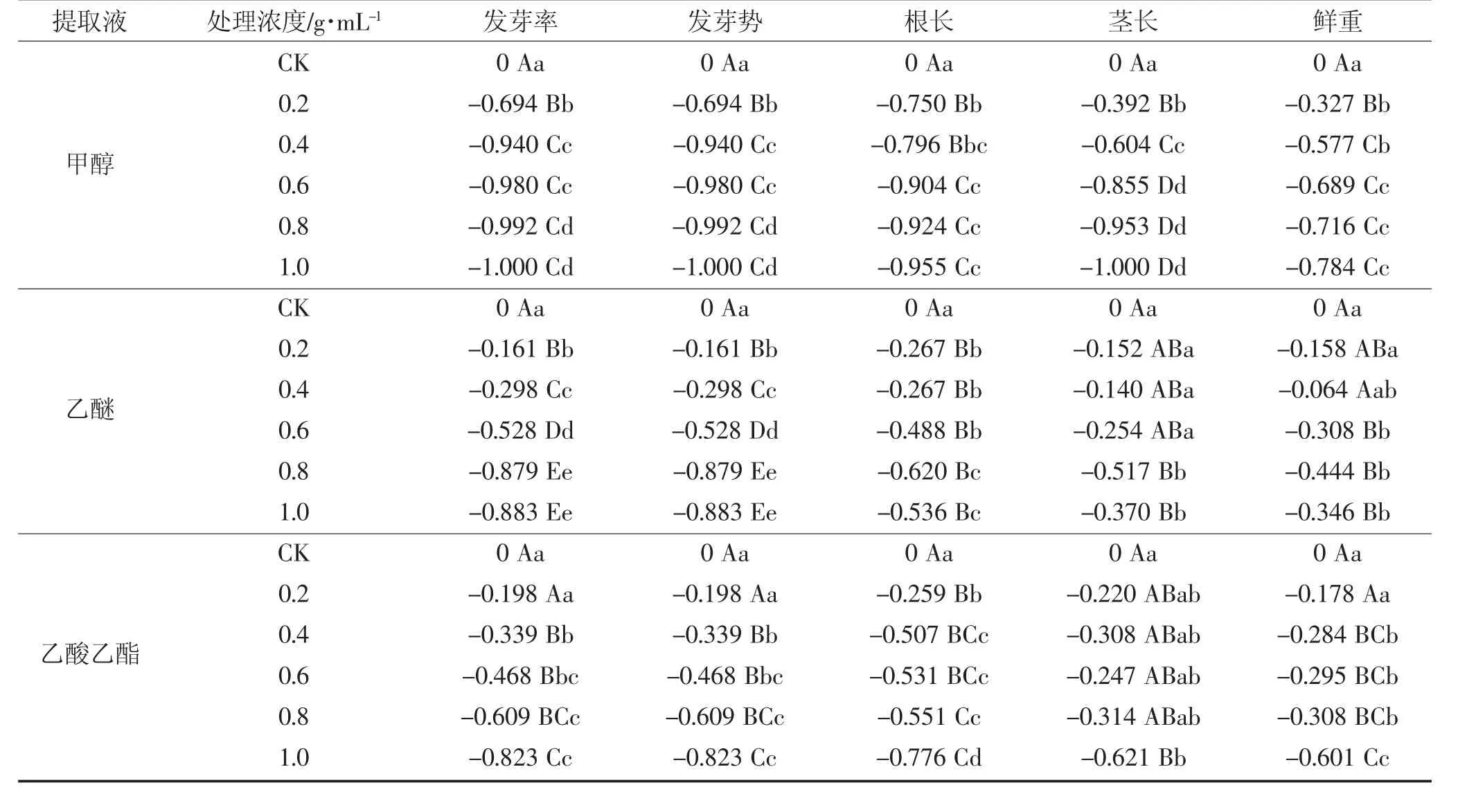
表2 珠兰鲜叶提取液对白菜种子萌发及幼苗生长影响化感指数差异Table 2 Allelopathic index of the extract of fresh leaves of Chloranthus spicatus(Thunb.)on the germination of chinese cabbage seeds and the growth of seedlings
2.2.3 对幼苗鲜重影响
由表1,表2 可知,珠兰鲜叶甲醇相态液对白菜种子鲜重具抑制作用,且其抑制作用随甲醇相态液浓度升高而增加。当甲醇相态液浓度为0.2 g·mL-1时,化感指数为-0.327,鲜重达到0.008 8 g,与处理组存在极显著差异。各甲醇相态液处理组与对照组均存在差异性显著,各处理组间差异不显著。
珠兰鲜叶乙醚相态液对白菜种子鲜重具抑制作用,当乙醚相态液浓度为0.4 g·mL-1时抑制作用减弱,浓度>0.4 g·mL-1时抑制作用随提取液浓度升高而加强,浓度为1.0 g·mL-1时抑制作用减弱。浓度>0.4 g·mL-1的各处理组与对照组差异极显著,浓度<0.4 g·mL-1处理组与对照组差异不显著。乙醚对幼苗鲜重的抑制作用表现为上升的波状曲线,在浓度为0.4 g·mL-1与浓度为1.0 g·mL-1时抑制作用均减弱。
珠兰鲜叶不同浓度梯度乙酸乙酯相态液对白菜种子鲜重抑制作用,各处理组化感指数分别达到-0.178,-0.284,-0.295,-0.308,-0.601,表现为其抑制作用随乙酸乙酯相态液浓度升高而增加。乙酸乙酯相态液浓度为0.2 g·mL-1处理组与对照组差异不显著,0.4,0.6 g·mL-1与0.8 g·mL-1处理组与对照组差异显著,1.0 g·mL-1处理组与对照组差异极显著。
3 结论与讨论
植物化感作用指植物通过挥发、淋浴、分解和分泌方式产生化感物质从而对周围植物生长产生影响的生态学现象,如蕨类的落叶中含有阿魏酸和咖啡酸等酚类物质,强烈抑制周围环境中的草本植物生长[8];油蒿通过释放化感物质使周围一年生植物无法生长[23];紫花苜蓿对自身种子生长抑制作用随其浸提液浓度升高而增强[24]。化感物质通常为高分子化合物,以酯键形态存在于土壤-植物体系中,其种类繁多,但最常见的化感物质主要为酚酸类物质[16-25],且由于酚类化感物质具有水溶性特征,因此很容易在自然条件下被雨雾淋溶而进入土壤中。化感物质常通过调控种子的萌发机制,包括破坏种子细胞结构,抑制胚的生长,影响种子萌发的代谢途径,干扰种子活性氧的含量等[26],来达到抑制种子萌发和幼苗生长的效应。在正常生理下,植物的活性氧的产生和消除处于动态平衡[27],植物体具保护酶系统,处于逆境时通过POD、SOD、CAT 等保护酶清除植物体内有害的活性氧自由基[26]。幼苗受到提取液中化感物质的胁迫,导致其POD、CAT 等保护酶含量增加而消除植物体内过度活性氧自由基含量,避免细胞过氧化[27]。
研究表明,许多植物浸提液的浓度对于其他植物生长具“高抑低促”的现象,如白三叶根系分泌物对禾本科草坪草的影响[28]、白三叶腐解液对禾本科草坪草的影响[29]、白桦各器官水浸液对落叶松种子胚根的影响[15]、桉树叶水浸提液对绿豆种子的萌发影响[30]等。而实验不同溶剂提取的珠兰鲜叶提取液对种子及幼苗的各生长形态指标均表现出不同程度的抑制作用,并且抑制程度与浸提液浓度成正比,而并没有表现出促进作用,这与卢彪儒[31],李悦[32],沈洁[33]等的研究结果一致。推测该原因是珠兰叶片相较于植物体其他部位在提取液中水溶性的化感物质较多[34],高浓度的提取液对种子的萌发及幼苗的生长产生显著的抑制作用[27],若降低提取液的最低浓度,则可实现提取液对种子萌发及幼苗生长的促进作用。
研究表明,不同植物的不同溶剂萃取组分的化感效应表现有所差异。在实验中,珠兰鲜叶不同溶剂提取液对白菜种子萌发及幼苗生长均具有抑制作用,且甲醇相态提取液抑制作用表现最强,在浓度为1.0 g·mL-1时,白菜种子发芽率发芽势和幼苗茎长化感指数达到-1.000,根长化感指数达到-0.955,鲜重化感指数达到-0.784,表明珠兰鲜叶中化感物质主要出现在甲醇相态提取液中,这与百合根系分泌物化感效应[35]结果相似。这是由于不同的有机溶剂的极性存在差异,并且所萃取的化感物质的种类和极性也存在差异[36],并随溶剂的极性增强而增强,因此不同溶剂提取液所萃取的化感物质种类和极性不同,导致最终表现的化感效应有所差异。
不同溶剂珠兰鲜叶提取液对白菜种子的发芽率、发芽势均具抑制作用,这可能与化感物质通过调控细胞伸长与分裂来阻止胚根伸长[14]有关。不同溶剂珠兰鲜叶提取液对白菜幼苗根长抑制程度均大于茎长,这可能由于胚根首先接触提取液,因此胚根细胞的分裂和伸长受抑制导致幼苗生长受抑制,这与霍鸿浩等[37]研究结果一致。
化感作用的作用方式是通过植物、微生物与土壤间相互作用而产生的结果,在农业中间作、混作、套作等复合种植模式具有重要作用并得到广泛应用。化感作用随生物技术的发展逐渐得到重视与认同,并随研究深入进一步认识。在农业生产中可通过控制提取液质量浓度来制得生长调节剂[38]。实验为室内试验,种子及幼苗生长环境如水分、温度、光照等条件均严格设置,避免了自然环境的一些因素如土壤、大气等。然而实际中植物生长环境错综复杂,因此如何利用化感效应来进行农作物之间合理有效的间作措施,仍有待进一步研究。
