卵巢癌患者外周血Treg细胞检测及临床意义*
2020-06-15李晗赵枰曹兴建陈相南通市第一人民医院检验科江苏南通226001
李晗,赵枰,曹兴建,陈相(南通市第一人民医院检验科,江苏南通 226001)
免疫功能低下可能是肿瘤发生关键的内因,而机体的细胞免疫功能状态发挥了重要作用。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是近年来研究较多的具有免疫抑制功能的T细胞亚群,能抑制T细胞对自身抗原的免疫应答,在肿瘤的免疫逃逸中发挥着重要的作用[1-2]。多项研究显示,在包括卵巢上皮性癌在内的多种肿瘤患者外周血和肿瘤组织中Treg细胞的比例显著升高[3-4]。本研究通过检测卵巢癌患者外周血标本中免疫细胞亚群与Treg细胞的变化,并结合患者的临床病理参数进行分析,以期探讨其临床应用价值。
1 资料与方法
1.1一般资料 选取2017年6月至2019年3月于南通市第一人民医院妇产科门诊就诊的卵巢癌初治患者48例,年龄47~72岁,中位年龄56岁。纳入标准:(1)所有病例均经本院2位高年资病理医师依据2104年WHO卵巢癌组织学分类标准诊断为乳腺癌;(2)所有病例均无感染、血液病、免疫系统疾病、妇科其他疾病及其他系统恶性肿瘤;(3)既往无卵巢相关手术史及半年内未接受过其他手术治疗;(4)均可查阅到完整的临床资料。其中浆液性腺癌29例、黏液性腺癌16例、其他上皮性卵巢癌3例;FIGO临床分期:Ⅰ~Ⅱ期17例,Ⅲ~Ⅳ期31例;分化程度:低分化29例,中分化11例,高分化8例。选取同期就诊的体检健康者30例作为健康人对照组,年龄44~70岁,中位年龄56岁。两组间年龄差异无统计学意义(P>0.05)。
1.2仪器与试剂 CD3-FITC/CD16+CD56-PE/CD45-PerCP/CD19-APC、CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC(北京同生时代生物公司);CD4-FITC、CD25-PE、IgG1-FITC、IgG1-PE及FACS Calibur流式细胞仪(美国BD公司);电化学发光全自动免疫分析系统Cobas e601及其CA125配套试剂(瑞士Roche公司);Ficoll淋巴细胞分离液(天津灏洋华科生物科技公司)。
1.3方法
1.3.1标本采集 所有患者于手术前采集空腹静脉血5 mL,其中2 mL经EDTA-K2抗凝,混匀,1 h内进行淋巴细胞亚群检测;其余3 mL经3 000×g离心10 min,收集血清标本,2 h内送检。
1.3.2淋巴细胞亚群检测 取2个流式管,分别加入50 μL全血标本,再加入20 μL相应荧光素标记抗体试剂(CD3-FITC/CD16+CD56-PE/CD45-PerCP/CD19-AP和CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC),涡旋混匀3 s,室温避光反应15 min,加入1 mL溶血剂,涡旋混匀10 s,室温避光温育10 min,加入4 mL细胞染色缓冲液洗涤,500×g离心5 min,弃去上清液(剩余200 μL),涡旋混匀3 s,重复洗涤1次,加入200 μL细胞染色缓冲液重悬,上流式细胞仪检测,采用Multiset软件获取数据并自动分析。
1.3.3Treg细胞检测 采集患者术前外周血4 mL,肝素抗凝,混匀备用。按照Ficoll淋巴细胞分离液说明书提取单个核细胞,加入溶血剂200 μL以溶解红细胞,混匀10 s,室温避光温育10 min,500×g离心5 min,弃上清液,加入4 mL PBS洗涤,500×g离心5 min,弃上清液,加入200 μL PBS,涡旋混匀3 s,取100 μL加至流式管底,分别加入CD4-FITC、CD25-PE单克隆抗体(1∶50稀释)各20 μL,同型对照IgG1-FITC、IgG1-PE(1∶100稀释)各20 μL,涡旋混匀3 s,室温避光反应25~30 min,500×g离心5 min,弃上清液,加入4 mL细胞染色缓冲液洗涤,500×g离心5 min,弃上清液,加入400 μL细胞染色缓冲液重悬,上机检测。
1.3.4血清CA125检测 取上述患者血清500 μL,按照电化学发光全自动免疫分析系统Cobas e601及其CA125配套试剂说明书检测血清CA125的表达水平。CA125参考范围:0~35 U/mL。

2 结果
2.1各组淋巴细胞亚群及Treg细胞的表达 与健康人对照组相比, 卵巢癌患者外周血Treg细胞占CD4+T淋巴细胞的比率明显升高(P<0.01),且CD3+、CD4+T淋巴细胞及CD4+/CD8+比值均升高(P均<0.01),而CD16+CD56+NK细胞表达水平显著降低(P<0.01),见表1。


组别健康人对照组 卵巢癌组tP值CD3+66.10±9.2880.10±11.89∗-5.4880.000CD4+32.70±5.7148.94±11.70∗-8.1780.000CD8+33.23±8.1432.50±11.540.3040.762CD4+/CD8+1.04±0.291.76±0.83∗-5.4440.000CD16+CD56+NK21.27±10.189.08±4.82∗6.1390.000CD19+12.63±4.4310.81±12.180.7850.435Treg9.92±3.0613.10±5.19∗-3.4000.001
注:*,与健康人对照组比较,P<0.05。
2.2Treg细胞/CD4+T淋巴细胞含量与卵巢癌患者临床病理参数的关系 卵巢癌患者外周血中Treg细胞占CD4+T淋巴细胞的比率与患者年龄、组织类型、肿瘤大小、淋巴结转移与否及是否合并CA125升高均无统计学意义(P>0.05),而与患者FIGO分期、细胞分化及是否存在腹水差异有统计学意义(P<0.05),见表2。

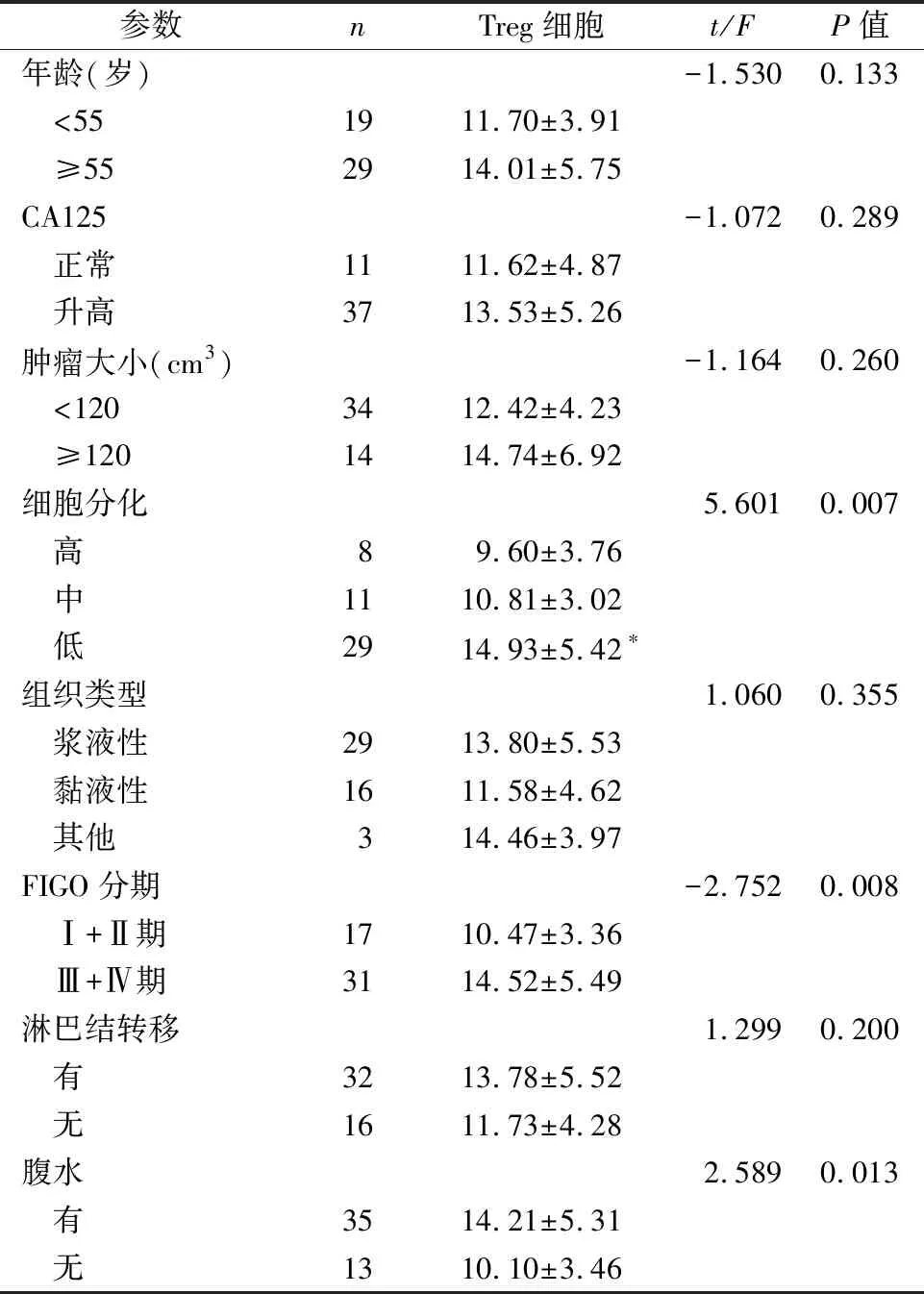
参数nTreg细胞t/FP值年龄(岁)-1.5300.133 <55 1911.70±3.91 ≥552914.01±5.75CA125-1.0720.289 正常1111.62±4.87 升高3713.53±5.26肿瘤大小(cm3)-1.1640.260 <120 3412.42±4.23 ≥120 1414.74±6.92细胞分化5.6010.007 高89.60±3.76 中1110.81±3.02 低2914.93±5.42∗组织类型1.0600.355 浆液性2913.80±5.53 黏液性1611.58±4.62 其他314.46±3.97FIGO分期-2.7520.008 Ⅰ+Ⅱ期1710.47±3.36 Ⅲ+Ⅳ期3114.52±5.49淋巴结转移1.2990.200 有3213.78±5.52 无1611.73±4.28腹水2.5890.013 有3514.21±5.31 无1310.10±3.46
注:*,与高、中分化比较,P<0.05。
3 讨论
Treg细胞是Sakaguchi等[5]在1995年发现的,是T淋巴细胞群体中的一种特殊类型。区别于TH1、TH2以及其他具有免疫调节功能的T淋巴细胞群体,Treg细胞具有免疫调控、免疫自稳及免疫抑制功能,并参与多种疾病的发生、发展过程[6]。在介导肿瘤细胞免疫逃逸的过程中,Treg细胞在维持对自身成分(肿瘤抗原)耐受的同时,能够有效阻止机体对肿瘤细胞的免疫应答。Treg细胞主要通过细胞接触依赖性机制、分泌抑制性细胞因子以及干扰细胞代谢影响效应细胞的功能等机制发挥免疫作用[7-10]。
本研究发现,卵巢癌患者外周血CD16+CD56+NK细胞比率明显降低,提示患者免疫细胞中自然杀伤肿瘤细胞的功能低下;而CD4+T淋巴细胞比率较健康人对照组明显升高,这一结果与赵艳勋等[11]研究结果存在较大的差异。分析原因可能与赵艳勋等[11]在其实验中仅考虑T淋巴细胞亚群的比率有关,柯星等[12]的研究结果亦证实卵巢癌患者外周血中Treg细胞占CD4+的细胞比率明显升高,即CD4+T细胞中具有免疫抑制性的Treg细胞增多,可抑制其他细胞亚群的活化和功能发挥,参与自身免疫耐受和肿瘤细胞免疫逃逸等过程。
本研究通过分析Treg细胞占CD4+T淋巴细胞比率与卵巢癌患者临床病理参数的关系发现显示,Treg细胞/CD4+T淋巴细胞比率含量与卵巢癌患者的年龄、肿瘤大小、组织类型、淋巴结转移与否以及是否合并血清CA125升高等无明显相关性,而和患者的肿瘤细胞分化程度、FIGO临床分期以及是否合并腹水密切相关,提示卵巢癌外周血Treg细胞与肿瘤进展相关,这与戴然等[2]的研究结果相一致。Treg细胞与卵巢癌的病程进展相关,随着肿瘤细胞生长活跃,可诱导机体产生的Treg细胞比率升高,机体发挥抗肿瘤的免疫效应细胞活性被抑制,免疫应答减弱,有利于肿瘤细胞的免疫逃逸。然而,本研究并未分析Treg细胞在肿瘤进展过程中的具体作用机制,今后需要进一步研究证实。
综上所述,检测外周血淋巴细胞亚群有助于了解肿瘤患者的机体细胞免疫状况,监测外周血Treg细胞有利于评估卵巢癌患者的病情进展。对Treg细胞的功能特征及调节机制的进一步研究可能为卵巢癌免疫治疗提供有效的治疗靶点。
