松嫩平原异质生境芦苇的表观遗传多样性和结构
2020-06-15邱天
邱 天
(1. 长春师范大学 生命科学学院, 长春 130032; 2. 东北师范大学 植被生态科学教育部重点实验室, 长春 130024;3. 东北师范大学 分子表观遗传学教育部重点实验室, 长春 130024)
芦苇(Phragmitesaustralis(Cav.) Trin. ex Steud.)是一种分布广泛的湿地禾草,营养繁殖能力强,经常出现在河湖岸边的沼泽,也分布在旱地生境和其他承受着非生物胁迫的地区[1-2]。它丰富的表型变异、遗传上高度的变异性以及灵活的繁殖对策使其成为世界性物种,在中国东北的松嫩平原上也广泛分布。在碱化草甸上经常作为伴生种生长,但在局域低洼地或碱斑上能形成单优种群落[3]。由于高产和高蛋白含量,它是松嫩平原主要的饲草之一。芦苇具有多年生根茎系统和对天然胁迫环境较强的适应性,因此能保留土壤养分,在生态修复方面具有重要的应用价值[4]。
在研究多年生物种的分子生态学问题时,常采用基因组扫描方法,应用扩增片段长度多态 (Amplified fragment length polymorphisms, AFLPs)研究种群遗传多样性是众多方法中最有效的方法之一[5-7]。这种分子标记已经用于短芒野大麦(Hordeumbrevisubulatum)[8]、羊草(Leymuschinensis)[5]、虎杖(Fallopiajaponica)[9]、空心莲子草(Alternantheraphiloxeroides)[10]、藏菠萝花(Incarvilleayounghusbandii)[11]和堇菜属植物(Violacazorlensis)[12]等物种的研究中。在最初AFLP技术基础上加以改良,即应用毛细管电泳的荧光AFLP标记方法,由于其分辨率高、敏感性高以及所需样本量少而成为一种有效、可靠的技术手段[13]。
在松嫩平原多种生境上生长的芦苇表现出容易辨别的不同表型特征,包括叶片、根茎、苗的形态和生物量等方面[4,14]。我们关注于多种生境中的两种。生境1(记为H1)是有季节性积水的低洼地,土壤为碱化草甸土,pH 8~8.5;生境2(记为H2)是没有季节性积水的光碱斑,pH大于10。近50年来松嫩平原严重的土壤盐碱化和植被退化导致草地上多种生境呈镶嵌体形式存在,而H1和H2是其中的两种。
关于松嫩平原芦苇遗传多样性的初步调查表明,跨越一定地理范围的芦苇存在广泛的遗传变异[3]。除了序列变异,表观遗传机制能够引起生态上相关的形态特征变异,其能被环境直接干扰而且遗传给下一代,因此它是生物个体对环境响应的一种重要的机制。DNA甲基化变异是迄今研究最多的表观遗传机制,在植物中可遗传。然而迄今为止,只有少量实验应用MSAPs(Methylation-sensitive amplified polymorphisms,即甲基化敏感的AFLPs)研究天然植物种群的甲基化变异[6],在小空间尺度上的研究更少[15-16]。鉴于此,作者在大致10 km×5 km范围内对两种生境的芦苇植株进行DNA水平的研究,分析了其表观遗传多样性和结构。
1 材料与方法
1.1 研究生境的自然概况和材料取样
材料来自于松嫩平原吉林省长岭县东北师范大学草地科学研究站内(123°45′E, 44°45′N)。该区域属于温带半干旱、半湿润季风气候。两种芦苇分布在土壤含水量和pH值不同的生境里。在H1中,土壤是碱化草甸土,pH 8~8.5,在雨季有季节性积水。单优种芦苇群落由于有充分的水分供应而高大茂盛,群落盖度85%以上。在H2中,碱斑土壤板结,表层土完全丧失,pH值大于10。植株矮小,零星地呈丛分布,形成单优种群落,群落盖度小于20%。每种生境的芦苇由于多种生境呈镶嵌体形式存在而分布广泛。在大致10 km×5 km研究范围内,随机采集每种生境20个个体,它们位于研究站的西部、中部和东部,即每种生境3个种群。所有个体至少间隔30 m,以避免采集同一基株。H1和H2每个采样地点的个体数分别是6、7、7和7、6、7,最小化芦苇采集量对局域土壤的影响是一个考虑因素。叶片用充足的硅胶干燥后储存在-20 ℃备用。
1.2 MSAP表观遗传印记
应用改良的CTAB法提取基因组DNA[17-19]。在标准的AFLP基础上,有少量技术改进[17-19],包括应用荧光标记选择性引物和96道毛细管的ABI-automated 3730XL基因分析仪。通过筛选得到能提供最可靠谱带的引物,引物序列参见文献[20]。MSAP和AFLP的操作一致,只是MspⅠ或HpaⅡ取代了MseⅠ,MspⅠ和HpaⅡ能够识别相同的5′-CCGG位点但对甲基化的敏感性不同。ROX500 Marker (Applied Biosystems) 用于每一个样本。应用软件GeneMapper v.4.1收集、记录原始数据。通过两次独立的AFLP分析,只记录重复性好的谱带,并用二进制数记录,即“0”代表无带而“1”代表有带。所有样本只有一条不一致谱带的情况不记。只记录大于等于100 bp的谱带。MSAP谱带有3种不同的类型:1)EcoR I/HpaII和EcoR I/MspI酶切扩增产物中均有带;2)EcoR I/HpaII和EcoR I/MspI酶切扩增产物中均无带;3)仅EcoR I/HpaII 或EcoR I/MspI酶切扩增产物中有带。类型(1)代表非甲基化状态,类型(3)代表甲基化状态,类型(2)代表序列突变或甲基化增加,记为缺省值。根据MspI和HpaII不一致情况的比率是否超过误差引起不一致的比率,将每个位点分为“甲基化敏感的位点”(Methylation susceptible loci, MSL)或“甲基化不敏感的位点”(Non-methylated loci, NML)[21]。在样本情况未知的情况下进行记带和统计。
1.3 数据分析
应用R软件中的msap软件包分析MSAP结果[22]。应用Popgene 1.32软件得到生境的多态位点百分比(P)和香浓维纳信息指数(I)数据[23]。应用GENALEX 6.5(999 random permutations)进行分子方差分析(AMOVA),将方差分解为生境间、种群间以及种群内成分用以评价表观遗传结构[24]。
2 结果与分析
2.1 表观遗传多样性
在938个MSAP位点中,633个是甲基化敏感位点(MSL),其中71.09%~88.38%是多态位点;305个位点是甲基化不敏感位点(NML),81.82%~88.12%是多态位点。记带误差率较低,在2.9%以下(表1)。在生境内水平,H1和H2中分别有12.33%、11.31%的甲基化敏感位点(MSL)是外侧胞嘧啶半甲基化的,14.14%、14.69%的位点是内侧胞嘧啶甲基化的,18.6%、19.38%是未甲基化的,以及其余的54.93%、54.63%是全甲基化或由于序列突变而缺乏限制性酶切位点的。由此可见两种生境内侧胞嘧啶甲基化的比率均高于外侧胞嘧啶半甲基化的比率。H1外侧胞嘧啶半甲基化的水平比H2的高约1%,H2的内侧胞嘧啶甲基化水平比H1的高约0.5%,可以确定总甲基化水平H1比H2略高。而H2的未甲基化情况的比率高于H1的。所有位点中,H1和H2分别有82.75%和79.93%位点是多态的,香浓维纳信息指数(I)分别是0.3712和0.358,可见H1高于H2(表2)。
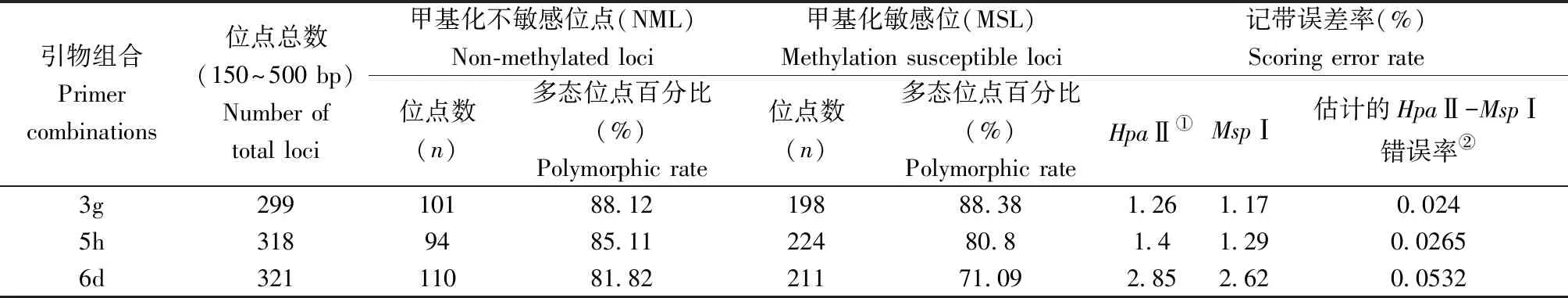
表1 MSAP各引物组合下扩增位点的表观遗传多样性信息
注:①记带误差率=(100×两次独立分析中不一致的标记数)/(标记数×个体数)。②不一致的EcoR I-HpaII 和EcoR I-MspI标记的平均可能性=eHpa+eMsp-2×eHpa×eMsp,其中eHpa和eMsp为记带误差率
Note: 1)The scoring error rates were calculated as 100×(number of inconsistent scores in two independent analyses)/(number of markers×number of individuals).2) Estimated average probability of receiving inconsistentEcoR I-HpaII andEcoR I-MspI scores was calculated as eHpa+eMsp-2eHpaeMspfrom the scoring error rates eHpaand eMsp
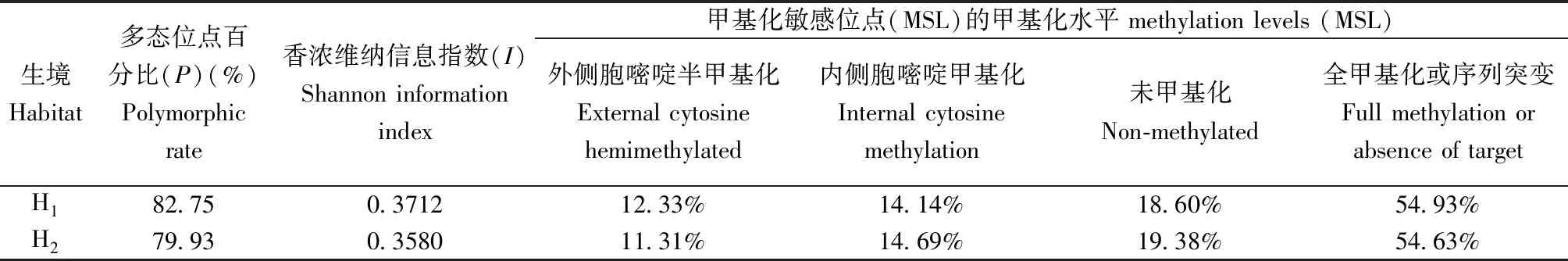
表2 2种生境芦苇的表观遗传多样性参数和甲基化水平
2.2 表观遗传结构
Hierarchical AMOVA表明生境间表观遗传分化达到极显著水平(P<0.01),它解释了1.75%的总体分子方差,2.67%归因于生境内种群间的极显著分化(P<0.01),95.57%归因于种群内极显著分化(P<0.001)。种群表观遗传分化的量度PhiPT,与FST类似,值为0.044(表3)。
3 讨论与结论
迄今为止,有关评价野生植物种群的表观遗传变异的范围和结构的报道还很少。DNA甲基化变异可以遗传,影响植物表型甚至进化。本文研究分析了芦苇在两种生境DNA甲基化,结果发现植株存在广泛的DNA甲基化,约2/3的MSAP位点是甲基化敏感位点(MSL),约1/3的位点是甲基化不敏感位点(NML)。MSL中多态位点所占的百分比较高,这与紫罗兰Violacazorlensis的研究报道相一致[21]。高水平的表观遗传基因型变异可能会带来更多的表型和进化灵活性,甚至影响物种的分布。在美国缅因州,入侵种芦苇比本地种的表观遗传变异更多就例证了这一点[16]。本文发现了广泛的生境内方差,这是由个体变异所致,单独个体的表观遗传变异是植物发生微进化的先决条件[21]。
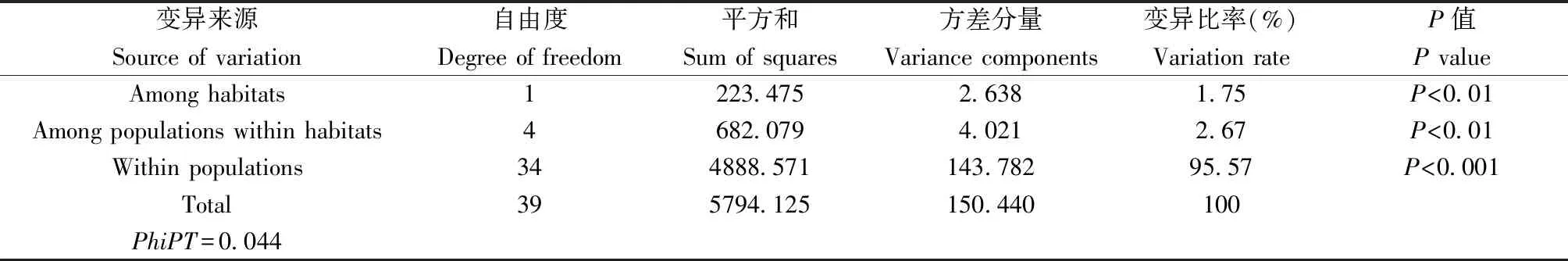
表3 基于MSAP谱带的芦苇不同生境间和生境内的AMOVA结果(生境内按地理位置分3个种群)
本文还发现了两种生境之间明显的表观遗传分化。由于表观遗传修饰能在变化的环境中改变基因表达,进而改变表型,而又不依赖遗传变异,这可能解释了不同生境芦苇表型不同的原因。此外,分子方差结果表明,天然芦苇的表观遗传变异能够分成生境间和生境内不同的组分。
H1的表观遗传多样性参数的值均高于H2的值,这与生境幅度变异假说一致[25]。即如果种群所在的生境范围更广阔、更加多样,如H1,会比生境范围狭窄的种群如H2的变异更多。
关于特定表观遗传位点类型是仅仅作为遗传变异的下游产物,还是独立于遗传变异,仍然是一个亟待解决的问题。本文中表观遗传变异的类型可能是遗传变异导致的,也可能与生物体应对异质生境发生分化有关。尽管基因组重组和遗传突变推动着生物体长期的进化,而表观遗传修饰也能使局域环境中的生物更快、更灵敏地适应变化的环境[26]。
总之,本研究结果有助于人们对小空间尺度上局域生境芦苇的表观遗传基础的深入理解。芦苇基因组MSAP标记的数据将为生态适应性理论研究和包括生态修复、遗传改良在内的保护和应用研究,提供有价值的参考。
