基于美拉德反应的鳕鱼过敏蛋白消减技术研究
2020-06-13郑建仙邓雯婷
周 丹 郑建仙 - 邓雯婷 -
(华南理工大学食品科学与工程学院,广东 广州 510640)
鳕鱼是常见的可食用海水鱼类之一,其鱼肉雪白,肉质嫩滑且营养丰富[1]。研究[2-3]表明,疑似食物过敏儿童患者鳕鱼IgG抗体检测阳性率仅次于牛奶和鸡蛋,食物过敏患者鳕鱼IgG抗体检测阳性率仅次于蟹、虾和鸡蛋。鱼类过敏会引发不同程度的反应,如口腔过敏、腹痛、腹泻、呕吐、过敏性休克等症状[4]。鳕鱼的主要过敏原为小清蛋白(PV),其分子量为10~12 kDa,稳定性极强[5-6]。
目前,食品过敏原消除技术主要有热处理[7]、蛋白酶水解[8]、超高压[9]等。Sletten等[10]利用腌制、烟熏等化学处理方法,降低了鱼过敏原的IgE结合能力,但会产生具有IgE结合能力的新蛋白和亚硝胺等有害物质。李振兴等[11]研究表明,经热蒸加工后,大菱鲆鱼蛋白质与lgE结合能力减弱,但会出现一个新的8 kDa的蛋白与IgE结合。董晓颖等[12]发现用风味蛋白酶和中性蛋白酶处理后的虾过敏原其致敏性几乎消失,但会破坏水产品性状,产品应用面窄,难以大范围推广。陆海霞等[13]发现超高压可以使鱿鱼肌动蛋白、肌球蛋白重链等聚集交联,但这种交联也有可能暴露IgE结合位点;此外,超高压技术只能改变蛋白质空间结构,不能改变一级结构,而且运行成本昂贵。
美拉德反应通过糖基修饰过敏原,改变或破坏过敏原的抗原表位,进而降低其致敏性[14-15]。李庆丽等[16]发现麦芽糖可使虾过敏原的免疫活性降低60%。李铮[17]用还原糖和纯化后草鱼小清蛋白反应,发现小清蛋白致敏活性也显著降低。美拉德反应是少数可以在生产中实现的海水鱼过敏原消除技术,目前尚未见利用美拉徳反应消除鳕鱼中过敏原的报道。美拉德反应会产生大量成色物质,使产品感官变差[18]。
试验拟以鳕鱼为试验对象,探究不同还原糖、热处理温度以及加工方式对脱除小清蛋白效果的影响,并应用于鳕鱼的低致敏性加工工艺中,以期为低致敏性的、健康的海水鱼食品的工业化生产提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
鳕鱼:市售;
Maker:无锡浮云生物技术有限公司;
明胶:西格玛奥德里奇(上海)贸易有限公司;
三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、丙烯酰胺:国药集团化学试剂有限公司;
IgG抗蛙小清蛋白单克隆抗体(PARV-19)、HRP 标记的羊抗小鼠 IgG 抗体:自制;
其他试剂均为国产分析纯。
1.1.2 主要仪器与设备
冻干机:GIPP-5000FDA型,美国Labconco公司;
电泳仪:DYY-6C型,北京市六一仪器厂;
分光光度计:UV-2100型,上海尤尼柯仪器有限司;
凝胶成像仪:Gel Doc XR+型,南京溯远基因科技有限公司。
1.2 方法
1.2.1 小清蛋白(PV)的热提取 称取20 g鳕鱼于烧杯中,加入180 mL PBS溶液,电动搅拌15 min,100 ℃水浴10 min,冷却,离心,上清液倒于培养皿,用扎有一定密度小孔的保鲜膜封住,冷冻干燥12~24 h,得小清蛋白粗提物,从培养皿内刮取备用[19-20]。
1.2.2 还原糖种类优化 参考蔡秋凤等[19]的方法修改如下:准确称量质量比为1∶1∶1的葡萄糖、木糖和果糖溶解于2 mL水中(还原糖质量为12.5 mg)备用。准确称取50 mg热提粗蛋白,加入2 mL水溶解,加糖溶液,100 ℃水浴30 min,得美拉德反应产物(MRPs),测定其PV含量。
1.2.3 美拉德反应温度优化 参考杨汝晴[20]的研究方法修改如下:准确称取1.2.2中消除效果最好的还原糖12.5 mg溶于1 mL温水中,备用;准确称取蛋白粗提物50 mg溶解,完全溶解后加糖溶液,控制样品体积为4 mL。于60,85,100,121,170 ℃下恒温反应,得不同反应条件下的MRPs,测定其PV含量。
1.2.4 还原糖加入方式优化
(1) 注射法:取长、宽、高分别约为5,2,3 cm块状鱼肉20 g,取1.2.2中消除效果最好的还原糖0.5 g配成1 mL的糖溶液,用微量注射器在鱼肉的长、宽表面上每3 cm3注射一次,放置2 h,使用最优温度恒温反应30 min,得美拉德反应产物。参照1.2.1提取小清蛋白,并测定其含量。
(2) 腌制法:操作步骤同(1),将还原糖的添加方式由注射改成“直接添加,腌制2 h”。
1.2.5 美拉德反应消除小清蛋白的应用
(1) 改良工艺:鱼去鳞、去内脏,洗净,晾干。取鱼肉500 g,加入花椒50 g、辣椒粉65 g、酱油50 g,盐300 g。取1.2.2筛选的还原糖2.5 g配成溶液,使用最优加工方式加入,腌制6 h后洗净,最优温度处理2 d,即得鱼干,提取小鱼干的小清蛋白,并测定其含量。
(2) 传统工艺:不加入糖溶液直接温度处理,其他操作步骤同1.2.5(1)。
1.2.6 PV含量分析
(1) SDS-PAGE电泳:对MRPs进行电泳,通过Image J软件分析电泳条带,可得小清蛋白的相对含量。
(2) ELISA酶联反应:用标准小清蛋白进行酶联反应,显色后测定吸光度,绘图得标准曲线。对美拉德反应产物进行ELISA酶联反应,显色后测定吸光度,平行试验数据代入标准曲线,得MRPs中小清蛋白绝对含量[21-22]。
(3) 美拉德反应程度:取MRPs稀释5倍,测定420 nm处吸光度。
(4) 感官评价:由10人组成的感官评定小组,按表1对MRPs的色泽、气味进行评分。

表1 感官评定对应指标参考词汇Table 1 Sensory evaluation related indicators reference vocabulary
1.3 数据处理
所有试验平行测定3次,采用Excel 2016软件进行数据处理,结果以平均值±标准偏差表示。使用SPSS 22.0软件进行显著性分析。利用Image J软件进行图像处理分析。
2 结果与分析
2.1 小清蛋白粗提物的SDS-PAGE电泳
由图1可知,小清蛋白分子量为10~12 kDa,其在粗提物中的相对含量为29.71%。小清蛋白热稳定较好,热提取对其性质无影响,但会使部分其他蛋白质变性。
2.2 还原糖种类筛选
2.2.1 小清蛋白相对含量 由图2可知,各泳道内的蛋白质种类较图1的少,除小清蛋白质外,其他蛋白质种类依然较多,且小清蛋白条带并未消失,热提取并不能完全消除小清蛋白,但能使部分其他蛋白变性。木糖、葡萄糖、果糖美拉德反应产物中的小清蛋白相对含量分别为19.6%,25.5%,21.3%,进一步表明相对应的还原糖对小清蛋白的消除能力大小为木糖>果糖>葡萄糖。
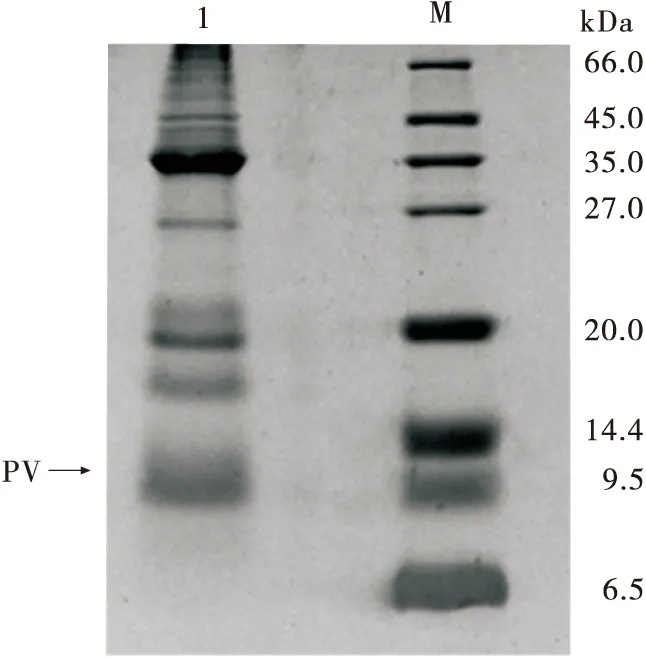
1. 小清蛋白粗提物 M. 标准蛋白Maker图1 小清蛋白粗提物电泳图Figure 1 Electrophoresis of parvalbumin crude extract
2.2.2 小清蛋白绝对含量及其他指标 由表2可知,美拉德反应越剧烈,其反应产物颜色越深,吸光度值越大;还原糖的反应程度次序为木糖>果糖>葡萄糖,对应的MRPs感官评分为60,30,30。轻度美拉德反应会产生适量成色物质及浓郁芳香,木糖与小清蛋白反应强度最高,其MRPs棕黄,感官评分最高。木糖、葡萄糖、果糖MRPs小清蛋白绝对含量分别为263,345,289 μg/mL,进一步表明相对应的糖类的消除效果为木糖>果糖>葡萄糖。

1. 木糖与小清蛋白MRPs 2. 葡萄糖与小清蛋白MRPs 3. 果糖与小清蛋白MRPs M. 标准蛋白Maker
图2 还原糖与小清蛋白反应产物电泳图
Figure 2 Electrophoresis of MRPs of reducing sugars and parvalbumin

表2 还原糖与小清蛋白反应的各项指标†Table 2 Various indicators of MRPs of reducing sugars and parvalbumin
† 同列字母不同表示差异显著(P<0.05)。
2.3 温度对消除小清蛋白的影响
2.3.1 小清蛋白相对含量 由图3可知,60,85,100,121,170 ℃美拉德反应产物中小清蛋白相对含量分别为22.2%,21.4%,19.1%,16.5%,11.2%。小清蛋白含量随温度的升高逐渐降低,且100 ℃以下小清蛋白含量的减少幅度小于100 ℃以上的,说明100 ℃以下进行的美拉德反应更温和、缓慢。
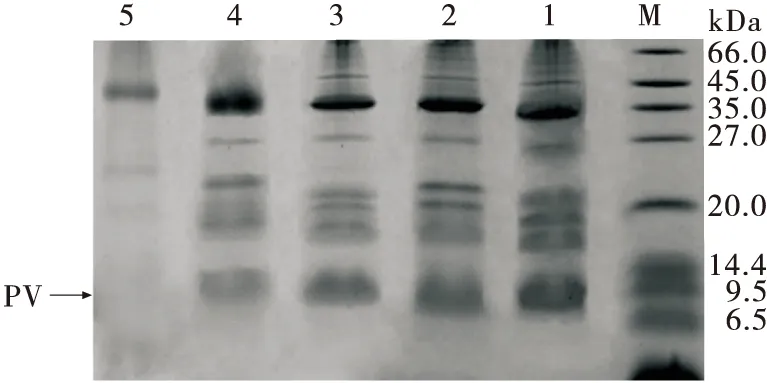
1. 60 ℃ 2. 85 ℃ 3. 100 ℃ 4. 121 ℃ 5. 170 ℃ M. 标准蛋白质Maker
图3 不同温度下木糖与小清蛋白美拉德反应产物电泳图
Figure 3 Electrophoresis of MRPs of xylose and parvalbumin at different temperatures
2.3.2 小清蛋白绝对含量及其他指标 由表3可知,随着温度的升高,MRPs吸光度逐渐升高,美拉德反应越剧烈。60,85,100,121,170 ℃下的美拉德反应产物感官评分分别为10,10,60,40,30。随着温度的升高,产物颜色呈现比较诱人的黄色,气味转变为肉酱味,但温度升高至一定程度后,MRPs颜色偏棕色,气味开始变焦,当温度为100 ℃时感官评分最高。MRPs中小清蛋白的绝对含量分别为302,291,223,185,50 μg/mL,说明随着温度的增加,小清蛋白残余量减少。综上,当温度为100 ℃时,木糖与小清蛋白的反应产物感官较好且小清蛋白含量较低。
2.4 加工方式对消除小清蛋白的影响
2.4.1 小清蛋白相对含量 由图4可知,注射加工和腌制加工的MRPs中小清蛋白相对含量分别为9.9%,16.2%,说明注射加工方式能使木糖和鱼肉反应得更加充分。注射处理的小清蛋白残余量低于腌制处理的,其MRPs小清蛋白的电泳条带更淡。

表3 不同温度下木糖与小清蛋白美拉徳反应产物的各项指标†Table 3 Various indicators of MRPs of xylose and parvalbumin at different temperatures
† 同列字母不同表示差异显著(P<0.05)。

1. 腌制加工 2. 注射加工 M. 标准蛋白质Maker图4 不同加工方式下木糖与鱼肉美拉德反应产物电泳图Figure 4 Electrophoresis of MRPs of xylose and fish under different processing methods
2.4.2 小清蛋白绝对含量及其他指标 由表4可知,注射加工的小清蛋白与木糖反应程度低于腌制加工的,两种反应产物的感官评分均为40;经注射加工和腌制加工的反应产物中小清蛋白残余量分别为134,212 μg/mL,说明注射加工的小清蛋白残余量明显少于腌制加工的。
2.5 小清蛋白消除技术对鱼干致敏性的影响
2.5.1 小清蛋白相对含量 由图5可知,泳道1,2的条带数目无明显差别,说明两种工艺条件下小鱼干的蛋白质类别均较少。传统工艺和改进工艺的小鱼干小清蛋白相对含量分别为6.08%,5.78%,说明传统工艺的小鱼干中小清蛋白较少,但经改良工艺的小清蛋白残余量低于传统工艺的。

表4 不同加工方式下木糖与鱼肉美拉德反应产物的各项指标†Table 4 Various indicators of MRPs of xylose and fish under different processing methods
† 同列字母不同表示差异显著(P<0.05)。
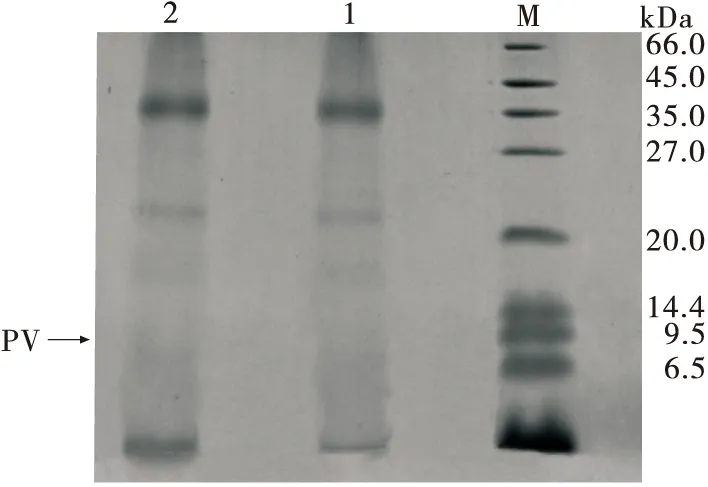
1. 传统工艺 2. 改进工艺 M. 标准蛋白质Maker图5 不同工艺下木糖与鱼肉美拉德反应产物电泳图Figure 5 Electrophoresis of MRPs of xylose and fish using different techniques
2.5.2 小清蛋白绝对含量及其他指标 由表5可知,改良工艺的美拉德反应程度低于传统工艺的,二者的感官评分无明显区别。传统工艺和改良工艺下木糖与小清蛋白MRPs中小清蛋白的绝对含量分别为81,75 μg/mL,说明改良工艺的小鱼干蛋白提取物中的小清蛋白残余量少于传统工艺的。
3 结论
利用美拉德反应,探究了还原糖种类、反应温度、还原糖添加方式等因素对消除小清蛋白效果的影响。结果表明,还原糖对小清蛋白的消除效果为木糖>果糖>葡萄糖;随着反应温度的升高,感官评分先增加后降低,小清蛋白残余量越来越少;注射加入还原糖的小清蛋白消除效果优于腌制的。低致敏性、健康的海水鱼食品生产的最优工艺参数为使用注射加工方法,于100 ℃时加入木糖,将该条件应用于鳕鱼鱼干的生产工艺中,可得到低致敏性产品。后续可探讨其他海水鱼类的脱敏技术。

表5 不同工艺下木糖与鱼肉美拉德反应的各项指标†Table 5 Various indicators of MRPs of xylose and fish MRPs using different techniques
† 同列字母不同表示差异显著(P<0.05)。
