结直肠癌中HIF-1α、CD147和MMP-9表达与临床病理特征的关系*
2020-06-12朱长龙王晓琼何常
朱长龙,王晓琼,何常
(1.贵州医科大学 临床医学院,贵州 贵阳 550025; 2.贵阳护理职业学院 基础医学部,贵州 贵阳 550081)
结直肠癌是一种常见的消化系统恶性肿瘤,在发达国家中的 发病率明显高于发展中国家,这可能与发达国家较高的肥胖率及饮食习惯等因素有关[1]。结直肠癌的病因和发病机制目前尚不完全清楚,近年来研究发现结直肠癌的发生与许多肿瘤抑制基因失活、或原癌基因活化密切相关,提示结直肠癌发生过程中经过了一系列较为复杂的分子事件。研究表明,缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)、细胞外基质金属蛋白酶诱导剂(CD147)和基质金属蛋白酶(matrix metalloproteinase ,MMP)均与肿瘤的发生、发展、转移和不良预后密切有关[2],本研究应用免疫组织化学技术标记结直肠癌组织中HIF-1α、CD147和MMP-9蛋白表达,分析这些指标与各种临床病理参数的关系,初步探讨这些指标对评估结直肠癌生物学行为的潜在关系。
1 材料与方法
1.1 材料
1.1.1标本 收集病理科2012年1-6月80例结直肠癌手术患者的临床资料,随机选取其中37例未经新辅助化疗的结直肠腺癌作为实验组,记录患者的性别、年龄,收集肿瘤的病理分级、大小、部位、浸润深度、脉管侵犯、神经侵犯、淋巴结转移及TNM分期等临床病理参数,同时选择这37例患者结直肠癌切除组织旁的正常(癌旁)组织作为对照组。
1.1.2主要试剂 Anti-HIF-1α抗体(Santa Cruz,sc-13515,单克隆抗体)、Anti- CD147抗体(Santa Cruz,sc-21746,单克隆抗体)、Anti-MMP-9抗体(Santa Cruz,sc-21733,单克隆抗体)和免疫组化二抗EnvsionTM由上海基因有限公司提供。
1.1.3纳入和排除标准 纳入标准按照2003版WHO结直肠癌病理诊断和分级标准:(1)有完整的性别、年龄、病理分级、肿瘤部位、浸润深度、脉管侵犯、神经侵犯、淋巴结转移及TMN分期资料,(2)入组患者经过首次病理确诊行肿瘤根治术治疗、未进行术前新辅助化疗[3]。排除标准:(1)双盲法复诊时病理诊断和病理分级不一致的样本,(2)患者资料不完整的样本,(3)术前进行新辅助化疗,导致病理组织学形态发生改变者[4]。
1.2 方法
按照EnvsionTM步骤处理组织标本,切取的组织标本石蜡包埋切片厚3 μm,60 ℃烤箱烘烤90 min;浸入两缸二甲苯中、每缸中脱蜡10 min,再逐级放入100%无水酒精、90%酒精、70%酒精、纯水各浸泡 5 min,3%过氧化氢孵育10 min,PBS溶液冲洗3次、每次3 min;浸泡在0.01 mmoL/L的EDTA(pH9.0)抗原修复液中,高温高压修复3 min;修复后室温下静置冷却30 min,PBS溶液反复冲洗3次(3min/次),滴加山羊血清封闭20 min、滴加一抗,4oC冰箱中孵育过夜、孵育过夜的切片在室温中复温40 min;PBS冲洗3次(3min/次),滴加二抗,37 ℃水浴箱孵育1 h、二抗孵育完成后PBS冲洗3次(3min/次),DAB显色5 min后镜下观察显色情况、PBS冲洗3次3 min滴加苏木素染色1 min,自来水冲洗 3 min、脱水、最后进入二甲苯透明5 min 3次;中性树脂封片,光学显微镜下观察,由2名病理医师双盲法判定结果。
1.3 观察指标
实验组和对照组各取37张切片,每张切片随机选取5个200倍视野,实验组观察计数结直肠癌中500个结直肠癌细胞,对照组观察计数500个结直肠正常腺体上皮细胞。观察两组切片中HIF-1α、CD147和MMP-9蛋白染色强度评分和阳性细胞百分率,染色强度分数定义为0、1、2、3,不着色为0、浅黄色为1、棕黄色为2、黄褐色为3;计数500个细胞中的阳性细胞数,计算阳性百分率,阳性百分率评分:1%~25%记为1分、26%~50%记为2分、51%~75%记为3分、>75%记为4分。强度和百分比的乘积作为免疫组化评分(IRS),IRS评分<4分判读为阴性表达、≥4分者为阳性表达[5]。
1.4 统计学方法
实验数据采用SPSS 22.0统计软件进行分析,率的比较采用χ2检验,2组间比较以P<0.05认为差异有统计学意义,采用Pearson法对HIF-1α、CD147和MMP-9蛋白阳性表达进行相关性分析。
2 结果
2.1 HIF-1α、CD147及MMP-9蛋白表达
结果显示,实验组HIF-1α、CD147及MMP-9蛋白表达明显高于对照组,差异有统计学意义(P<0.05)。见图1和表1。
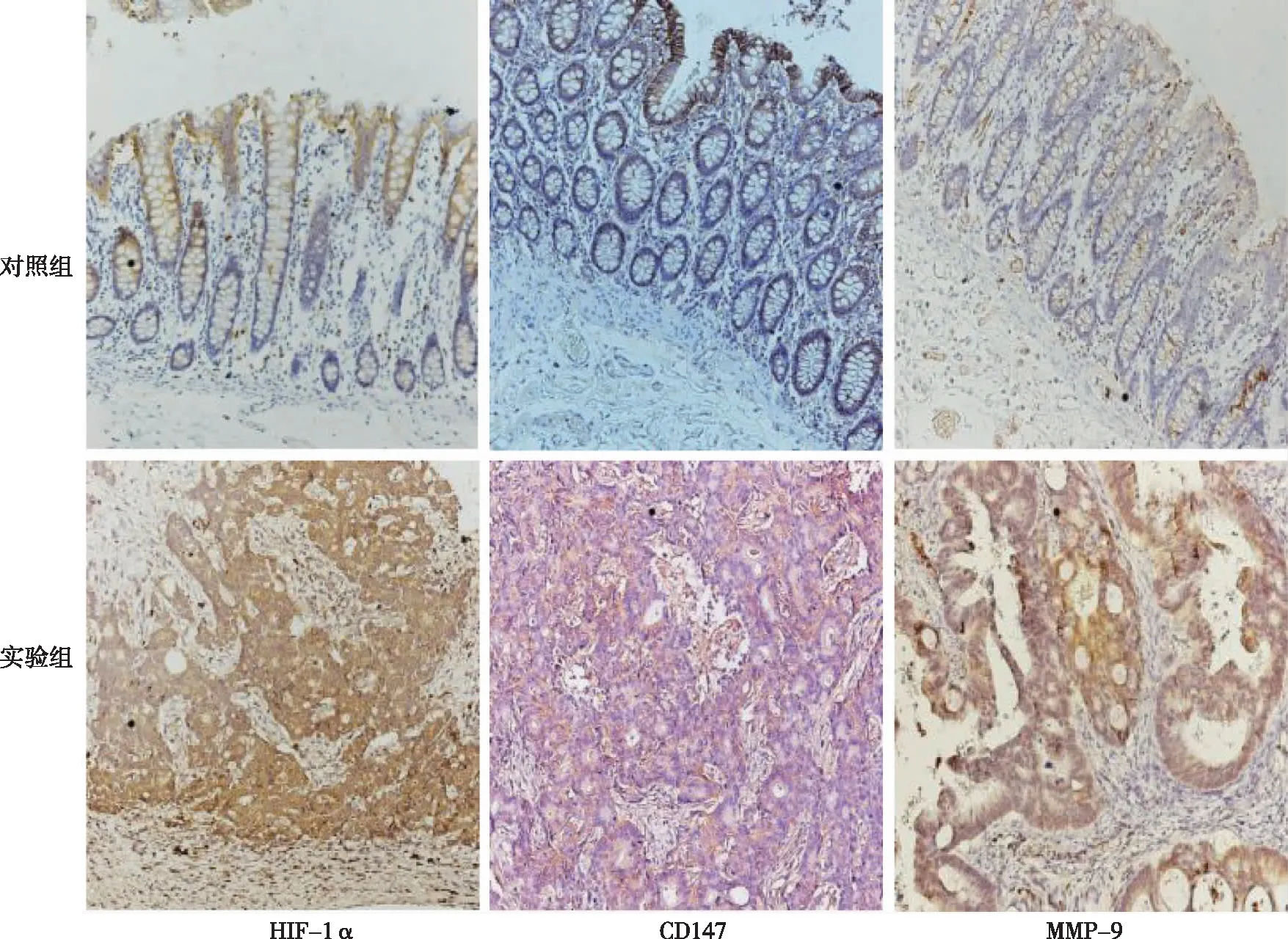
图1 两组组织标本中HIF-1α、CD147和MMP-9表达(Envison,×200)Fig.1 The expression of HIF-1α, CD147and MMP-9 in two groups of tissue samples(Envison,×200)

表1 两组组织标本中HIF-1α、CD147和MMP-9表达[n(%)]Tab.1 The expression of HIF-1α, CD147and MMP-9 in two groups of tissue samples[n(%)]
2.2 HIF-1α、CD147及MMP-9蛋白表达与结直肠癌患者临床病理参数的关系
肿瘤组织中HIF-1α、CD147及MMP-9蛋白表达与患者性别、年龄、肿瘤部位、病理分级、浸润深度、神经侵犯、脉管受累、淋巴结转移及TNM分期无关,差异无统计学意义(P>0.05);HIF-1α及CD147蛋白表达与肿瘤大小有关,差异有统计学意义(P<0.05);HIF-1α、CD147及MMP-9蛋白表达与淋巴结转移有关,差异有统计学意义(P<0.05)。见表2。
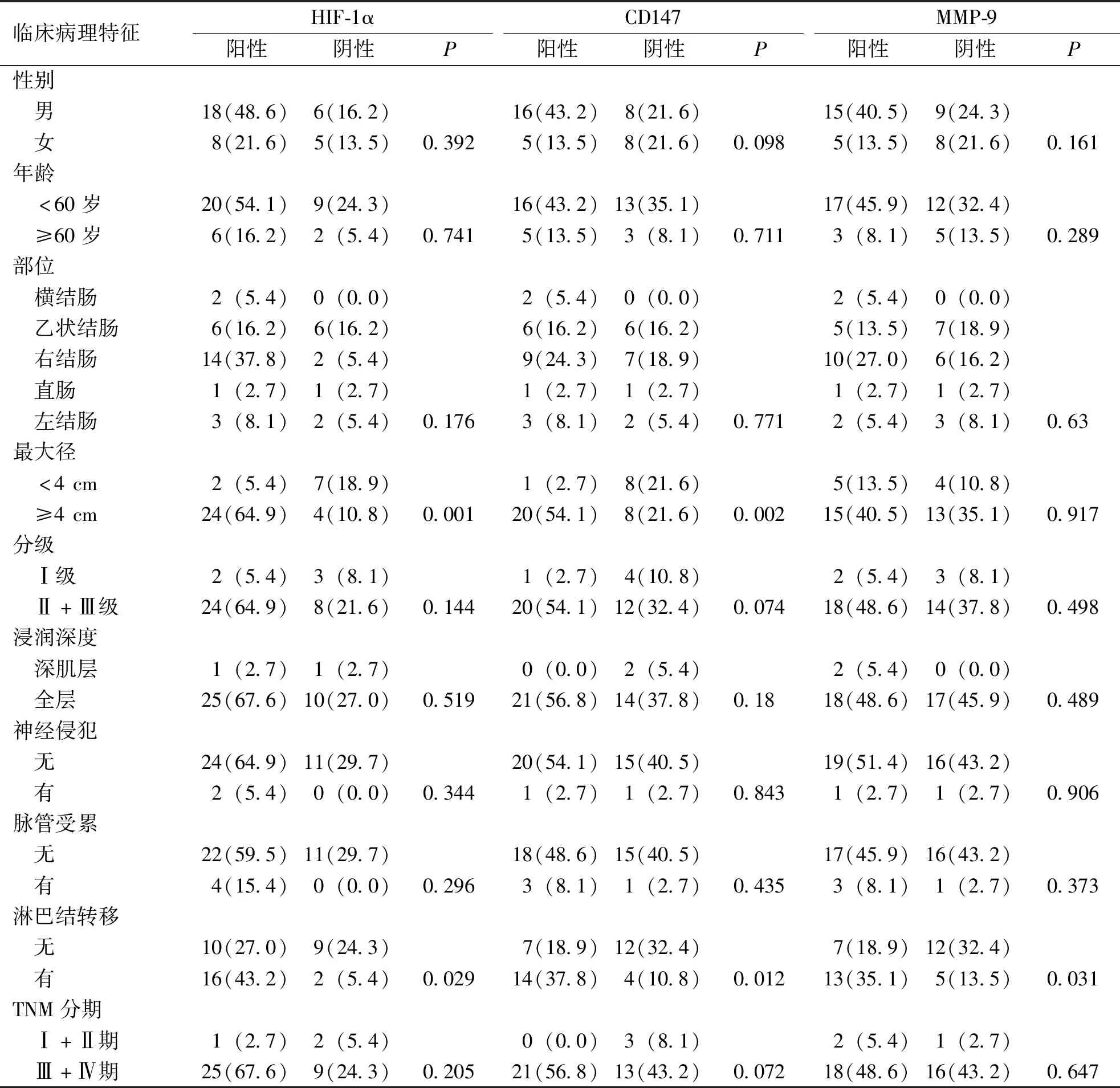
表2 HIF-1α、CD147及MMP-9表达与结直肠癌患者临床病理特征的关系[n(%)]Tab.2 Correlation between the expression of HIF-1α, CD147and MMP-9 and clinicopathological features of colorectal cancer patients[n(%)]
2.3 结直肠癌中 HIF-1α、CD147及MMP-9蛋白表达的相关性
Pearson相关性分析结果显示,结直肠癌肿瘤组织中HIF-1α、MMP-9及CD147蛋白表达间互相呈正相关,差异有统计学意义(P<0.05)。见表3。

表3 结直肠癌患者HIF-1α、CD147和MMP-9表达的相关性Tab.3 The correlation between expression of HIF-1α, CD147 and MMP-9 in colorectal cancer patients
注:(1)P<0.05。
3 讨论
结直肠癌是一种常见的恶性肿瘤,在中国乃至全球均有非常高的发病率和致死率。流行病学调查发现结直肠癌发病与低纤维、高脂肪饮食,肥胖率增加等风险因素有密切关系[6]。随着对结直肠癌研究不断深入,认为结直肠癌可能是在各种致肿瘤因素共同作用下,逐渐经过一系列如原癌基因活化,肿瘤抑制基因突变,肿瘤抑制基因缺失,启动子甲基化和或乙酰化地改变等分子事件,并伴有病理组织形态学改变及恶性肿瘤生物学行为后,最终导致结直肠癌的发生。
HIF在人类编码6种蛋白,其中HIF-1α是目前关注的热点。越来越多的证据表明,随着肿瘤生长速度增快,导致供血不足,形成局部缺氧,是肿瘤环境中最常见的一种情况[7]。在缺氧环境中,HIF-1α易活化,HIF-1α活化后促进血管内皮生长因子VEGF、hgf和met原癌基因的表达,并参与糖代谢,红细胞生成,血管形成。同时参与细胞存活、凋亡以及对肿瘤药物抗药性形成等重要生物学功能中,从而维持组织、细胞在缺氧条件下内环境稳定,以适应缺氧[8]。在人类多种实体肿瘤中都可检测到HIF-1α高表达。应用免疫组织化学技术检测134例锯齿状息肉、104例非锯齿状腺瘤、81例囊性腺瘤和74例锯齿状结直肠癌检测HIF-1α和VEGF,发现锯齿状息肉和锯齿状结直肠癌普遍存在HIF-1α表达增高,提示HIF-1α对在肿瘤发生和进展起着重要作用[9]。本组研究结果显示,37例结直肠癌组织中,HIF-1α蛋白阳性率为70.3%(26/37),正常对照组织中为13.5%(5/37),HIF-1α蛋白在结直肠癌肿瘤组织中明显高于正常组织(P<0.05),同时在实体肿瘤中肿瘤直径大者(P<0.05)和有淋巴结转移者(P<0.05)明显出现HIF-1α蛋白高表达。综合以往的研究结果,本研究认为在正常结直肠组织和结直肠癌早期以及肿瘤体积较小时候,由于有足够的血液供应,细胞微环境为非缺氧状态,HIF-1α蛋白被降解。但是随着肿瘤组织不断生长,肿瘤细胞微环境逐渐转变由有氧环境转变为缺氧环境,肿瘤细胞中HIF-1基因活化增强并伴有HIF-1蛋白降解减弱。HIF-1α蛋白促进了肿瘤细胞增殖和血管形成,并促进了肿瘤的淋巴结转移[10-11]。但HIF-1蛋白与肿瘤演进的分子机制有待进一步研究证实。
CD147基因定位于19p13.3号染色体,CD147是一种54kDa糖基化跨膜蛋白,CD147通过刺激基质金属蛋白酶(MMP)和细胞因子的分泌,参与调节细胞增殖、凋亡和肿瘤细胞迁移、转移和分化及肿瘤耐药性的形成等重要功能[12]。CD147是促进肿瘤侵袭、生长、进展和转移的核心。大量研究证实CD147的过度表达与肿瘤进展、转移发展和耐药性等现象之间的相关性[4]。此外在一组入组328例结直肠癌患者的研究应用免疫组织化学方法检测结直肠癌组织中CD147的表达,采用统计学分析评价CD147表达与结直肠癌患者无疾病生存率的关系,结果显示CD147在结直肠癌中表达增加(P<0.001),与肿瘤侵袭(P<0.001)、转移(P<0.001)和TNM分期(P<0.001)有关,这些结果提示CD147在人类结直肠癌复发中的潜在作用,这可能是预测结直肠癌复发的一种新的分子标记物[13]。本研究通过对本组37例的结直肠癌组织中CD147检测发现,结直肠癌组织中CD147表达明显高于正常组织,同时结直肠癌组织中CD147的高表达与肿瘤大小和淋巴结转移比较,差异有统计学意义(P<0.05),本研究结果与既往研究相似,表明CD147在结直肠癌组织中是一个非常关键的因子,可能参与肿瘤的进展和转移[14]。在本组病例中未观察到CD147与肿瘤侵袭性指标,如神经侵犯,脉管侵犯等,以及肿瘤TNM分期的相关性,可能与入组病例数较少有关。
MMPS是锌依赖性内肽酶家族,由25个成员组成,MMP家族成员MMP-9起着关键的蛋白酶作用,MMP-9蛋白一旦被激活,MMP-9蛋白就能够降解许多细胞外基质[15]。Jeroen等[16-17]通过免疫组织化学染色检测507例结直肠癌患者的肿瘤组织,发现MMP-9过度表达与肿瘤细胞过度增殖、细胞凋亡、血管生成及肿瘤侵袭转移密切相关。并发现在原发结直肠癌和未接受系统治疗的肿瘤组织中MMP-9蛋白的高表达,具有评估预后的价值,是早期检测结直肠癌复发、转移和预后的生物标志物[18]。本研究结果显示,37例结直肠癌组织中,MMP-9蛋白在结直肠癌肿瘤组织中阳性率为54.1%(20/37),在正常对照组中为16.2%(6/37),MMP-9蛋白在肿瘤组织表达明显高于正常组织,MMP-9蛋白表达与淋巴结转移比较,差异有统计学意义(P<0.05)。提示高水平的MMP-9蛋白促进细胞周围基质降解,有助于肿瘤细胞突破细胞外基质的屏障作用,向周围的脉管发生浸润和转移,可见MMP-9蛋白在介导肿瘤细胞恶性生物学行为过程中起到重要的作用[19]。
HIF-1α通过诱导数百个基因的转录,在肿瘤的生长和恶性进展中发挥重要作用,这些基因在提高肿瘤组织中的氧利用率并诱导血管生成、使肿瘤细胞摆脱缺氧并促进肿瘤细胞的侵袭和转移,以及癌细胞对缺氧微环境的适应(代谢重编程)[6]。CD147表达上调后能促进肿瘤生长,抑制肿瘤细胞凋亡,增强其缺氧侵袭能力[20]。CD147刺激对MMP降解细胞外基质并导致肿瘤的生长、侵袭和转移具有重要意义[15]。本研究结果显示,在结直肠癌肿瘤组织中,HIF-1α、MMP-9、CD147蛋白表达之间互相呈正相关(P<0.05)。
综上所述,综合已有国内外研究结果结合本研究结果,本研究认为HIF-1α、CD147、MMP-9蛋白表达与结直肠癌发生和发展是有着密切的关系,即HIF-1α基因转录活化,癌细胞对缺氧微环境的适应,同时提高肿瘤组织中的氧利用率、诱导血管生成、肿瘤细胞的侵袭和转移能力增强;同时HIF-1α基因转录活性增强后,对CD147启动子激活的介导作用加强,CD147刺激对MMP-9降解细胞外基质,从而促进肿瘤细胞增殖、侵袭和转移以及耐药性产生[21]。但HIF-1α、CD147和 MMP-9 3种分子在信号传导通路上相互作用和相互关系的分子机制,有待进一步深入研究。
