Ph+急性B淋巴细胞白血病耐伊马替尼细胞模型的建立*
2020-06-12方宗宇马莉张智琪吴青青
方宗宇,马莉,张智琪,吴青青**
(1.贵州中医药大学第二附属医院,贵州 贵阳 550004; 2.贵州医科大学附院 检验中心,贵州 贵阳 550004)
BCR-ABL融合突变是由于染色体易位t(9;22)(q34;q11.2)导致费城染色体(philadelphia chromosome,Ph)的形成而产生, 是慢性髓系白血病的典型特征[1-2],研究发现,20%~30%的成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和 3%~5%的儿童ALL中可检测到Ph染色体[3-7]。BCR-ABL融合突变导致酪氨酸激酶持续激活, 进而激活多种信号通路, 促进细胞增殖、抑制细胞分化和黏附等[8]。BCR-ABL由于含有持续的酪氨酸激酶活性, 因此含有BCR-ABL融合基因的患者对酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs) 敏感[9]。甲磺酸伊马替尼(imatinib mesylate,IM)是TKI的典型代表,作为BCR/ABL融合基因的靶向治疗药物,IM在Ph+ALL的治疗中作为首选药物可提高缓解率,但复发率高,易产生耐药,并且对总生存率和长期无病生存率无明显提高[10]。Ph+ALL对TKI耐药机制复杂,报道较多的机理有耐药相关基因如MDR和MRP等的高表达[11]、基因点突变[12]、BCR/ABL基因扩增[13]以及多条信号通路激活等[12],是目前国内外研究的热点,但其具体机制仍未完全明确。因Ph+ALL中以Ph+B-ALL为主,本研究以Ph+B-ALL细胞系(SUP-B15)为对象,建立IM耐药的Ph+B-ALL细胞系(SUP-B15/IM),为寻找参与Ph+B-ALL的IM 耐药的基因提供实验依据。
1 材料与方法
1.1 细胞株和主要试剂
亲本细胞(SUP-B15)和IMDM培养基购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),伊马替尼(sigma,美国)、胎牛血清(BI,以色列)、青链霉素(Hyclone,美国)、台盼蓝(Solarbio,北京)、PBS(Hyclone,美国)、培养瓶和离心管(Corning,美国)、Cell Counting Kit-8(同仁公司,日本)、AnnexinV-FITC/PI细胞凋亡双染试剂盒(BD,美国)、RNA提取试剂Trizol(Invitrogen,英国),逆转录试剂盒和TB GreenTMPremix Ex TaqTMII试剂盒均购自TaKaRa公司。
1.2 方法
1.2.1IM诱导SUP-B15/IM细胞系模型的建立 SUP-B15细胞在含有20%胎牛血清,含100 U/mL的青霉素和100 mg/L的链霉素的IMDM 培养基、37 ℃、5%CO2培养箱中培养。根据Boichuk等[14]研究,用小剂量浓度递增间歇诱导的方式加入IM诱导细胞耐药,由于初期加入药物细胞极易死亡,因此第一次加药浓度极低,为0.2 μmol/L[约为SUP-B15亲本细胞1/80半数抑制浓度(50% inhibitory concentration,IC50)值]。首先配置好完全培养基,加入一定量1 mmol/L IM储备液配置成0.2 μmol/L工作液,再加入到细胞沉淀中,用吸管轻柔吹吸混匀后转移到T25培养瓶后置于培养箱中培养,2~3 d传代1次,待细胞生长稳定后再进行下一个药物浓度的诱导。诱导初期药物浓度每次增加0.2 μmol/L,达到1 μmol/L浓度后、每次增加0.5 μmol/L,达到5 μmol/L浓度后、每次增加1 μmol/L,直到获得了能在10 μmol/L IM条件下持续传代的耐药细胞SUP-B15/IM;对照组细胞SUP-B15/C除了不加药物外,其传代方法及次数同耐药组。在验证实验使用之前,将SUP-B15/IM细胞维持在不含IM的培养基中,并传代至少3次。
1.2.2细胞形态学观察 取对数生长期的亲本细胞(SUP-B15)、对照组细胞(SUP-B15/C)和耐药组细胞(SUP-B15/IM)于倒置显微镜(100×)下观察细胞形态。
1.2.3细胞短串联重复序列(short tandem repeat,STR)鉴定 耐药成功后,分别收集106个SUP-B15/C和SUP-B15/IM细胞,送至苏州金唯智生物科技有限公司行STR鉴定。利用软件对数据进行分析,并与相应的数据库进行比较。
1.2.4细胞毒实验及IC50测定 采用CCK8法分别检测亲本细胞(SUP-B15)、对照组细胞(SUP-B15/C)和耐药组细胞(SUP-B15 /IM)对IM的敏感性。取各组对数生长期的细胞接种于96孔板中,每孔细胞浓度为5×105个。实验孔加入不同浓度的IM(20、40、60、80、100、120、140和160 μmol/L),每个浓度设8个复孔;另外再设置不含IM的对照孔和不含细胞的空白孔,对照孔和实验孔分别加入与IM相同体积的注射用生理盐水,置于37 ℃ 5%CO2孵箱中孵育24 h后,在每孔中加入10 μL CCK8试剂,再置于孵箱中孵育4 h,用酶标仪测定450 nm处的吸光度值。8个复孔的数值去掉一个最高值和一个最低值,其余6孔吸光度值的平均值按下列公式计算抑制率,绘制生长曲线。抑制率=[(Ac-As)/(Ac-Ab)]×100%,其中Ac,As,Ab分别为对照孔、实验孔及空白孔在450 nm波长处的吸光度值。用GraphPad Prism 5 软件计算细胞IC50值,再根据IC50值计算出耐药指数(resistance index,RI)。RI=耐药细胞系的 IC50/对照细胞系的 IC50。
1.2.5细胞凋亡分析 用不同浓度(0、10和100 μmol/L)的IM处理细胞24 h后,使用AnnexinV-FITC/PI细胞凋亡双染试剂盒检测细胞存活和凋亡。分别收集SUP-B15/C和SUP-B15/IM细胞约5×105个,加入Binding Buffer 50 μL,再加入Annexin V-FITC 5 μL和Propidium lodide 5 μL混匀,室温下避光孵育15 min;最后加入Binding Buffer 200 μL重悬上流式细胞仪检测,并分析凋亡率。
1.2.6相关耐药基因MDR1和MRP5 用不同浓度(0和100 μmol/L)的IM处理细胞24 h后分别收集106个对数生长期的SUP-B15/C和SUP-B15/IM细胞,按照RNA提取试剂盒和逆转录试剂盒操作说明提取总RNA,逆转录为cDNA,并去除组织DNA;取cDNA 300 ng,使用RT-PCR法扩增MDR1和MRP5 mRNA。反应条件:95 ℃预变性30 s,然后95 ℃ 5 s、60 ℃ 34 s,共40个循环,最后95 ℃ 15 s、60 ℃ 1 min。内参基因β-actin上游引物5′-TGGCACCCAGCACA ATGAA-3′,下游引物5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′;MDR1上游引物5′-GAGAGATCCTCACCAAGCGG-3′,下游引物5′-CGAGCCTGGTAGTCAATGCT-3′;MRP5上游引物5′-GTCCTGGGTATAGAAGTGTG-3′,下游引物5′-CAGAAGATCCACACAACCCT-3′。
1.3 统计学处理
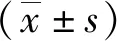
2 结果
2.1 细胞形态特征
采用光学显微镜观察SUP-B15、SUP-B15/C和SUP-B15/IM细胞,结果显示SUP-B15细胞为悬浮细胞、圆形、大小排列均匀、边界清晰可见,具有典型淋巴细胞的特征(图1A);SUP-B15/C细胞在传代过程中仍然保持典型淋巴细胞的特征(图1B),而耐药的SUP-B15/IM细胞呈悬浮生长、细胞体积变小、边界不清(图1C)。

SUP-B15细胞 SUP-B15/C细胞 SUP-B15/IM细胞图1 细胞形态比较(100×)Fig.1 Comparison of cellular morphology (100×)
2.2 SUP-B15 /C和SUP-B15 /IM细胞STR鉴定
STR鉴定结果显示,经过与数据库进行比较,两株细胞均与SUP-B15细胞遗传位点吻合(图2)。

注:C为SUP-B15/C细胞,R为SUP-B15/IM细胞。图2 培养细胞的STR鉴定Fig.2 STR identification of cultured cells
2.3 3组细胞的IC50
通过CCK8法检测SUP-B15、SUP-B15/C和SUP-B15/IM细胞对IM 的IC50,结果显示:SUP-B15细胞对IM的IC50是16.72 μmol/L,SUP-B15/C细胞对IM的IC50是22.53 μmol/L,SUP-B15/IM细胞对IM的IC50是277.2 μmol/L,其中SUP-B15细胞与SUP-B15/C细胞的IC50比较,差异无统计学意义(P>0.05);SUP-B15/IM细胞对SUP-B15/C细胞的RI为12.3。见图3。

图3 不同浓度IM作用后SUP-B15、SUP-B15/C和SUP-B15/IM细胞的存活率Fig.3 Survival rate of SUP-B15, SUP-B15/C and SUP-B15/IM cells after IM different concentrations
2.4 SUP-B15 /C和SUP-B15 /IM细胞凋亡分析
流式细胞术检测结果显示,在IM浓度为0和10 μmol/L时SUP-B15/C细胞与SUP-B15/IM细胞的凋亡率比较,差异无统计学意义(P>0.05),而在IM浓度100 μmol/L时SUP-B15/C细胞的凋亡率明显高于SUP-B15/IM细胞,差异有统计学意义(P<0.001)(图4)。

注:A为SUP-B15/C细胞凋亡流式图;B为 SUP-B15/IM细胞凋亡流式图(10、100为加10和100 μmol/L IM);C为凋亡率分析;(1)与SUP-B15/IM细胞比较,P<0.001。图4 不同浓度IM下SUP-B15/C及SUP-B15/IM细胞凋亡Fig.4 SUP-B15/C and SUP-B15/IM apoptosis at different concentrations of IM
2.5 SUP-B15/C和SUP-B15/IM细胞中MDR1和MRP5的mRNA表达
100 μmol/L IM浓度下,SUP-B15/IM细胞中MDR1和MRP5 mRNA表达水平显著高于SUP-B15/C细胞,差异有统计学意义(P<0.001)(图5)。

注:(1)与SUP-B15/C细胞比较,P<0.001。图5 SUP-B15 /IM与SUP-B15/C细胞MDR1和MRP5 mRNA表达Fig.5 Expression of MDR1 and MRP5 mRNA in SUP-B15/IM and SUP-B15/C cells
3 讨论
开发建立耐药肿瘤细胞模型对于人类进行相关基础研究和药物的评价进而攻克肿瘤治疗具有重大意义[14]。而在众多建立耐药模型的方法里,药物浓度递增法是最常用且有效的方法,所建立的耐药细胞系具有耐药性稳定、可靠的特点,耐药倍数普遍高于其他方式建立的耐药细胞株[15]。另外目前尚缺乏Ph+B-ALL耐药模型,建立稳定有效的耐药细胞株对Ph+B-ALL的研究尤为重要;因此,本研究采用药物浓度递增法建立的Ph+B-ALL耐药细胞株可以为研究更深的耐药机制提供模型,为攻克Ph+B-ALL临床耐药治疗打下基石。
在本研究中,从Ph+B-ALL细胞系(SUP-B15)建立了对IM产生耐药性的耐药细胞系(SUP-B15/IM)。在诱导前期,细胞对IM极度敏感,因此起始阶段加入的IM浓度极低,且增加IM浓度缓慢;在诱导3个月后,细胞生长速度有所增加,因此增加药物浓度梯度变大,这可能是由于细胞已经产生了一定的耐药性。值得注意的是,在诱导过程中,细胞形态发生了一些改变,例如细胞体积缩小,形态变得不规则,散在生长。
据统计约30%细胞系被交叉污染或错误辨识,在细胞的传代过程 导致研究结果出现偏移[16-17]。STR鉴定可以证实本研究的细胞是否被污染或错误辨识。本研究的细胞经STR鉴定,表明通过12个月的诱导耐药,细胞的短串联重复序列没有发生变化,说明细胞未出现问题。另外CCK8实验表明,SUP-B15/IM细胞对SUP-B15/C细胞的耐药指数为12.3,而SUP-B15细胞与SUP-B15/C细胞的IC50无明显差异,说明耐药组细胞确实产生了耐药性。凋亡实验也表明,浓度为100 μmol/L IM作用细胞24 h后,SUP-B15/IM细胞的凋亡率远低于SUP-B15/C细胞,同样说明耐药诱导成功。
MDR1是耐药相关基因,它编码P-糖蛋白(Pgp),Pgp嵌于细胞膜表面形成具有外排功能的“泵”,能逆向转运药物排出细胞外,防止毒物在胞内积聚对细胞造成损害[18]。有研究表明,MDR1基因的过度表达导致Pgp活性增加,从而降低IM对细胞的杀伤性[19-20],另外研究证明,MRP5能够转运cGMP,也能将药物排出胞外[21]。RT-PCR结果表明,在SUP-B15/IM细胞中用100 μmol/L IM作用细胞后MDR1和MRP5 mRNA表达水平显著高于SUP-B15/C,意味着这两个基因参与了SUP-B15/IM的耐药过程。
总之,本研究建立了对IM具有高耐药性的SUP-B15/IM系,为Ph+B-ALL患者耐药机制研究提供了细胞模型。
