糖尿病小鼠肾组织中细胞焦亡发生的现象研究*
2020-06-12周兴艳李华柳茜罗欣月陈烨朱春玲严瑞
周兴艳,李华,柳茜,罗欣月,陈烨,朱春玲,严瑞
(贵州医科大学附院 肾脏内科,贵州 贵阳 550004)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)最严重的微血管并发症,也是导致终末期肾病(end-stage renal disease,ESRD)的主要原因[1]。研究发现,慢性炎症是促进DN进展的重要危险因素[2-3]。细胞焦亡,是一种可由半胱天冬氨酸蛋白酶-1(Caspase-1)介导的炎性程序性溶解性细胞死亡,而Gasdermin家族成员GSDMD是引起细胞焦亡发生的最终执行者,细胞焦亡的发生与炎症反应密切相关[4-5]。本研究以DM小鼠为研究对象,观察Caspase-1及细胞焦亡关键蛋白GSDMD及其mRNA表达变化,为探索糖尿病肾病细胞焦亡和炎症反应的机制研究提供理论基础。
1 材料与方法
1.1 主要材料与试剂
SPF级C57BL/6J小鼠(雄性),体质量(18±1.2)g【斯贝福生物技术有限公司,许可证号SCXK(京)2016-0002】;链脲佐菌素(STZ,美国,Sigma公司)、血糖仪及血糖试纸(上海鱼跃生物技术有限公司)、预染Marker(Thermo Scientific公司)、rabbit-anti-β-actin(博奥森生物技术有限公司)、rabbit-anti-caspase-1(Proteintech公司)、rabbit-anti-GSDMD(Abcam公司)、HRP标记的山羊抗兔IgG(普美生物技术有限公司)。BCA蛋白浓度测定试剂盒、HE及Masson染色试剂盒(北京索莱宝公司),总 RNA提取试剂盒(天根生化科技公司)、引物合成 (Thermo Scientific公司)、Real Time-PCR试剂盒(Takara公司)以及生化指标由成都里来生物技术有限公司提供技术支持。
1.2 方法
1.2.1分组及DM小鼠模型复制 将6~8周龄的C57BL/6J小鼠随机分为正常对照组(NC组)和糖尿病小鼠模型组(DM组),每组6只。将DM组小鼠禁食(不禁饮)3~4 h,以1%链脲佐菌素(STZ)按55 mg/kg剂量(柠檬酸钠缓冲液配制)腹腔注射,正常组小鼠以等体积的柠檬酸-柠檬酸钠缓冲液腹腔注射,连续注射5 d,造模结束72 h后测定DM组小鼠空腹尾静脉末梢血糖均>16.7 mmol/L,造模成功后继续饲养16周。
1.2.2生化指标测定及肾脏组织观察 将NC组和DM组饲养16周后乙醚麻醉处死,眼球取血离心后取上清检测血糖及血肌酐;经小鼠左心室予4 ℃预冷的0.9%生理盐水灌洗肾脏,取一侧肾脏组织存于1.5 mL离心管中冻存-80 ℃冰箱备用,另一侧肾脏组织立即放入4%多聚甲醛中固定、制成3 μm厚的石蜡切片,行HE和Masson染色进行病理学观察,并拍摄图片。
1.2.3检测Caspase-1、GSDMD蛋白表达 Western blot法检测Caspase-1、GSDMD的蛋白表达,取小鼠肾皮质部分加入组织蛋白裂解液后组织匀浆,离心后取上清,按照BCA试剂盒说明书测定蛋白浓度;各组蛋白上清加入5×蛋白上样缓冲液加热变性后加至SDS-PAGE凝胶中,经电泳、转膜、5%脱脂牛奶封闭后,分别用对应一抗β-actin(1 ∶6 000)、Caspase-1(1 ∶1 000)、GSDMD(1 ∶1 000),4 ℃孵育过夜,TBST洗膜3次后,加入HRP标记的山羊抗兔IgG(1 ∶5 000),室温孵育1.5 h,再次TBST洗膜3次,应用ECL显色,凝胶成像系统显影拍照,重复3次以上,进行统计分析。
1.2.4检测Caspase-1、GSDMDmRNA的表达 Real Time-PCR法检测Caspase-1、GSDMD的mRNA表达。应用Trizol法提取小鼠肾组织的总RNA并测定其浓度,步骤参照试剂盒说明书;选取20 μL作为反转录的反应体系合成模板cDNA,应用Thermo Scientific公司提供的PCR引物,采用SYBR premix Ex TaqII进行荧光定量PCR。目的基因引物序列见表1。

表1 目的基因引物序列Tab.1 The sequences of the primers in real time PCR
1.3 统计学分析
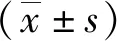
2 结果
2.1 生化指标测定
与NC组比较,DM组小鼠血糖水平明显增高,差异有统计学意义(P<0.01);且在DM组小鼠肾功能指标血肌酐水平较NC组增高,差异有统计学意义(P<0.05),提示造模成功,见表2。
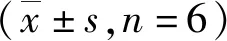
表2 两组小鼠血糖、血肌酐水平Tab.2 Levels of blood glucose and plasma creatinine in the two
注:与NC组比较,(1)P<0.01,(2)P<0.05。
2.2 小鼠肾组织变化
光镜下,HE染色可见NC组小鼠肾小球形态完整,结构清晰,肾小管未见明显扩张、变性及坏死,基底膜完整;DM组小鼠见肾小球内系膜基质增生,部分肾小管上皮细胞完整性被破坏,可见细胞肿胀、空泡变性(图1A)。Masson染色下显示,NC组小鼠肾小球基底与系膜区未见胶原沉积,肾小管间质区未见胶原增多;DM组小鼠肾组织中可见部分肾小管管腔扩张,肾小管基底膜增厚,肾小球内可见大量被染成蓝紫色条索状的胶原纤维沉积(图1B)。
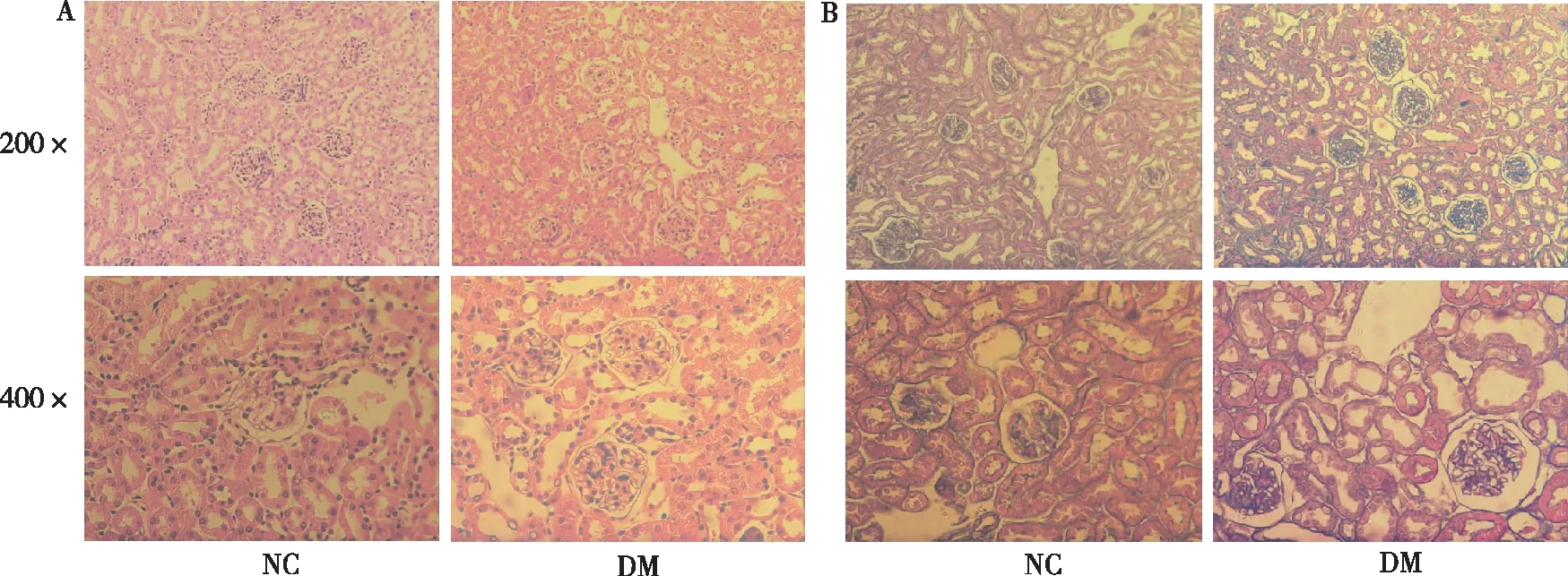
注:A为HE染色,B为Masson染色。图1 NC组和DM组小鼠肾组织变化(HE和Masson染色)Fig.1 Histological changes of kidney tissues mouse in two groups (HE and Masson)
2.3 肾组织中Caspase-1和GSDMD的蛋白表达
与NC组相比,DM组小鼠肾脏组织中Caspase-1及GSDMD蛋白表达增高,差异有统计学意义(P<0.05),见图2。

注:(1)与NC组比较,P<0.05。图2 NC和DM组小鼠肾组织中Caspase-1及GSDMD蛋白的表达(Western blot)Fig.2 The protein expression of Caspase-1 and GSDMD in kidney tissues of normal controls and diabetic groups(Western blot)
2.4 肾组织中Caspase-1和GSDMDmRNA表达
与NC组相比,DM组小鼠肾脏组织中Caspase-1和GSDMDmRNA的表达增高,差异有统计学意义(P<0.05,n=6),见图3。

注:(1)与NC组比较,P<0.05。图3 肾组织中Caspase-1和GSDMD mRNA表达(Real Time PCR)Fig.3 The mRNA expression of Caspase-1 and GSDMD in kidney tissues in two groups(Real Time PCR)
3 讨论
DN逐渐成为我国终末期肾脏病患者的主要病因之一,其防治机制的研究一直以来备受关注[1]。本研究发现,C57BL/6J小鼠在STZ诱导下发生血糖增高,长时间高血糖状态,DM小鼠逐渐出现肾脏损伤,其病理表现为小鼠肾小球内系膜基质增生及胶原纤维沉积,部分肾小管上皮细胞完整性被破坏,可见细胞肿胀、空泡变性,这与既往研究结果类似[6],可见持续高血糖状态是引起DN发生的因素之一。而近年研究表明,慢性炎症逐渐成为促进DN进展的主要因素之一,并发现抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3,NLRP3)/Caspase-1/白细胞介素-1β(interleukin-1β,IL-1β)通路可改善糖尿病肾损伤,这可能是一种预防DN进展的潜在治疗策略[7],但目前针对糖尿病肾病炎症反应的发生机制尚未完全阐明,故对其发生的防治缺乏相对有效的治疗手段。因此,探索DN炎症反应的发生机制,将为DN的防治研究提供作用靶点奠定一定的实验基础。
细胞焦亡是由炎性Caspases如人同源性和鼠同源性Caspase-1、人同源性Caspase-4 及 Caspase-5或鼠同源性Caspase-11激活的炎性程序性细胞死亡方式,而具有“膜孔形成效应”的Gasdermin家族成员GSDMD是引起细胞焦亡发生的底物蛋白[4-5]。而细胞焦亡的发生形式可分为经典途径和非经典途径两种类型:由炎症小体激活的人同源性和鼠同源性Caspase-1介导的细胞死亡为经典途径细胞焦亡,由人同源性Caspase-4、Caspase-5或鼠同源性Caspase-11直接介导的细胞死亡称为非经典途径细胞焦亡[8]。研究发现,细胞焦亡的发生涉及细胞膜破裂、细胞质内容物如炎症细胞因子的释放,进而引起细胞周围炎症级联反应,作为炎性Caspases的底物蛋白GSDMD是引起这一过程发生的必需基因[8-10]。目前针对DN细胞焦亡和炎症反应的机制研究尚不完全清楚。目前针对细胞焦亡是否能作为DN炎症反应防治的突破点也鲜有研究报道。
本研究发现,在DM小鼠肾组织中活性Caspase-1的蛋白及mRNA表达增高,这一结果与既往研究结果类似:活性Caspase-1是促炎性细胞因子分泌、细胞焦亡、炎症介导免疫所必需的,Caspase-1蛋白前体(protein precursor-caspase-1,Pro-caspase-1)是炎症小体的重要组成部分,由炎症小体激活Pro-caspase-1进一步裂解产生的活性Caspase-1可分解促炎性细胞因子如IL--1β和IL--18的蛋白前体,产生并控制成熟炎症细胞因子的分泌和介导一种称为细胞焦亡的炎性细胞死亡[11]。Shahzad等[12]研究发现,在糖尿病小鼠(db/db小鼠)模型及高糖诱导的足细胞中,检测到Caspase-1的表达高于凋亡标记物(Caspase-3、Caspase-7、PARP1)的表达水平,Caspase-1依赖性炎症小体激活可促进DN发生发展,小分子靶向Caspase-1或炎症小体活化可能是DN的一种可行的治疗途径。高糖诱导大鼠肾小球系膜细胞可发生细胞增殖、氧化应激和细胞外基质(extracellular matrix,ECM)沉积,且发现Caspase-1的表达水平增高,红景天苷(salidroside,SAL)是玫瑰红景天中的主要成分,对DN有保护作用,可抑制硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)的表达,从而可抑制Caspase-1参与的NLRP3炎症小体活化,进而抑制高糖诱导的肾小球系膜细胞增殖、氧化应激和减轻ECM沉积[13]。而肾小管间质炎症在DN的进展中起关键作用,Optineurin(OPTN)的表达减少可促进DN病程进展;过表达OPTN的鼠肾小管上皮细胞中NLRP3表达明显降低,且抑制Caspase-1和IL-1β的裂解以及炎症因子IL-1β和IL-18的释放,显著增加了肾小管上皮细胞中微管相关蛋白1A / 1B-轻链3-II和线粒体外膜20的转位酶的共配作用,进而表明OPTN通过增强线粒体吞噬作用,抑制Caspase-1活化,减轻肾小管间质炎症反应[14]。姜黄素作为一种有效的抗纤维化剂,可抑制DN小鼠肾组织和高糖诱导的HK-2细胞中胶原IV、纤连蛋白、Caspase-1和NLRP3的表达,减轻肾小球肥大、肾小球系膜基质增生,降低蛋白尿的排泄[15]。A1腺苷受体(A1 adenosine receptor,A1AR)通过抑制DN中与细胞焦亡相关的Caspase-1 / IL-18信号传导,在近端肾小管巨蛋白丢失相关蛋白尿中起保护作用[16]。以上研究表明,活性Caspase-1介导的炎症反应和细胞焦亡可促进DN的发生发展。
同时,本次研究中发现DM小鼠肾组织中GSDMD蛋白及mRNA表达增高。已有研究报道,细胞焦亡不仅可发生在固有免疫细胞中,而且在肾脏实质细胞中也可出现,与肿瘤、免疫反应和炎症反应密切相关[17-19]。既往研究显示,GSDMD是细胞焦亡和分泌促炎性细胞因子的关键蛋白[20]。在髓系细胞或巨噬细胞中抑制GSDMD活性可抑制细胞焦亡及促炎性细胞因子的释放[21-22]。高糖诱导的肾小球内皮细胞中Caspase-1和GSDMD的表达增高,丁酸钠可通过Caspase-1/GSDMD途径抑制细胞焦亡和促炎性因子的释放[23]。有研究报道,lncRNA可通过改变miRNA的表达来改善DN,lncRNA-GAS5过表达通过下调miR-452-5p的表达来抑制HG诱导的肾小管上皮细胞的炎症反应、氧化应激和细胞焦亡[24]。结合既往研究结果,提示GSDMD介导的细胞焦亡可促进高葡萄糖状态下肾脏实质细胞的损伤,但细胞焦亡在DN中的发生机制仍未完全阐明。
综上,推测DM小鼠肾组织中可能发生活性Caspase-1介导关键蛋白GSDMD激活引起的细胞焦亡。本次研究为DN病细胞焦亡和炎症反应的发生机制研究提供初步实验依据,而细胞焦亡在DN实质细胞中的具体发生机制及调控机制需要进一步实验进行探索,对指导DN的防治具有一定意义。
