基于高通量测序的连栽木麻黄根际土壤细菌群落变化研究
2020-06-12周柳婷李建鹃赵艳琳吴则焰林文雄
周柳婷,李建鹃,赵艳琳,罗 扬,白 莹,陈 军,吴则焰,3,4,*,林文雄
1 福建农林大学生命科学学院,福州 350002 2 福建农林大学林学院,福州 350002 3 作物生态与分子生理学福建省高校重点实验室,福州 350002 4 福建省农业生态过程与安全监控重点实验室,福州 350002
木麻黄(CasuarinaequisetifoliaForst.)是木麻黄属常绿乔木,20世纪50年代作为庭院绿化树种引入我国[1- 2],因其良好的适应性及抗风、耐贫瘠、耐盐碱等生理特点,在维持海岸带生态系统稳定、缓解沿海沙地盐碱危害、防潮汐侵蚀等方面都起到极其重要的作用[3]。目前滨海沙地的适生树种较少,木麻黄作为重要的防护林树种,长期受到严重的连栽障碍问题困扰[4],具体表现为木麻黄平均木生物量、林分生物量及林分净生产力均呈现逐代下降趋势,植株生长缓慢,病虫害严重,造成产量、品质下降[5- 6]。如何缓解或消减木麻黄连栽障碍,成为国内外同行研究的前沿热点。
前人研究认为,植物连栽障碍是地力衰退[7]、化感物质自毒作用[8- 9]、土壤微生态环境失衡等诸多方面综合作用的结果。在地力衰退研究方面,有学者指出长期连栽条件下植物对土壤矿质营养元素的片面吸收,使连栽土壤养分不均衡,进而导致林分生产力下降、森林防护效益降低。更有甚者试图通过增施肥料的措施来缓解连栽障碍但收效甚微,反而加剧了环境污染[10]。在化感物质自毒作用研究方面,李键[11]、邓兰桂[12]等人从木麻黄小枝提取物中分离鉴定出了黄酮类、鞣花酸类化感物质,认为自毒作用是引起木麻黄连栽障碍的原因。随着研究的深入,国内外同行逐渐认识到化感物质释放到土壤后势必受到微生物的加工、分解、转化等[10,13],其存在只是诱因而不是导致植物连栽障碍形成的直接因素[14],因此土壤微生态成为连栽障碍研究的关注焦点。深入研究“植物-土壤-微生物”三者在根际的互作过程,对于探索土壤微生物与植物生长发育之间的相互调控关系、揭示植物连栽障碍机制至关重要[15]。例如:Zhao等[16]研究表明,桉树多代连栽后根际土壤中真菌多样性增加;Wu等[17]发现连栽杉木使根际土壤中真菌/细菌比例显著增加,且微生物群落多样性和代谢活性显著降低,从而打破了土壤微生态平衡;叶功富等[18]研究发现,连栽木麻黄林地中细菌、放线菌、固氮菌与纤维素分解菌数量分别比一代林地减少22.46%、12.25%、32.66%和29.61%,真菌数量增加22.39%,微生物总量减少21.07%。目前,虽然已有少量关于连栽木麻黄土壤微生物数量变化的研究,但由于传统微生物培养方法的局限性,未能充分揭示连栽条件下土壤微生物群落结构及多样性的变化规律[19]。本研究利用空间代替时间的方法,采用高通量测序技术扩增细菌的16S rRNA基因高变区,并对物种进行注释及相对丰度分析,探索连栽木麻黄根际土壤细菌群落变化规律,为揭示木麻黄连栽障碍机制提供科学依据。
1 材料与方法
1.1 研究区概况
试验样地选址于福建惠安赤湖国有防护林场(118°55′E,24°35′N),该林场占地面积约433 hm2,地处中国南亚热带气候区。该地区夏季多台风和暴雨,秋冬季盛行东北风。年均温19.8℃,极端低温1℃,极端高温35℃,年降雨量1029 mm,年蒸发量2000 mm[20]。该林场栽植有3个不同代数的木麻黄人工林,其中第一代木麻黄林(First rotation plantation,FCP)栽植于1987年,第二代(Second rotation plantation,SCP)栽植于2011年,第三代(Third rotation plantation,TCP)栽植于2014年。不同样地的伴生树种和林下植被基本一致,伴生树种均为少量的台湾栾树(Koelreuteriaelegans)和潺槁木姜子(Litseaglutinosa(Lour.)C. B. Rob.),林下植被均为霍香蓟(AgeratumconyzoidesL.)和鬼针草(BidenspilosaL.)。土壤质地均为风积黄沙土。
1.2 土壤样品的采集
2018年7月,于福建惠安赤湖境内的国有防护林场内设置样地:在FCP、SCP和TCP设立3个林地概况相近的20 m×20 m实验样地,每个样地设3个重复样方,共9个样方。采集木麻黄根际土壤方法参考王圳等[21]的“抖落法”:沿“S”形路径在每个样方内选择20株平均胸径、树高相近的木麻黄,去除其落叶层后逐层挖去上层覆土,剪下细根分枝并轻轻抖动,仍粘在细根上的即为根际土壤,用小毛刷收集至自封袋中保存备用。将每个样方内取得的20份根际土壤混匀为1份土样,共获得9份土壤样品。土样通过2 mm筛选后其中一部分保存于-80℃冰箱,另一部分土样4℃冰箱保存用于测定土壤中微生物多样性。
1.3 根际土壤DNA提取及PCR扩增
利用试剂盒BioFast Soil Genomic DNA Extraction Kit(BioFlux公司,中国)提取木麻黄根际土壤微生物基因组总DNA。DNA浓度通过Nanodrop进行测定,并用1.2%琼脂糖凝胶电泳检测DNA 的质量。再将基因组总DNA用无菌水稀释至1 ng/μL。以稀释后的基因组DNA为模板,采用 Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶(New England Biolabs公司,美国)对细菌16S rRNA基因的V4区域进行扩增。扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)[22]。采用50 μL PCR扩增体系,反应程序为:98℃预变性1 min;30个循环包括(98℃,10 sec;50℃,30 sec;72℃,30 sec);72℃,5 min。扩增后用2%琼脂糖凝胶电泳检测PCR产物的质量。将PCR产物送至北京诺禾至源科技有限公司进行高通量测序。
1.4 数据分析
测序所得的原始数据经Fast QC软件进行质控后,利用Cutadapt(V1.9.1)软件去除短序列(<200 bp)及低质量序列(q<25)[23]。通过Mothur方法与SILVA数据库对97%相似度的有效序列分配操作分类单元(Operational Taxonomic Units,OTUs)[24]。依据物种分类信息绘制物种分类条形图和物种丰度热图[25]。再通过QI-IME 软件计算样品的覆盖度和多样性指标[26- 28]。运用PICRUSt软件对菌群的功能和代谢途径进行预测分析[29]。
2 结果与分析
2.1 连栽木麻黄根际土壤细菌群落OTU组成及结构
通过IonS5TMXL测序平台,从3个林地概况相近的不同连栽代数木麻黄根际土壤中总共得到338560条有效序列,平均每个样品的有效序列为37618条。以97%的序列相似性阈值将有效序列聚类为17627个OTU。其中FCP均值为1905个OTU,SCP均值为2046个OTU,TCP均值为1924个OTU。平均而言,约98.6%的有效序列可聚类为门级,但仅有38.68%以上的有效序列可聚类为属级。稀释曲线可直接反映所抽取的优化序列深度是否合理,并间接反映样品中的物种丰富度[30]。由图1可知,抽取的序列条数达到25000条以上,曲线趋于平坦,表明不同处理土壤所测的序列库容都能够较好地反映细菌群落种类数量,测序数据量基本合理。
Venn图可以直观地体现不同代数木麻黄根际土壤细菌群落OTU组成的差异性及重叠情况(图2)。维恩分析结果表明,在OTU水平上,FCP中特异性细菌OTU占总OTU序列数的9.86%(341),SCP中特异性细菌OTU占14.68%(508),TCP中特异性细菌OTU占9.62%(333)。此外,FCP与SCP共有的OTU数量为292(8.44%),SCP与TCP共有的OTU数量为345(9.97%),FCP与TCP共有的OTU数量为177(5.12%)。FCP、SCP、TCP根际土壤中共有的细菌OTU数量为1464(42.31%)。
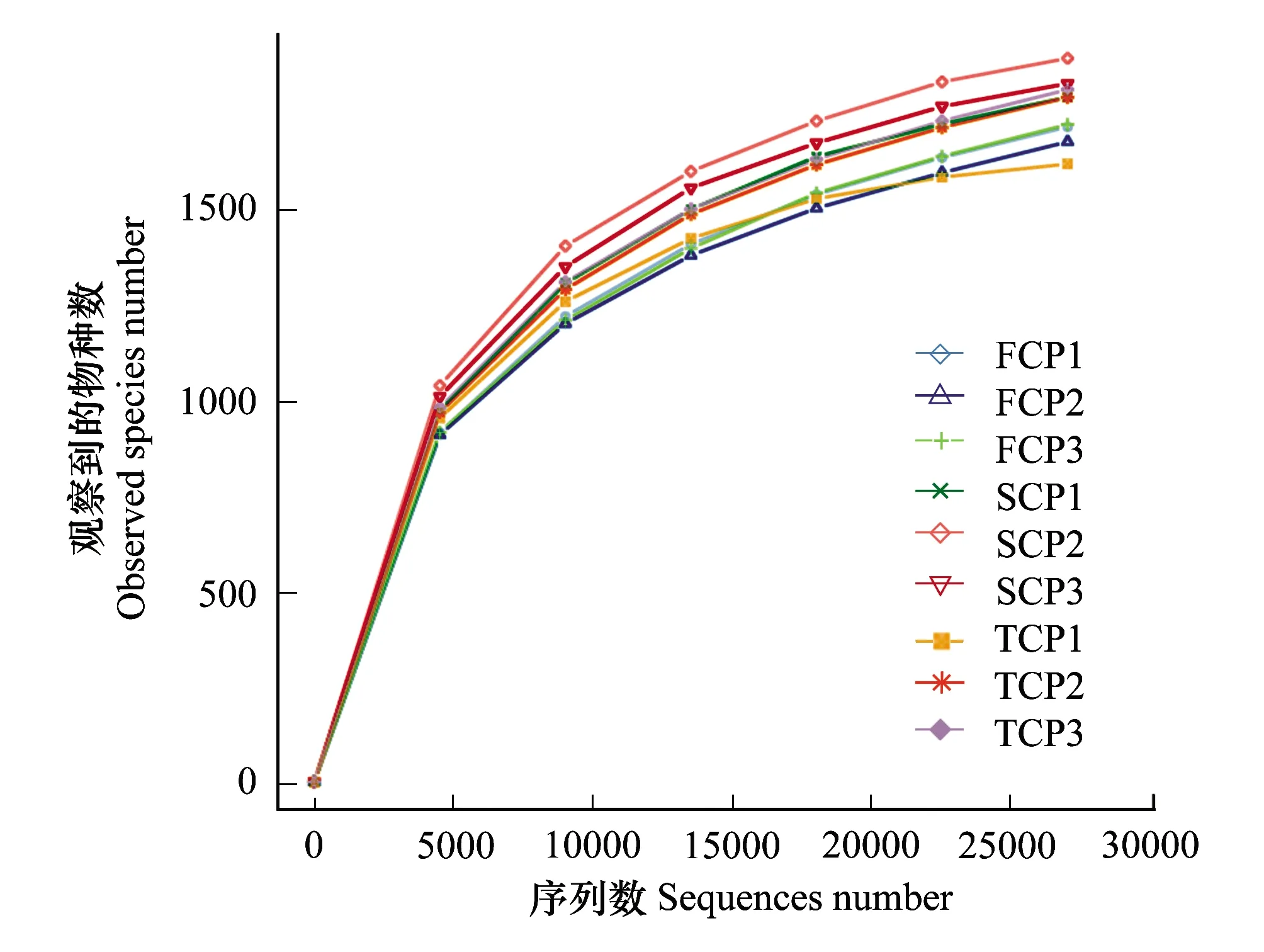
图1 木麻黄根际土壤样本微生物群落的稀释曲线Fig.1 Rarefaction curves of microbial communities in rhizosphere soils samples of C. equisetifolia FCP:第一代First rotation plantation;SCP:第二代Second rotation plantation;TCP:第三代Third rotation plantation
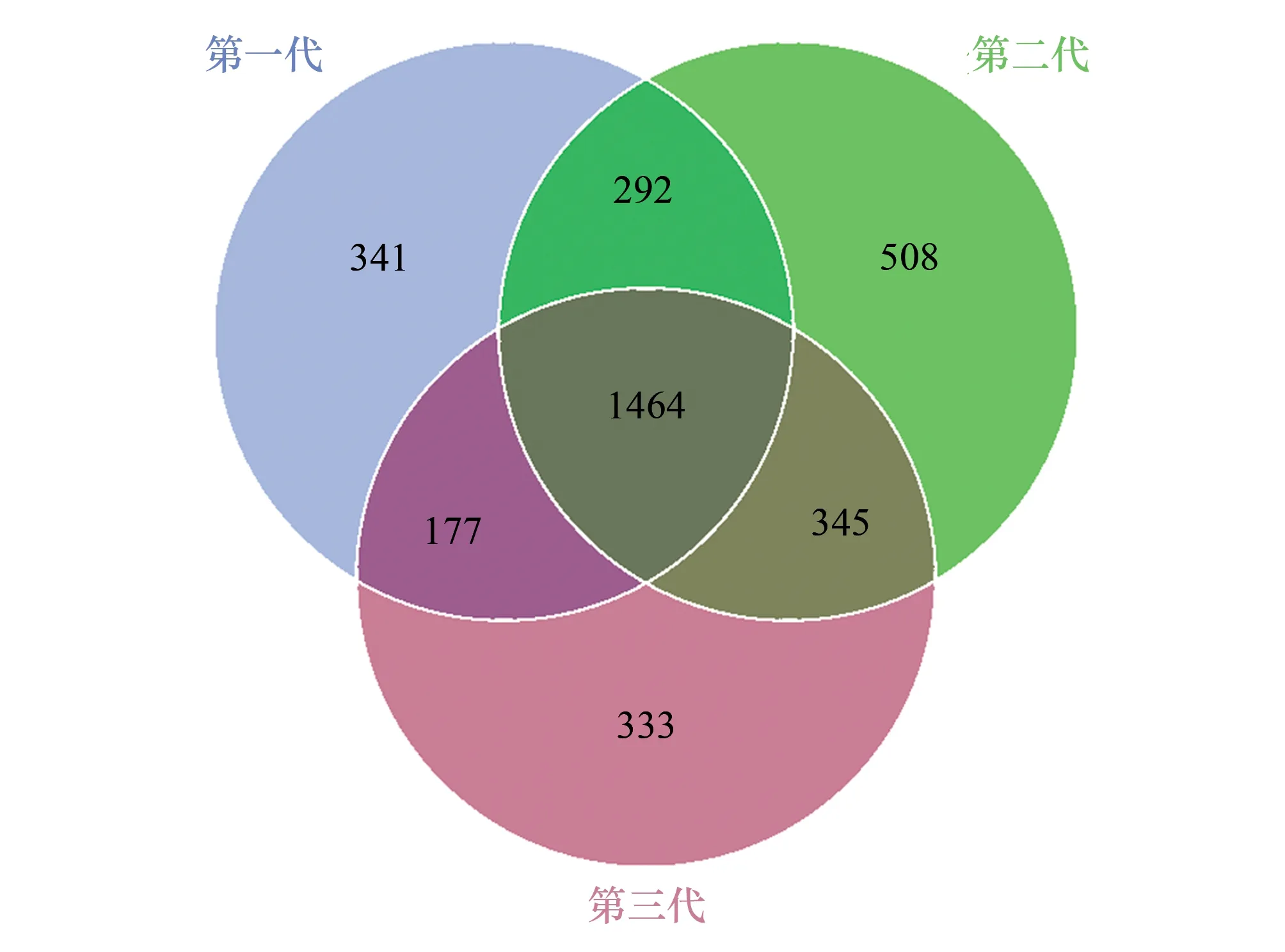
图2 基于OTU丰度的不同代数木麻黄根际土壤细菌群落维恩图Fig.2 Venn diagram of bacterial communities in rhizosphere soil of different rotations of C. equisetifolia based on OTUs abundance
2.2 连栽木麻黄根际土壤细菌群落结构
2.2.1连栽木麻黄根际土壤细菌群落多样性分析
通过土壤样品中细菌群落多样性分析指数,对连栽木麻黄根际土壤细菌群落物种丰富度和均匀度进行评估(cutoff=27075)。由表1可知,随着连栽代数增加,Chao1指数、ACE指数均逐代下降,而Observed species、Shannon指数则呈现先上升后降低的趋势,但差异均不显著(P>0.05),Simpson指数几乎没有发生变化。Shannon指数分析显示,木麻黄根际土壤SCP(8.874)中细菌多样性相对较高,FCP(8.780)最低。从Chao1指数分析来看,FCP物种丰富度最高(2086.012),SCP次之(2005.244),TCP最低(2002.447)。
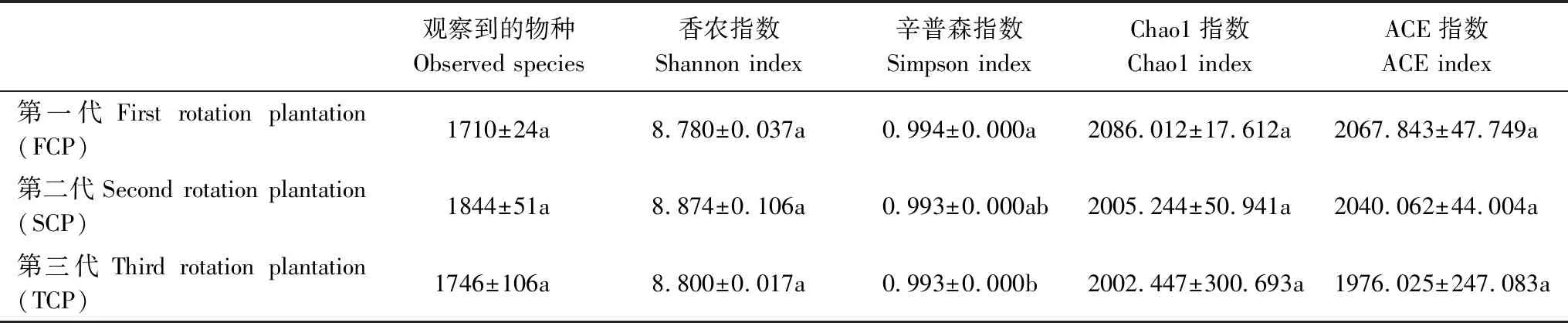
表1 连栽木麻黄根际土壤细菌群落丰富度和多样性指数
每列不同字母表示差异达显著水平(P≤0.05,n=3)
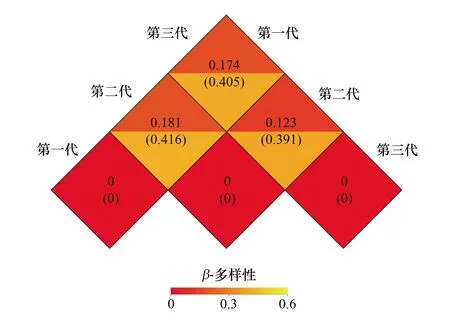
图3 不同代数木麻黄根际土壤样本间的Weighted Unifrac距离和Unweighted Unifrac距离Fig.3 Weighted and unweighted Unifrac distances between rhizosphere soils samples of different rotations of C. equisetifolia
通过Weighted Unifrac距离和Unweighted Unifrac距离来比较两个样品间物种多样性的相异程度。FCP和SCP之间的Weighted Unifrac距离和Unweighted Unifrac距离分别为0.181和0.416,FCP和TCP之间分别为0.174和0.405,SCP和TCP之间分别为0.123和0.391。
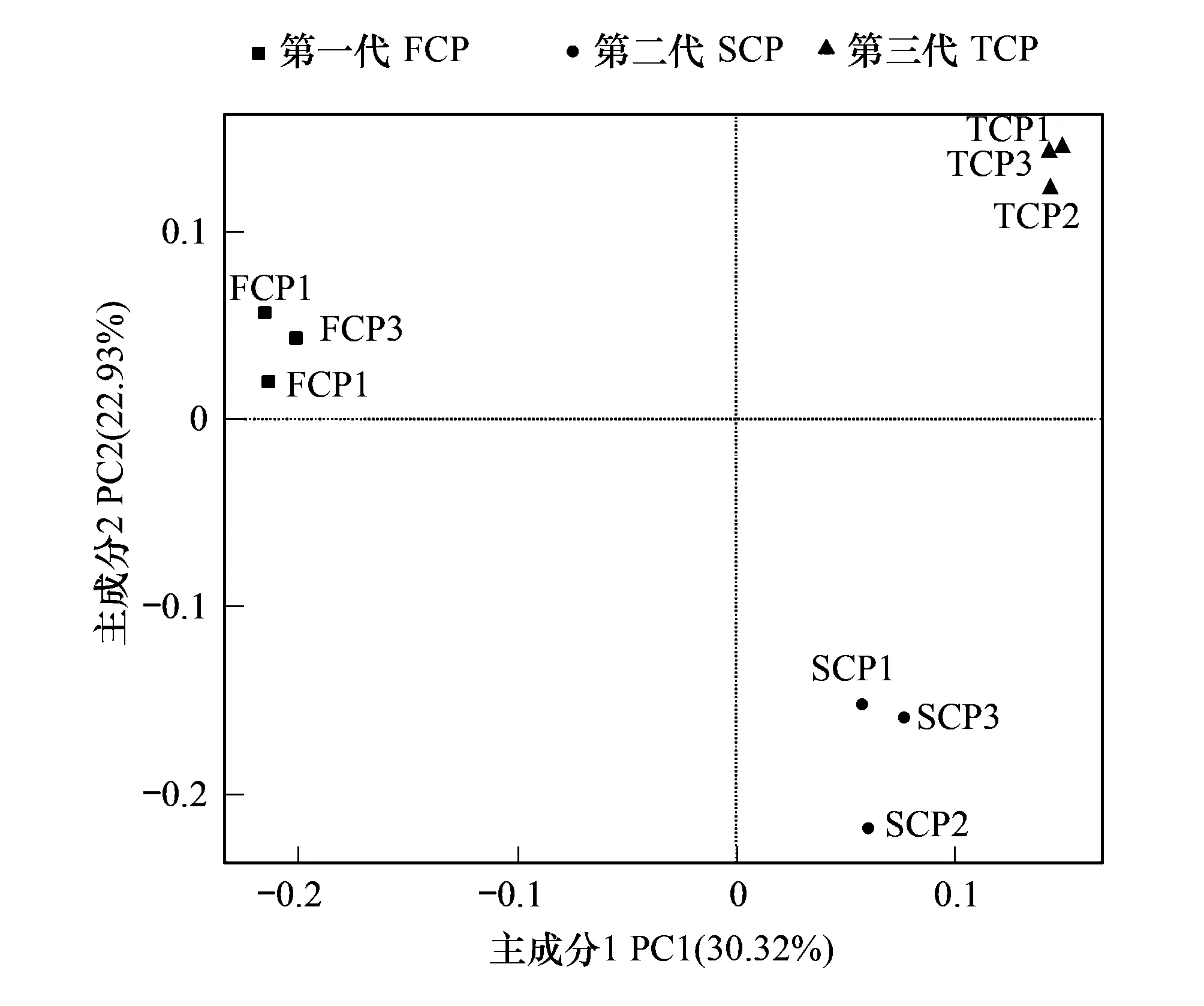
图4 连栽木麻黄根际土壤细菌群落PcoA分析Fig.4 PcoA analysis of bacterial communities from rhizosphere soils of continuous rotations of C. equisetifolia
2.2.2连栽木麻黄根际土壤细菌群落PCoA分析与UPGMA聚类分析
基于OTU的木麻黄根际土壤细菌群落主坐标分析(Principal Co-ordinates Analysis,PCoA)结果见图4,主成分1(PC1)与主成分2(PC2)分别解释变量方差的30.32%、22.93%,两者累计贡献率达53.25%。PC1将FCP中的细菌群落与SCP、TCP明显区分开,PC2将SCP中的细菌群落与FCP、TCP明显区分开。UPGMA(Unweighted Pair-group Method with Arithmetic Mean)聚类分析结果见图5,SCP和TCP的细菌群落结构聚集为一个群体,再与FCP聚集在一起形成系统发生树,说明FCP与SCP、TCP二者存在较大差异。
2.2.3连栽木麻黄根际土壤细菌群落组成及结构变化
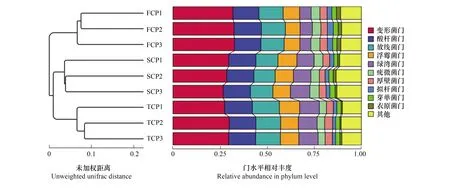
图5 连栽木麻黄根际土壤的UPGMA聚类分析Fig.5 UPGMA analysis of bacterial communities from rhizosphere soil of continuous rotations of C. equisetifolia
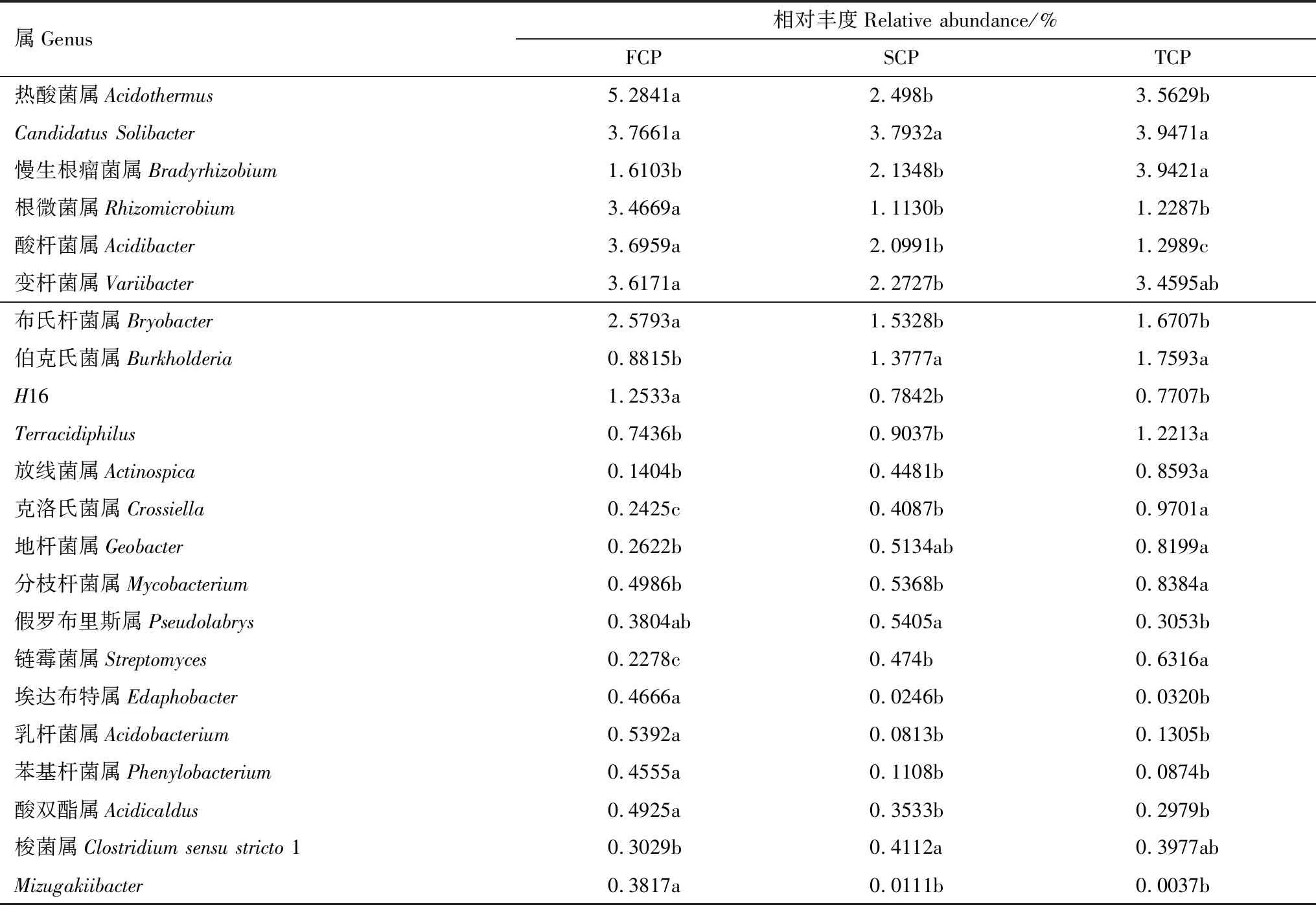
在木麻黄根际土壤细菌群落中共检测到10个门,优势类群依次是变形菌门(Proteobacteria)(30.27%—34.42%)、酸杆菌门(Acidobacteria)(28.10%—32.21%)、放线菌门(Actinobacteria)(14.86%—18.84%)、疣微菌门(Verrucomicrobia)(3.79%—8.09%)(图6)。由表2可知,在属水平上,热酸菌属(Acidothermus)、CandidatusSolibacter、慢生根瘤菌属(Bradyrhizobium)、根微菌属(Rhizomicrobium)、酸杆菌属(Acidibacter)、变杆菌属(Variibacter)、布氏杆菌属(Bryobacter)是根际土壤细菌群落的优势属(丰度>1%),其中FCP中最高丰度属是热酸菌属(Acidothermus),而SCP、TCP根际土壤中CandidatusSolibacter相对丰度最高。随着木麻黄连栽代数增加,根际土壤中热酸菌属(Acidothermus)、根微菌属(Rhizomicrobium)、酸杆菌属(Acidibacter)、布氏杆菌属(Bryobacter)的相对丰度大体呈下降趋势,其中酸杆菌属(Acidibacter)的相对丰度在FCP、SCP、TCP之间的下降趋势达显著水平(P<0.05)。与之相反,慢生根瘤菌属(Bradyrhizobium)的相对丰度随连栽代数的增加而增加。此外,从木麻黄根际土壤中前35个优势细菌在属水平的群落热图分析也可以看出,木麻黄连栽后土壤细菌群落组成结构发生了显著变化(图7)。
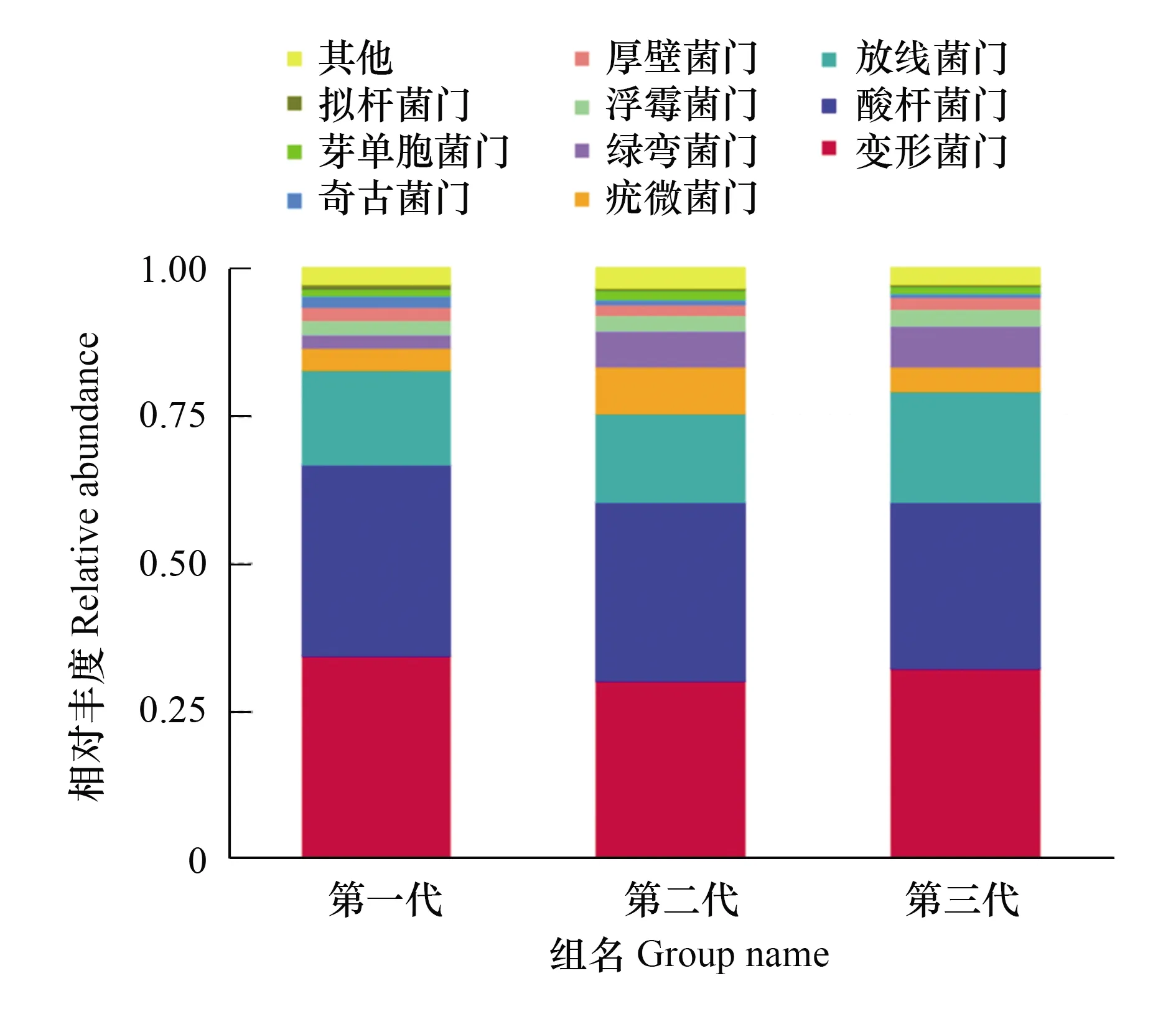
图6 连栽木麻黄根际土壤优势细菌在门水平的群落相对丰度Fig.6 The relative abundance of predominant bacteriain rhizospheric soil samples of continuous rotations of C. equisetifolia at the phylum level
3 结论与讨论
植物根系与根际微生物形成的植物-微生物群落综合体,是“植物-土壤-微生物”三者进行根际互作过程的重要场所[31]。根际微生物是土壤生态系统能量流动、物质循环和信息传递最主要的驱动者,对维持土壤生产力至关重要[32]。本研究通过高通量测序技术对连栽木麻黄根际土壤细菌群落变化进行探究。结果表明连栽后根际土壤细菌群落的组成与结构发生了显著变化。由多样性分析可知,木麻黄根际土壤细菌群落的Simpson、Chao1、ACE指数随着连栽代数的增加而下降,Observed species、Shannon指数呈现先增加后减少的趋势,变化趋势不一致的原因可能是由于土壤理化性质不完全一致、林龄差异、森林凋落物等因素导致。这与韩亚飞[33]研究杨树土壤细菌群落多样性所提出的观点相似,但与李延茂等[34]通过DGGE分析法研究杉木根际土壤细菌群落的结果不一致。推测可能是由于技术方法不同、树种差异、地域差别、土壤异质性等因素造成研究结果不一致。
进一步分析连栽木麻黄根际土壤细菌群落组成与结构变化。由图6可知,不同连栽代数木麻黄根际土壤细菌在门水平上的最优势类群是变形菌门(Proteobacteria),分别占FCP、SCP、TCP根际土壤总细菌丰度的34.42%、30.27%、32.34%,证实了变形菌门是陆地土壤生态系统细菌群落的优势类群,与Bazylinski等[35]的研究结果一致。慢生根瘤菌属(Bradyrhizobium)是变形菌门α变形菌纲的一种根瘤菌[36],可以与寄主植物形成共生关系,将大气中的游离氮固定成寄主生物可以利用的形式,例如氨(NH3)或铵(NH4+)[37]。木麻黄是重要的结瘤共生固氮树种之一[38],可以富集根瘤菌以适应贫瘠的滨海沙地环境。在本研究中,随着连栽代数的增加,慢生根瘤菌属(Bradyrhizobium)的相对丰度随之增加约132.57%、244.81%,且FCP、SCP两者与TCP的差异达显著水平(P<0.05)。与朱琳等[39]研究大豆连作土壤细菌群落多样性所得的结论一致。与之相反,根际土壤中的热酸菌属(Acidothermus)、根微菌属(Rhizomicrobium)、酸杆菌属(Acidibacter)、布氏杆菌(Bryobacter)的相对丰度呈下降趋势。变形菌门下的根微菌属(Rhizomicrobium)是在土壤氮循环、解磷过程以及降解有机物过程中发挥重要作用的有益微生物[40]。在本研究中,随着连栽代数的增加,根微菌属(Rhizomicrobium)的相对丰度随之降低约311.49%、282.16%,且FCP与SCP、TCP两者的差异达显著水平(P<0.05)。酸杆菌门下的酸杆菌属(Acidibacter)是具有分解蛋白质和摄取环境周围酸性物质的有益菌属[41]。在本研究中,随着连栽代数的增加,酸杆菌属(Acidibacter)的相对丰度随之降低约176.07%、284.54%,且FCP、SCP与TCP三者之间的差异达显著水平(P<0.05)。由此可见,木麻黄连栽后根际土壤微生物群落结构发生了改变。这种现象可能是由于根系化感物质所产生的间接生态效应引起的,从而导致根际微生物发生恶化偏移。化感物质可以直接或间接影响根际微生物的代谢和生长发育,进而对根际微生物的种类、数量和分布产生影响[42]。如田给林[43]研究发现,外源添加阿魏酸能显著促进草莓专化型尖孢镰刀菌的生长及孢子萌发,从而间接侵染草莓植物,造成连作障碍的发生。刘金光等[44]研究发现,低浓度的苯甲酸对曲霉菌属和镰刀菌属有显著促进作用,造成根际土壤微生物群落结构失衡。
本研究证实了木麻黄长期单一化栽植后,根际土壤细菌群落结构发生了显著变化,导致土壤微生态失衡,间接造成木麻黄连栽障碍问题。然而,连栽障碍形成及加重的原因不是单一孤立的,是众多因素彼此影响、相互制约的结果。唯有建立在充分了解“土壤-微生物-根际”相互关系的基础上,才能系统地认识连栽木麻黄的根际生态效应。因此,对于木麻黄根际土壤化感物质如何介导土壤微生物区系定向演变?以及关键的特异微生物如何在木麻黄连栽障碍形成的根际生态学中扮演重要角色,仍需实验验证讨论。
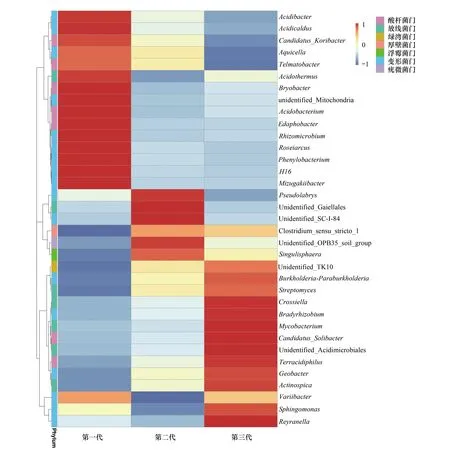
图7 连栽木麻黄根际土壤优势细菌在属水平的群落热图分析Fig.7 Heat map analysis of the main bacteria in rhizospheric soil of continuous rotations of C. equisetifolia at the genus level
表2 连栽木麻黄根际土壤在属水平的细菌群落信息
Table 2 Information regarding the bacterial community at the genus level inrhizospheric soil ofC.equisetifoliaunder successive rotations
属Genus相对丰度Relative abundance/%FCPSCPTCP热酸菌属Acidothermus5.2841a2.498b3.5629bCandidatus Solibacter3.7661a3.7932a3.9471a慢生根瘤菌属Bradyrhizobium1.6103b2.1348b3.9421a根微菌属Rhizomicrobium3.4669a1.1130b1.2287b酸杆菌属Acidibacter3.6959a2.0991b1.2989c变杆菌属Variibacter3.6171a2.2727b3.4595ab布氏杆菌属Bryobacter2.5793a1.5328b1.6707b伯克氏菌属Burkholderia0.8815b1.3777a1.7593aH161.2533a0.7842b0.7707bTerracidiphilus0.7436b0.9037b1.2213a放线菌属Actinospica0.1404b0.4481b0.8593a克洛氏菌属Crossiella0.2425c0.4087b0.9701a地杆菌属Geobacter0.2622b0.5134ab0.8199a分枝杆菌属Mycobacterium0.4986b0.5368b0.8384a假罗布里斯属Pseudolabrys0.3804ab0.5405a0.3053b链霉菌属Streptomyces0.2278c0.474b0.6316a埃达布特属Edaphobacter0.4666a0.0246b0.0320b乳杆菌属Acidobacterium0.5392a0.0813b0.1305b苯基杆菌属Phenylobacterium0.4555a0.1108b0.0874b酸双酯属Acidicaldus0.4925a0.3533b0.2979b梭菌属Clostridium sensu stricto 10.3029b0.4112a0.3977abMizugakiibacter0.3817a0.0111b0.0037b
每列不同字母表示差异达显著水平(P<0.05,n=3)
