HSPA12B对Aβ1-42诱导PC12细胞tau蛋白磷酸化的影响①
2020-06-12王萍
王 萍
(绍兴市人民医院,绍兴 312000)
阿尔茨海默病(Alzheimer′s disease,AD)是一种以老年斑和神经纤维缠结为主要病理特征的神经退行性疾病[1]。淀粉样β蛋白(amyloid β-protein,Aβ)的聚集诱导神经毒性、tau蛋白磷酸化和神经元凋亡[2,3]。因此,任何一种能降低Aβ诱导tau磷酸化的蛋白,都可能成为治疗和预防AD的新靶点。热休克蛋白A12B (heat shock protein A12B,HSPA12B)是HSP70家族的新成员[4]。HSPA12B在脑中高表达,与脑的发育过程密切相关[5]。研究报道,在中枢神经系统(central nervous system,CNS)应激过程中,HSPA12B发挥保护作用,可抑制缺血性脑损伤引起的神经元凋亡,改善缺血引起的神经功能障碍,维持血脑屏障通透性,敲除HSPA12B可显著上调神经元中活化的caspase-3表达,促进神经元的凋亡[6-8]。AD病程中神经元的凋亡主要通过激活caspase-3途径,caspase-3能直接和特异地调节tau蛋白磷酸化[9,10]。本实验选用Aβ1-42诱导PC12细胞,模拟AD病程中神经元损伤模型,观察HSPA12B对AD的重要病理改变tau蛋白磷酸化的影响,以期为AD的预防治疗提供新的思路。
1 材料与方法
1.1材料 PC12细胞购自American Type Culture Collection;DMEM培养基购自美国Gibco公司;胰蛋白酶购自美国HyClone公司;Aβ1-42购自上海圣翔生物科技有限公司;Lipofectamine3000、OptiMEM 购自美国Invitrogen公司; HSPA12B多克隆抗体(美国Sigma 公司,HPA13659-100UL,R04942);phosphor-Tau (pS396,p-tau,32275,F2807); total-Tau (t-tau,sc-58860,L2315)购自美国Santa cruz公司;β-actin(杭州达文生物有限公司,DW9562,1508)。大鼠HSPA12B和阴性对照siRNA(NC)的siRNAs购自广州锐博。CLAS100型细胞培养箱购自美国Thermo公司;电泳仪、蛋白印迹检测系统购自美国Bio-Rad公司。
1.2方法
1.2.1细胞分组培养 PC12细胞加入DMEM培养基(含100 U/ml青毒素、10 μg/ml链霉素、10 mmol L-谷氨酰胺及10%小牛血清)于37℃、5% CO2培养箱培养。细胞达到80%融合时换成无血清的DMEM培养基培养过夜后进行实验。将处于对数生长期的PC12细胞随机分为4组:空白对照组、DMSO对照组、Aβ单一刺激组(取Aβ1-42终浓度为20 μmol/L刺激后继续培养12 h)、Aβ刺激HSPA12B-siRNA组。
1.2.2Western blot 常规提取各组细胞总蛋白,采用Bradford法进行蛋白质定量。一抗为兔抗HSPA12B多克隆抗体;小鼠抗p-tau、t-tau、β-actin抗体,二抗为HRP标记的山羊抗兔及山羊抗小鼠抗体。用ECL(pierce)进行检测,柯达胶片曝光显影。以β-actin为内参,目的蛋白与β-actin的灰度比值代表蛋白表达水平,实验重复3次,取平均值。
1.2.3HSPA12B干扰和过表达转染 HSPA12B特异siRNAs靶序列为:Si1 (5′-GGCTTCCTTCTCTGTG-GTT-3′)、Si2(5′-GGGTGGACCTGGCCTTTGA-3′)和Si3(5′-GCGGCCCTTATGGTGCAGT-3′)。按照脂质体Lipofectamine3000转染要求转染HSPA12B-siRNAs和过表达质粒。转染48 h后,用转染细胞进行后续实验。
1.2.4观察指标 观察并比较Aβ组、Aβ+HSPA12B-siRNA组、normal组、DMSO组PC12细胞内HSPA12B、p-tau及t-tau蛋白表达水平。

2 结果
2.1Aβ1-42诱导的PC12细胞中tau蛋白磷酸化 用Aβ1-42(20 μmol/L)处理PC12细胞12 h,检测tau蛋白的表达和磷酸化。与normal组相比,Aβ诱导p-tau差异具有统计学意义(P<0.05),而tau的总表达(t-tau)保持不变,0.5% DMSO组差异无统计学意义(均P>0.05,图1)。
2.2Aβ1-42诱导的PC12细胞中HSPA12B的表达 用20 μmol/L Aβ1-42处理12 h后,与normal组相比,HSPA12B表达显著增加,差异具有统计学意义(P<0.05);0.5%DMSO组差异无统计学意义(P>0.05,图2)。
2.3沉默HSPA12B增强Aβ1-42诱导的PC12细胞中tau蛋白磷酸化 为了降低PC12细胞中HSPA12B的表达,Western blot检测了3条特异的HSPA12B siRNAs (Si1、Si2和Si3)和一条阴性的siRNA(NC)干扰效率。PC12细胞内分别转染终浓度为50 nmol/L 的HSPA12B-siRNAs和NC,48 h后,检测结果显示: Si3显著下调HSPA12B蛋白表达,干扰效率达70%;Si2次之达57%;Si1的效率仅有35%;而NC组与normal组无统计学差异(图3A)。因此,选取干扰效率最佳的Si3进行后续实验。HSPA12B-Si3沉默可部分消除Aβ1-42诱导的HSPA12B表达(图3B),并显著增加了tau蛋白磷酸化(图3B)。这提示HSPA12B可能在Aβ1-42诱导的PC12细胞tau磷酸化中发挥调节作用。
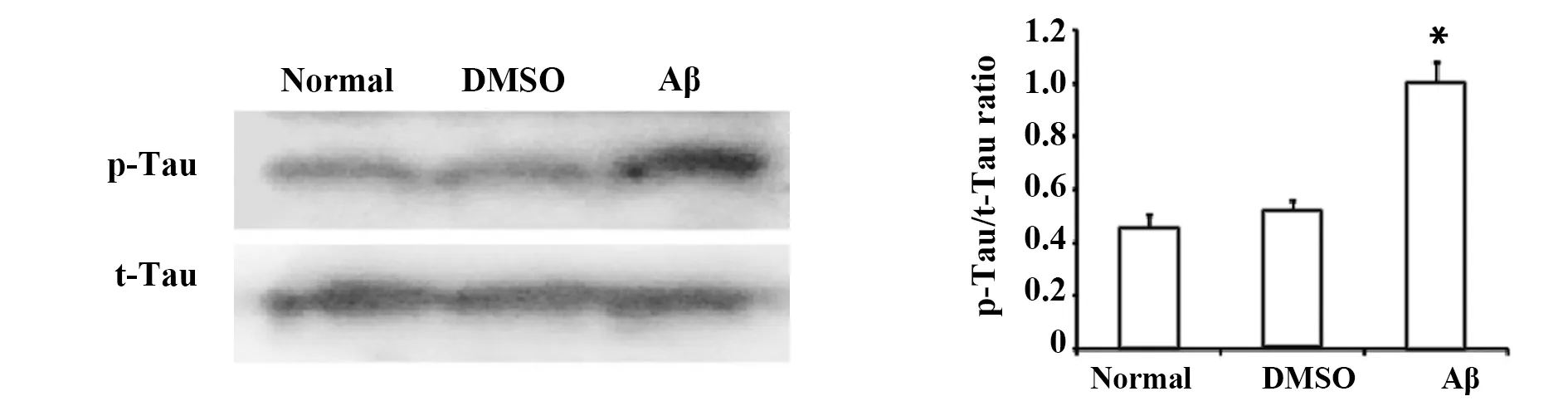
图1 Aβ诱导PC12细胞中tau蛋白磷酸化水平比较Fig.1 Aβ-induced tau phosphorylation in PC12 cellsNote: *.P<0.05,vs normal.
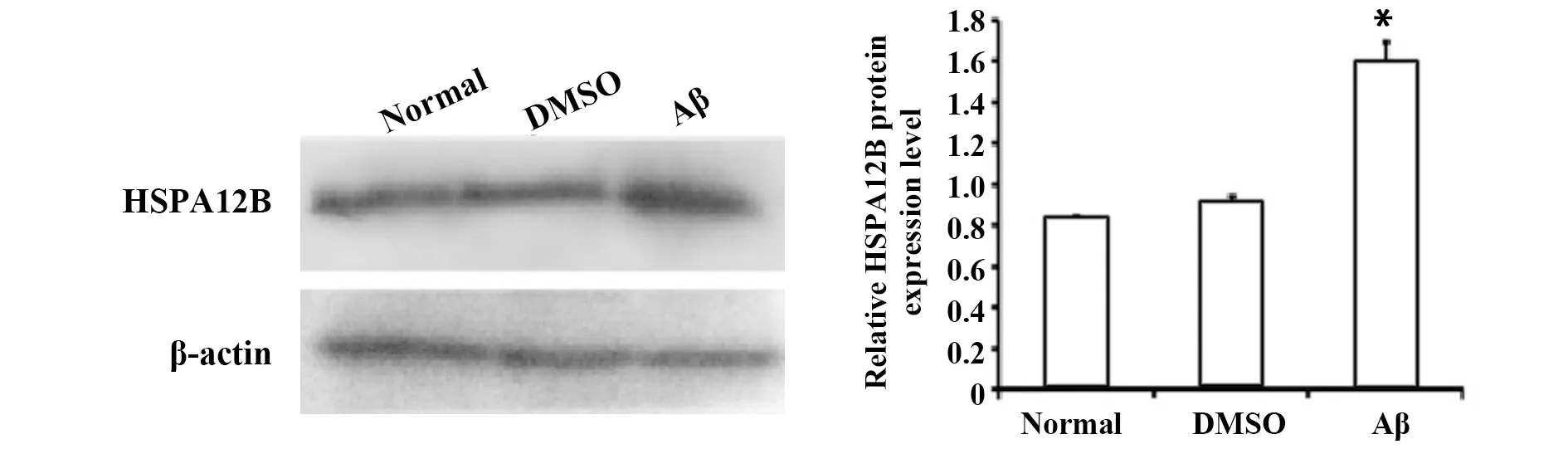
图2 Aβ诱导PC12细胞中HSPA12B蛋白水平比较Fig.2 Aβ-induced HSPA12B expression in PC12 cellsNote: *.P<0.05,vs normal.
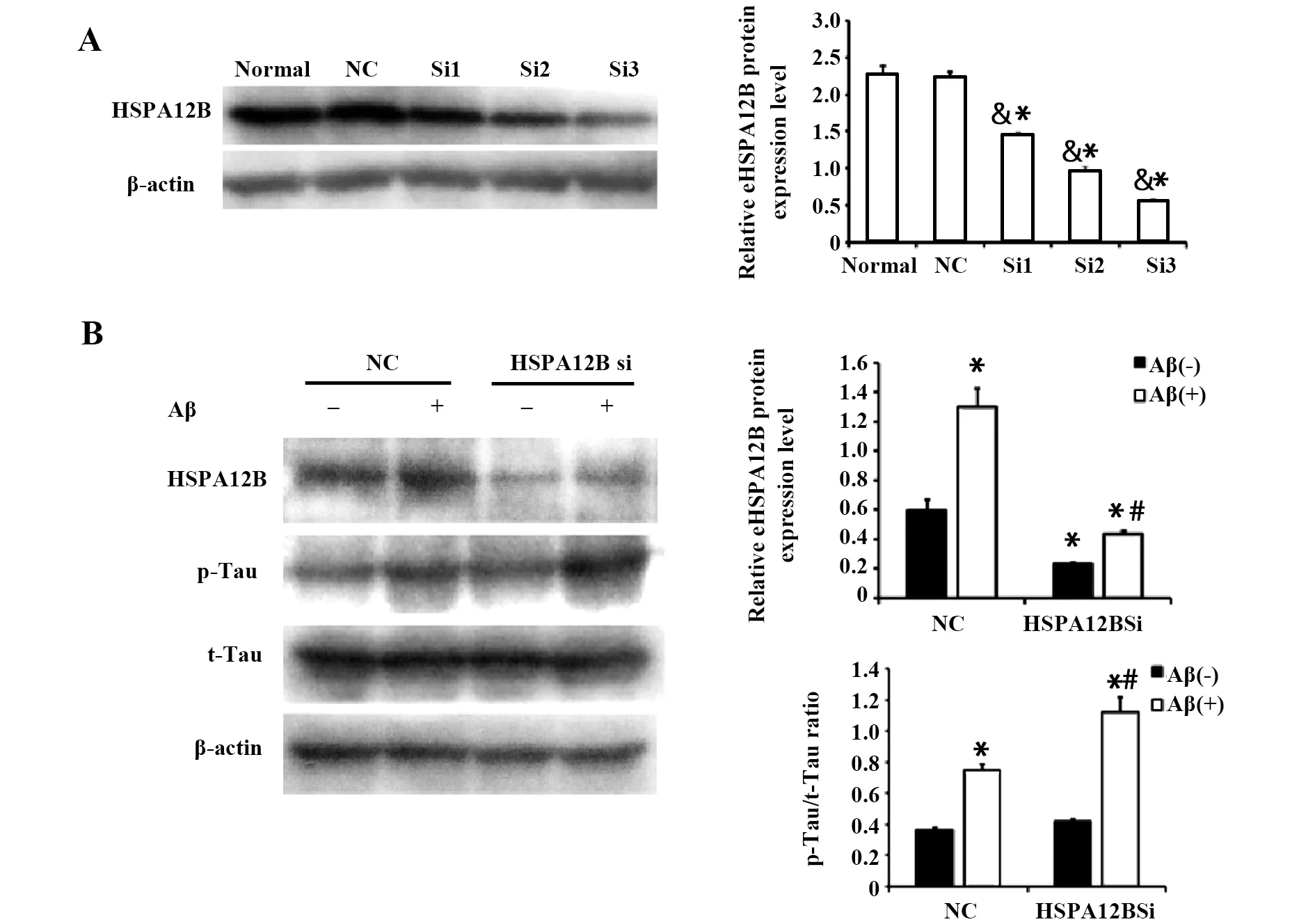
图3 HSPA12B基因沉默增强Aβ诱导的PC12细胞中tau磷酸化蛋白水平Fig.3 Knockdown HSPA12B expression in PC12 cells efficiency increased tau phosphorylation induced by AβNote: A.Effect of silencing HSPA12B protein in PC12 cells;B.HSPA12B-Si3 silencing significantly blocked Aβ mediated up-regulation of HSPA12B expression in PC12 cells,and Aβ-induced tau phosphorylation was significantly increased than that of Aβ group. &.P<0.05,vs the normal cells;*.P<0.05,vs the NC cells;#.P<0.05,vs Aβ-treated PC12 cells.
3 讨论
AD是老年人最常见的神经退变性疾病,过度磷酸化的tau蛋白在AD中更容易聚集,因此如何降低tau蛋白有望成为AD治疗的途径。本研究探讨了HSPA12B在Aβ诱导PC12细胞tau蛋白磷酸化的调节作用。Aβ1-4220 μmol/L作用12 h后,HSPA12B表达增加;同时tau蛋白磷酸化水平增强。提示HSPA12B可通过抑制tau蛋白磷酸化对Aβ诱导PC12细胞所致的神经毒性过程中起保护作用。
Aβ诱导的神经毒性伴随着兴奋性毒性、促炎症反应和促凋亡性事件以及氧化应激,氧化应激本身既介导直接神经毒性作用,也介导间接tau蛋白过度磷酸化[11,12]。研究表明,Aβ诱导的神经毒性作用主要是通过激活皮层神经元和海马神经元中tau蛋白磷酸化的升高来实现[13,14]。尤其在PC12细胞中,tau磷酸化水平的升高被认为是Aβ诱导的神经毒性机制之一[15]。因此,阻断tau蛋白磷酸化可作为对Aβ诱导的细胞死亡的保护作用。热休克蛋白70 (HSP70)具有防止β淀粉样蛋白/tau蛋白聚集的能力,使其成为潜在的药物靶点[16]。HSPA12B 是最近发现的HSP70 家族的新成员,在CNS的神经元和胶质细胞都有表达[17]。文献报道了过表达HSPA12B,能显著缩小MCAO引起的脑梗死面积,显著减轻海马神经元损伤[18]。在缺氧诱导的PC12细胞中敲除HSPA12B可明显上调活性caspase-3活性,提示HSPA12B在PC12细胞凋亡中起重要作用[9]。本研究发现,Aβ可诱导PC12细胞tau蛋白的过度磷酸化,同时HSPA12B的表达显著增强。诱导型HSP家庭成员在应激反应中发挥保护作用的标志之一就是表达增强。敲除HSPA12B显著增强了PC12细胞tau蛋白的磷酸化。提示Aβ诱导的tau蛋白过度磷酸化受HSPA12B的影响,HSPA12B在PC12细胞中发挥抗Aβ的神经保护作用,为AD治疗提供新的干预靶点。
