右美托咪定腹腔注射对老龄大鼠全脑缺血再灌注损伤的预防作用及其机制
2020-06-12陶静周铭孙秋雁彭安林
陶静,周铭, 孙秋雁,彭安林
1武汉市肺科医院药学部,武汉 430030;2 武汉市皮肤病防治院; 3 湖北中医药大学药学院
脑血管疾病为当今全球主要的致死性疾病;其中,脑缺血、卒中等缺血性脑病发病率较高,占比较大,尤其是脑缺血发病人数逐年递增[1]。临床上脑缺血治疗的原则是尽可能快地恢复缺血区组织血液灌注。然而,脑缺血治疗中恢复血流灌注的同时也产生了大量的活性氧(ROS),ROS会加剧缺血区组织的氧化应激过程,导致大量氧自由基进一步释放,造成脑缺血再灌注损伤[2]。前期有研究[3~5]报道,右美托咪定(Dex)可通过抑制氧化应激反应减轻大鼠全脑缺血再灌注损伤,但具体的病理生理机制仍不明确。2019年1~12月,本研究进一步验证了Dex腹腔注射对老龄大鼠全脑缺血再灌注损伤的预防作用,并探讨了其预防机制,为丰富临床治疗及机制探讨提供参考。
1 材料与方法
1.1 动物、试剂、仪器 清洁级老年SD大鼠36只,月龄20~22个月,体质量(450±20)g,购于华中科技大学实验动物中心,动物合格证号:NO.42009800001823。于室温、常规环境下喂养。Dex(江苏恒瑞医药有限公司,批号:10061534);超氧化物歧化酶(SOD )、过氧化氢酶(CAT)、丙二醛(MDA)等生化试剂盒均购于南京建成生物工程研究所。抗体包括β-actin(稀释浓度比为1∶3 000)、核因子E2相关因子(Nrf2)(稀释浓度比为1∶500)、血红素单加氧化酶-1(HO-1)(稀释浓度比为1∶400)等,兔种属来源一抗均购于美国Abcom公司,兔二抗购于武汉Antijie Biocom有限公司。BCA蛋白测定试剂盒、Western blotting 电泳凝胶试剂盒均购自武汉百奥斯公司。FA1004分析天平购自北京中仪公司。飞鸽牌离心机购自上海仪天科学仪器有限公司。TB-85型恒温水浴锅购自日本岛津公司;KHB ST-360酶标仪购自上海科华有限公司。免疫印迹Western blotting电泳系统购自美国Bio-Rad有限公司。
1.2 大鼠分组、Dex给予方法、脑缺血再灌注操作方法 老年大鼠适应喂养两周后,采用随机数字表法分为Dex组(n=12)、模型组(I/R,n=12)、假手术组(S,n=12)。S组无电凝闭塞及夹闭双侧动脉处理。I/R组和Dex组采用文献[6,7]报道方法,并根据实际情况进行改良后,运用四动脉阻断法制备全脑缺血再灌注损伤大鼠模型:自由饮水、禁食12 h后,10%水合氯醛腹腔麻醉大鼠(0.4 mL/100 g)固定于操作台,备皮、暴露颈部,于第1颈椎处采用2.5%碘伏进行消毒,单极电凝对准横突孔烧灼双侧椎动脉,使其形成永久性闭塞;然后于颈部作一切口,钝性分离腺体及皮下组织,暴露双侧颈动脉,准备好丝线,消毒缝合。待自然苏醒24 h后,提起外置丝线分离的颈总动脉,采用动脉夹夹闭双侧颈动脉,形成4动脉闭塞的全脑缺血模型。夹闭10 min后,松开动脉夹再灌注24 h。Dex组夹闭双侧颈总动脉前30 min腹腔注射50 μg/kg的 Dex,S组和I/R组给予等量生理盐水。缺血再灌注24 h后,处死再断头取脑,冰下剥离脑组织,进行相关生化指标测定。
1.3 各组脑组织病理观察 断头取脑,冰下剥离脑组织,每组部分脑组织(n=4)固定于4%多聚甲醛中,石蜡包埋常规切片(厚度4 μm)。然后,进行常规病理HE(苏木素及伊红)染色,光学显微镜下观察脑组织海马区病理改变。
1.4 各组脑组织SOD、CAT、MDA的测定 称取各组大鼠(n=8)脑组织,采用生理盐水进行组织匀浆,制备10%的脑组织匀浆液。根据试剂盒说明书操作步骤测定脑组织SOD、CAT、MDA。
1.5 各组脑组织Nrf2和HO-1蛋白的测定 采用Western blotting法测定。冰下解剖脑组织后,采用含1%苯甲磺酰氟(PMSF)的裂解液裂解脑组织,提取总蛋白。4 ℃下12 000×g离心15 min后取上清;然后采用BCA试剂盒(武汉安特捷)测定脑组织总蛋白含量。加入适量裂解液将各组蛋白调至相同浓度,最后加入5×上样缓冲液,沸水浴煮10 min变性,冰箱20 ℃冻存。取20 μL样品上样,SDS-PAGE凝胶电泳分离蛋白,然后湿转法转膜2.5 h,转膜成功后5%脱脂奶粉封闭1 h。根据Marker条带剪下PVDF膜上不同目的条带,分别加兔抗大鼠的β-actin、Nrf2和HO-1一抗,并置于4 ℃冰箱孵育过夜,次日摇床振荡下采用TBST洗涤多次(15 min×3次)。洗涤后孵育二抗:加入 1∶3 000 的二抗室温孵育1 h。同样采用TBST洗涤后ECL 法曝光显影,观察Nrf2和HO-1蛋白的表达,结果以灰度值表示。
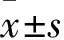
2 结果
2.1 各组大鼠大脑海马组织病理变化 各组大鼠海马HE染色结果如图1所示,Dex组缺血损伤较I/R组明显减轻,细胞形态规则,排列较为整齐;I/R组则呈现缺血坏死,组织排列紊乱、细胞破碎,典型的缺血损伤; S组大鼠皮质层细胞排列整齐规则,无缺失。

图1 各组大脑海马组织结构(HE染色)
2.2 各组大鼠脑组织SOD、CAT活性及MDA含量比较 与S组比较,I/R组SOD和CAT活力明显下降,MDA含量升高(P均<0.05)。Dex组脑组织SOD、CAT活性较I/R组增加,MDA含量降低(P均<0.05),详见表1。

表1 各组大鼠脑组织SOD、CAT活性及MDA含量
2.3 各组大鼠脑组织细胞核内Nrf2、HO-1蛋白表达水平比较 Dex组、I/R组、S组大鼠脑组织细胞核内Nrf2分别为0.91±0.06、0.81±0.05、0.41±0.08,HO-1分别为1.18±0.05、0.91±0.04、0.31±0.09。各组之间各指标两两比较,P均<0.05。各组大鼠脑组织细胞核内Nrf2、HO-1蛋白电泳图见图2。
3 讨论
正常生理状态下,机体内氧化和抗氧化处于一种动态平衡。大脑作为人体的重要器官,在病理状态下如脑缺血再灌注损伤过程中,氧化和抗氧化失衡,一系列氧化应激反应被激活,进而产生大量的超氧阴离子、氢氧根离子等氧自由基,可与脑细胞表面的不饱和脂肪酸结合发生脂质过氧化反应,代谢生成有害物质,损害脑组织,加重脑缺血损伤[8]。SOD和CAT作为生理平衡中不可或缺的抗氧化酶,能清除氧自由基,减少脂质过氧化物等对脑组织的毒性损伤[9]。Dex是临床上应用非常广泛的麻醉药物,是α2肾上腺素受体激动剂,在大脑、肾脏、心脏等脏器缺血再灌注中通过抗氧化发挥一定的保护作用[10~12],然而具体的作用机制仍不清楚。

图2 各组大鼠脑组织细胞核内Nrf2、HO-1蛋白表达电泳图
心脑血管疾病多发于老年群体,因此本研究探讨了老年大鼠全脑缺血再灌注模型中,Dex抗氧化保护脑组织可能的具体作用机制。结果发现,I/R组大鼠脑组织中SOD和CAT活性较S组下降,而MDA含量明显增加,提示大量氧自由基侵袭细胞,生成的脂质过氧化物损害脑组织导致细胞破裂、凋亡。Dex可以抑制机体的氧化应激反应,使大脑中SOD和CAT活性上升,清除氧自由基,有害物质MDA生成进而减少[13,14],给予Dex干预后,脑组织缺血损伤较I/R组明显减轻,提示Dex通过提高SOD和CAT活性,从而减少了MDA对大鼠脑组织损伤。
有研究[15]表明,Nrf2是细胞发生氧化应激的感受器,是介导抗氧化应激反应的重要转录因子, 在氧化和抗氧化过程中发挥了一定的防御作用。Nrf2可与肌动蛋白结合蛋白Keapl结合,使HO-1表达上调,激活Keapl/Nrf2/HO-1通路,诱导抗氧化酶SOD、CAT等活性增加,清除氧自由基等有害物质,维持机体氧化还原调节的平衡,发挥细胞保护作用。静息状态下,Nrf2与Keapl结合形成Keapl-Nrf2二聚体位于细胞质中,当受到来自ROS或外界氧化应激信号刺激时,Nrf2 磷酸化转入细胞核,进而启动下游HO-1和SOD、CAT基因的表达,发挥抗氧化作用。全脑缺血再灌注损伤导致脑组织中超氧阴离子、氢氧根离子等大量释放,氧化应激反应被激活。本研究结果显示,与S组比较,I/R组细胞核内Nrf2和HO-1水平明显增加,表明机体存在自身免疫调节,可抵御氧化应激损伤;Dex组Nrf2表达较I/R组显著上调,其信号通路下游的HO-1表达也明显增多,提示Dex可以促进细胞核内Nrf2/HO-1的表达上调,增加 SOD、CAT 活性,降低MDA 含量,减少氧化应激对脑细胞的损伤和凋亡。
综上所述,Dex对老龄大鼠全脑缺血再灌注损伤有一定的预防作用,其作用机制可能是上调Nrf2、HO-1蛋白的表达而抑制氧化应激反应。本研究仅进行了Dex对老龄大鼠全脑缺血再灌注损伤预防作用分子机制方面的探讨,后续将在细胞水平进一步分析Dex的作用机制。
