CRH调节妊娠期慢性应激致子代雄性大鼠抑郁
2020-06-12吕逸丽姚余有
陈 鹏,况 亮,吕逸丽,张 阔,姚余有,2
抑郁症是一种慢性精神疾病,特点是思维缓慢、反复发作,严重者甚至危及生命。研究[1]发现,抑郁症患者海马、大脑皮层、杏仁核等部位发生明显异常。抑郁和焦虑可能与下丘脑分泌过多的促肾上腺皮质激素释放激素(corticotrophin-releasing hormone,CRH)有关[2-4]。课题组以往的实验[5]结果显示,妊娠期慢性应激可引发子代雄鼠抑郁,但目前尚不清楚是否由CRH分泌增多引起。CRH和CRH受体1(CRH receptor 1, CRHR1)广泛分布于全脑,参与并影响海马、大脑皮层、杏仁核等部位众多生理功能[6-7]。因此,现使用慢性不可预测的轻度应激(chronic unpredictable mild stress, CUMS)方式作用于妊娠期大鼠,通过向其子代雄鼠侧脑室微量注射CRHR1拮抗剂(NBI30775),观察子代雄鼠行为学和组织病理学改变,并利用体外培养实验来研究子代雄鼠抑郁的机制。
1 材料与方法
1.1 试剂与仪器CRHR1拮抗剂NBI30775(英国Tocris Bioscience公司);anti-mTOR、anti-p-mTOR(Ser2448)(美国Cell Signaling Technology公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);酶联免疫试剂盒(ELISA)(上海江莱生物有限公司);MEM(美国Hyclone公司);马血清(美国Gibico公司);插入式微孔滤膜(美国Millipore公司);强迫游泳实验分析系统(上海欣软信息科技有限公司);大鼠脑立体定位仪、微量注射器和微量给药套管(深圳瑞沃德生命科技有限公司);Western blot 相关仪器(北京六一厂);ELX全自动酶标仪(美国BD公司);CO2恒温培养箱(美国Thermo公司)。
1.2 动物与分组8周龄SPF级Sprague Dawley大鼠,雌鼠30只,雄鼠15只,由安徽医科大学实验动物中心提供。动物饲养方法:室温(24±1) ℃,相对湿度50%,正常提供食物和水,饲养7 d以适应周围环境。7 d后,按照雌雄比例2 ∶ 1在20 ∶ 00点合笼,次日早上07 ∶ 00点查阴。标记、称重查到阴栓的母鼠,单笼饲养并记录为受孕第1天。为研究不同妊娠期应激时间对子代大鼠行为学的影响,将妊娠期母鼠分为妊娠期正常对照组(CON组)、妊娠中期(7~14 d)处理组(MIDDLE组)、妊娠晚期(15~21 d)处理组(LATE组)和妊娠中晚期(7~21 d)处理组(MID-LATE组)。随机取出同一组孕鼠孕育的子代雄鼠,于出生后30 d做行为学实验,选取最强致子代抑郁的应激方式。在上述基础上重新应激孕鼠(应激时间为7~21 d)。待子鼠出生后,按妊娠期应激与不应激将子代雄鼠分成以下4组:妊娠期正常对照+子代对照组(CON组)、妊娠期正常对照+子代侧脑室注射 CRHR1 拮抗剂组(CON+ANT组)、妊娠期慢性应激+子代侧脑室注射 CRHR1拮抗剂组(CUMS+ANT组)、妊娠期慢性应激+子代对照组(CUMS组)。
1.3 慢性应激方法慢性应激组:正常喂养1周后,受孕第8天起开始慢性不可预知性轻度刺激:夹尾巴(离尾尖5 cm处,5 min)、禁水(24 h)、冰水游泳(水温4 ℃,15 min)、改变居住环境(让鼠在潮湿的垫料上生活24 h)、昼夜颠倒、禁食(24 h)、摇床振荡等,每天随机施加1种刺激方式(禁水、禁食除外),直到大鼠分娩。
1.4 给药方式产后10 d,用4%的水合氯醛腹腔注射麻醉子鼠,并利用脑立体定位仪定位侧脑室(以前囟为原点,AP-0.7 mm、L2.0 mm、V3.3 mm),将不锈钢导管插入侧脑室,用牙托粉和牙托水将其固定。手术后皮下注射抗生素(0.1×104U/只,每天1次),持续注射3 d防止子鼠感染。NBI30775给药剂量为2.5 mg/(kg·d),给药周期为10~30 d。
1.5 抑郁模型大鼠行为学评价
1.5.1强迫游泳实验(forced swimming test,FST) 试验第1天进行预实验,将大鼠置于直径20 cm玻璃桶中游泳15 min[水深30 cm,水温(24±1) ℃]。第2天,将大鼠置于桶中游泳6 min,拍摄大鼠在桶中的运动情况,统计后4 min不动时间总和。
1.5.2糖水偏好实验(sucrose preference test,SPT) 试验第1天进行预实验,在每个笼子两侧放2瓶1%蔗糖水(50 ml的透明玻璃瓶)。第2天禁食禁水。第3天,每个笼子一侧放1瓶1%蔗糖水,另外一侧放1瓶纯净水。称重并记录1%蔗糖水和纯净水消耗量。实验结束后,分析得到得数据并且计算糖水偏好值 =(糖水前后重量差值/总液体前后重量差值)×100%。
1.6HE染色观察海马形态学改变行为学实验全部结束后,取出全脑,4%多聚甲醛固定脑组织。24 h后进行脱水、包埋,做冠状切片,染色。在显微镜(200倍)下拍摄海马 CA3 区神经细胞,保存图片。用 Image-Pro Plus软件的计数功能标记出神经元的数目并求出平均值。
1.7 ELISA法检测海马组织中CRH含量实验时称取一定量的海马组织,按照酶联免疫试剂盒(ELISA)使用书的说明进行操作,测定海马组织CRH的含量,海马组织CRH的浓度单位用CRH/总蛋白(pg/mg)表示。
1.8 Western blot法检测海马组织哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和p-mTOR(Ser2448)蛋白含量称量40 mg的海马组织,加入 PBS轻摇洗涤,匀浆,4 ℃离心后分离上清液,重复1次。灌制8%的胶,电泳(60 V/90 min,120 V/180 min),转膜(250 mA/250 min),纯水洗膜3次后封闭1.5 h,孵育一抗(4 ℃过夜)。TBST洗膜4次后孵育二抗。加适量显色液显影并拍照,保存照片分析结果。抗体浓度β-actin鼠抗(1 ∶ 2 000)、mTOR兔抗(1 ∶ 2 000)、p-mTOR兔抗(1 ∶ 2 000)、二抗羊抗兔(1 ∶ 5 000)。
1.9 Western blot法检测体外培养海马脑片中mTOR蛋白含量取10 d的SD大鼠大脑,制作冠状切片(180 μm),切下的脑片置于4 ℃的HBSS中,最后将切片放置在装有培养基的Millicell-CM微孔膜上。培养基组成成分为50% MEM、25%马血清、24% HBSS溶液、1%的100 UL/ml青链霉素双抗、6.5 mg/ml葡萄糖,pH 7.25。放入37 ℃、5% CO2培养箱培养,24 h内换液,随后1周内每隔1 d更换1次培养基,以提供海马脑片充足的营养和适宜的生长环境。1周以后,将实验分为1.0×10-6mol/L CRH+0.1×10-6mol/L CRHR1 拮抗剂组(Low组)、1.0×10-6mol/L CRH+1.0×10-6mol/L CRHR1拮抗剂组(Middle组)、1.0×10-6mol/L CRH+10×10-6mol/L CRHR1拮抗剂组(High组)、1.0×10-6mol/L CRH+溶剂对照组(CRH组)和正常对照组(Control 组)。其中CRHR1拮抗剂终浓度设定为(0.1~10)×10-6mol/L,CRH浓度为1.0×10-6mol/L。
1.10 统计学处理SPSS 23.0统计软件分析实验所得数据,用单因素方差分析(ANOVA)比较多组间均数差异,用最小显著差异法(least significant difference,LSD)作两两比较。P<0.05表示差异有统计学意义。
2 结果
2.1 妊娠期不同应激阶段对子代雄鼠的影响如表1所示,与CON组相比,MIDDLE、LATE和MID-LATE组的大鼠糖水偏好率均下降(P<0.05),强迫游泳不动时间均增长(P<0.05);与MIDDLE组和LATE组相比,MID-LATE组大鼠强迫游泳不动时间更长(P<0.05),糖水偏好率下降(P<0.05)。
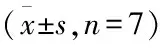
表1 各组子代大鼠行为学实验结果
与CON组比较:*P<0.05;与MIDDLE组、LATE组比较:#P<0.05
2.2 CRHR1拮抗剂对子代雄鼠行为学影响如表2所示,与CON组相比,CUMS组大鼠糖水偏好率下降(P<0.05),强迫游泳不动时间增长(P<0.05);与CUMS组相比,CUMS+ANT组大鼠糖水偏好率上升(P<0.05),强迫游泳不动时间减少(P<0.05);与CON组相比,CON+ANT组大鼠糖水偏好率和强迫游泳不动时间无明显变化。
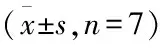
表2 各组子代大鼠行为学实验结果
与CON组比较:*P<0.05;与CUMS组比较:#P<0.05
2.3 CRHR1拮抗剂对子代雄鼠海马病理学影响HE染色结果显示,CON组与CON+ANT组海马CA3区神经细胞数量较多,细胞排列紧密,核仁界限清晰、明显。CUMS组海马CA3区神经细胞数量较少,细胞排列疏松,发生核固缩的细胞较多。用Image-Pro Plus分析软件的计数功能标记海马CA3区神经细胞数量,分析结果显示,与CON组(121.01±9.64)相比,CUMS组(83.00±5.24)神经元总数减少(P<0.05);与CUMS组(83.00±5.24)相比,CUMS+ANT组(101.25±5.91)神经元总数增加(P<0.05);而CON组与CON+ANT组(125.67±7.51)相比神经元总数无明显区别。见图1。
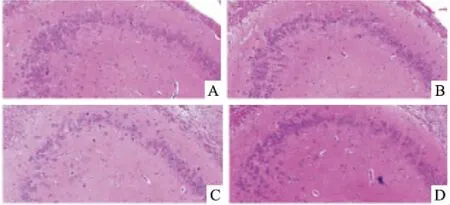
图1 各组子代雄鼠海马CA3区HE染色图 ×200
A:CON组;B:CON+ANT组;C:CUMS组;D:CUMS+ANT组
2.4 CRHR1拮抗剂对子代雄鼠海马组织中CRH水平影响ELISA检测结果显示,与CON组大鼠相比,CUMS组大鼠海马组织中CRH水平升高(P<0.05);与CUMS组相比,CUMS+ANT组大鼠海马组织中CRH水平降低(P<0.05)。见图2。

图2 各组子代大鼠海马组织CRH水平影响(n=3)
与CON组比较:*P<0.05;与CUMS组比较:#P<0.05
2.5 CRHR1拮抗剂对子代海马mTOR、p-mTOR蛋白表达影响采用Western blot法检测mTOR和p-mTOR蛋白水平。图3显示,与CON组相比,CUMS组大鼠海马组织中mTOR表达量下降(P<0.05);与CUMS组相比,CUMS+ANT组大鼠海马组织中mTOR表达量上升。图4显示,与CON组相比,CUMS组大鼠海马组织中p-mTOR水平下降(P<0.05);与CUMS组相比,CUMS+ANT组大鼠海马组织中p-mTOR表达量上升。CON组和CON+ANT组大鼠海马组织中mTOR和p-mTOR表达量均无统计学差异。
2.6 CRHR1拮抗剂对体外培养海马脑片中mTOR蛋白水平影响采用Western blot法检测体外培养的海马脑片mTOR蛋白水平,结果显示,与对照组相比,CRH组大鼠海马脑片mTOR表达量下降(P<0.05);与CRH组相比,低、中和高剂量CRHR1拮抗剂组大鼠海马脑片mTOR表达量增加(P<0.05);但低、中和高剂量CRHR1拮抗剂组与对照组相比,大鼠海马脑片mTOR表达量差异无统计学意义,且低、中和高剂量CRHR1拮抗剂组3组之间组内比较大鼠海马脑片mTOR表达量差异无统计学意义。见图5。

图3 CRHR1拮抗剂对海马组织中mTOR蛋白表达的影响(n=3)
与CON组比较:*P<0.05;与CUMS组比较:#P<0.05
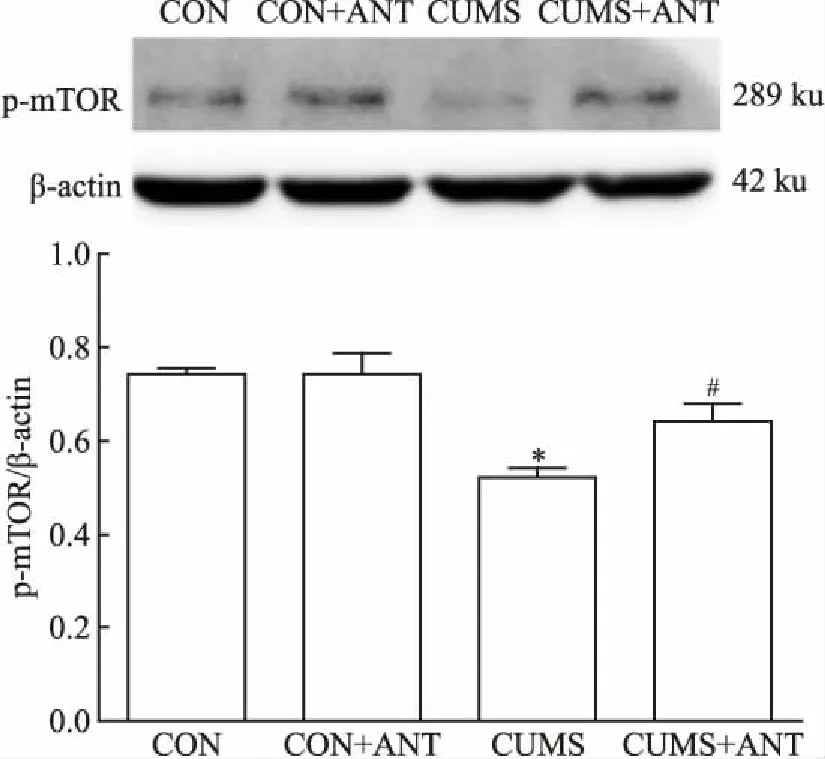
图4 CRHR1拮抗剂对海马组织中p-mTOR蛋白表达的影响(n=3)
与CON组比较:*P<0.05;与CUMS组比较:#P<0.05
3 讨论
不同妊娠时期应激会对子代雄鼠的行为产生不同的影响。本实验结果显示, 与CON组相比,MID-DLE、LATE和MID-LATE组的大鼠糖水偏好率下降、强迫游泳不动时间增长,且MID-LATE组比MIDDLE和LATE组强迫游泳不动时间更长,糖水偏好率提高,提示MID-LATE妊娠期应激组子代雄性大鼠抑郁程度最严重。
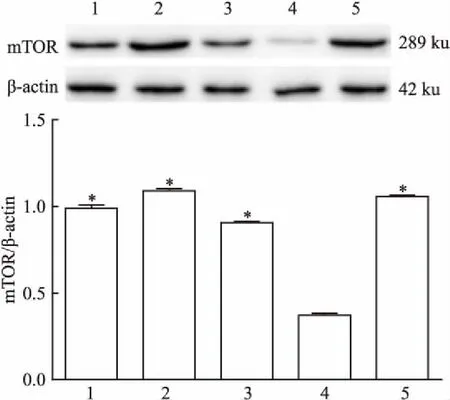
图5 CRHR1拮抗剂对体外培养海马脑片中mTOR蛋白表达的影响(n=3)
1:低剂量CRHR1拮抗剂组;2:中剂量CRHR1拮抗剂组;3:高剂量CRHR1拮抗剂组;4:CRH组;5:对照组;与CRH组比较:*P<0.05
CRH和CRHR1在全脑分布广泛,故本实验通过向妊娠期慢性应激子鼠侧脑室微量注射CRHR1拮抗剂,并结合体外培养海马脑片更有利于探讨妊娠期慢性应激诱导子代雄性大鼠抑郁的机制。实验结果显示,与CON组相比,CUMS组大鼠糖水偏好率下降,强迫游泳不动时间增长,说明妊娠期慢性应激致子代出现抑郁样症状。与CUMS组相比,CUMS+ANT组大鼠糖水偏好率上升,强迫游泳不动时间减少,提示CRH参与了妊娠期慢性应激致子代抑郁。HE染色和海马组织CRH浓度检测结果显示,与CON相比,CUMS组的子代雄鼠海马CA3区神经细胞损伤,海马组织CRH浓度升高,而加入CRHR1拮抗剂后,CUMS+ANT组子代雄鼠海马病理损伤改善,提示妊娠期慢性应激通过提高子代海马组织中CRH水平,导致海马CA3区损伤,从而引起抑郁样症状。本研究结果还显示,CRHR1拮抗剂可下调CUMS引起的升高的CRH,其机制不详,还有待于进一步研究。
mTOR是一种丝氨酸/苏氨酸激酶,参与调控蛋白质翻译、细胞增殖与死亡等生理过程[8]。研究[9-10]发现,激活mTOR通路,可通过上调多种相关蛋白的磷酸化水平,提高神经元的可塑性,产生抗抑郁效果。本研究结果显示,CUMS组大鼠海马组织中mTOR和p-mTOR蛋白的表达低于CON组,但侧脑室注射CRHR1拮抗剂后mTOR和p-mTOR蛋白表达升高,提示CRHR1拮抗剂可上调妊娠期慢性应激导致的子鼠mTOR和p-mTOR的蛋白水平的降低。此外体外培养海马脑片结果显示,CRH、低、中和高剂量CRHR1拮抗剂组大鼠海马脑片mTOR蛋白表达量增加,且中剂量组的mTOR蛋白表达水平接近正常水平,进一步说明CRHR1拮抗剂可以上调mTOR蛋白表达水平,提示妊娠期慢性应激通过下调子鼠海马mTOR蛋白水平致海马神经细胞损伤,最终引起抑郁。遗憾的是,本课题组尚未掌握体外观察海马脑片病理形态的技术,无法在观察mTOR蛋白的同时观察海马脑片的病理改变。此外本研究也未能成功检查海马神经元凋亡状况,也是本文不足之处。
综上所述,妊娠期慢性应激可导致子代出现抑郁样行为,其作用机制可能是妊娠期慢性应激诱导子代海马组织CRH水平升高,通过抑制mTOR通路的激活,导致海马CA3区神经细胞损伤,进而使子代抑郁。
