抗Pg-IgY脂质体的制备及理化性质的测定
2020-06-12徐涵颖王腾飞沈继龙桂双英
徐涵颖,徐 燕,王腾飞,韩 旭,程 婷,沈继龙, 桂双英
牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)是引起牙周病的主要病原体之一。机械治疗牙周炎存在局限性,而临床上经常使用的辅助治疗药物如抗生素、西吡氯铵等可能会引起细菌耐药性的产生,味觉改变和色素沉着等问题[1]。近年来采用免疫学方法如卵黄抗体(immunoglobulin of yolk,IgY)来控制感染为解决这一难题提供新的思路和方法[2]。现采用薄膜分散法制备抗Pg-IgY脂质体,测定其包封率、体外释放率、粒径、Zeta电位并进行质量评价,以期达到缓慢释药,提高药效的作用[3]。
1 材料与方法
1.1 试剂与器材特异性抗牙龈卟啉单胞菌卵黄抗体溶液(合肥安科生物有限公司);卵磷脂(德国利保德公司);胆固醇(生物试剂纯,加拿大BBI公司);三氯甲烷、生育酚等试剂(天津博迪化工技术有限公司);透析袋(上海原野生物科技有限公司)。动态光散射粒度分布仪(美国布鲁克海文仪器公司);恒温磁力搅拌仪(常州智博瑞仪器有限公司);N-1001型旋转蒸发仪(日本EYELA公司);涡流振荡器(常州神光仪器有限公司);Mettler AE240电子天平(上海右一仪器有限公司);酶联免疫检测仪(山东博科生物有限公司)。
1.2 实验方法
1.2.1抗Pg-IgY蛋白检测方法的建立
1.2.1.1标准曲线的绘制 本实验采用BCA法进行标准曲线绘制。取20 μl蛋白标准品(25 g/L BSA溶液),加入980 μl蛋白稀释液,配置成0.5 g/L,分别在96孔板中加入0、1、2、4、8、12、16、20 μl上述溶液,再分别加入标准品稀释液至20 μl。向每个孔中加入200 μl BCA工作溶液,并在37 ℃反应30 min~1 h左右,测量562 nm处吸光度(optical density,OD)值。 以浓度C(g/L)对OD值进行线性回归。求出标准曲线Y=0.742X-0.109,R2=0.999。
1.2.1.2回收率和精密度测定 配制低、中、高浓度的抗Pg-IgY溶液,分别稀释至为0.03、0.02、0.015 g/L。根据1.2.1.1项下操作,分别在OD值为562 nm处测量上述3种溶液的OD,并通过重复测量3次来计算回收率。取浓度为7.2 g/L的抗Pg-IgY溶液,准确地将1 ml上述溶液转移到试管1~6中。根据1.2.1.1项下的操作重复测量6组样品的OD,并计算其精密度。
1.2.2抗Pg-IgY脂质体的制备方法 为了提高脂质体制备的成功率,本实验采用薄膜分散法制备脂质体,并称取60 mg干燥的卵磷脂,将9 mg胆固醇和0.1 mg亲脂性抗氧化剂生育酚置于圆底烧瓶并溶于5 ml氯仿中。超声震荡使其充分水化,旋转蒸发(400~700 kPa)干燥磷脂,温度设置为30 ℃,同时30 ℃水浴环境预热抗Pg-IgY溶液,30 min后,用5 ml抗Pg-IgY溶液将脂质膜水合,使用振荡并涡旋的方式搅拌混悬液数分钟至数十分钟不等,得到抗 Pg-IgY脂质体溶液。
1.2.3Zeta电位和脂质体粒径的测定 用超纯水将1 ml抗Pg-IgY脂质体溶液稀释10倍,并通过动态光散射粒度分布分析仪测量粒度分布,以25 ℃的温度测量。将待测抗Pg-IgY脂质体溶液加入到样品杯中,将钯电极插入溶液中,并通过Zeta电位分析仪测量脂质体的表面电荷性质。每个样品重复测量3次并取平均值,并将温度设定为25 ℃。
1.2.4通过透析法测定包封率
1.2.4.1透析袋的处理 将透析袋剪成6~8 mm,放入2% NaHCO3(W/V)和1 mmol/L EDTA(pH 8.0)中将透析袋煮沸10 min。用超纯水洗涤透析袋后,将其在1 mmol/L EDTA(pH 8.0)中煮沸数十分钟。冷却后存放于50%乙醇中4 ℃储存备用[4]。
1.2.4.2透析时间的确定 取2 ml抗Pg-IgY脂质体溶液置于透析袋内(孔径1 000 ku),将透析袋放入由200 ml生理盐水作为透析液的烧杯内,将恒温磁力搅拌器的温度设置为10 ℃,分别在2、4、6、8、12、20、24 h取透析液1 ml并补充等体积的生理盐水,BCA法测定透析液中蛋白浓度。
1.2.4.3包封率的测定 包封率(encapculation efficiency,EE)的计算公式: EE(%)=(W总-W游)/W总。其中W总为总药量;W游为未包封的游离药量。
1.2.5体外释放实验[5]取制备所得抗Pg-IgY脂质体溶液,精确地将2 ml脂质体溶液转移到透析袋中。将末端固定并置于含有200 ml 0.9%生理盐水的烧杯中。37 ℃恒温水浴条件下进行磁力搅拌,于0.5、1、2、8、12、24、36、48、72、84、96、108 h分别从烧杯中取1 ml样品并同时补充等体积透析介质,用BCA法测出每个取样时间点透析介质中的蛋白含量,以0 h时透析袋内的蛋白含量作为总含量,二者之比即为累积释放率。
1.2.6抗Pg-IgY脂质体的质量评价[6]用2%磷钨酸负染脂质体后置于透射电子显微镜下观察。

2 结果
2.1 回收率实验和精密度实验结果根据1.2.1.2项所述方法进行操作测定回收率和精密度,回收率R=测量浓度/实际浓度×100%,结果如表1所示。3组的平均回收率分别为1.045、1.00和1.02。精密度计算公式如下:
相对标准偏差(RSD)=标准偏差/平均值×100%,结果如表2所示为1.29%。BCA蛋白质测定的原理是在碱性条件下蛋白质可以将二价铜离子还原为单价铜离子。单价铜离子与独特的BCA溶液A(含有BCA)的相互作用产生敏感的颜色响应。2个BCA分子螯合铜离子形成紫色反应复合物。水溶性复合物在562 nm处显示出强吸光性,并且OD和蛋白质浓度在很宽的范围内具有良好的线性关系。因此根据OD可以推算出待测物的蛋白浓度。精密度常用RSD值表示,当该值小于5%时,该组样品之间彼此符合的程度越高。根据本文回收率和精密度实验所得结果计算出的RSD值为1.29%,均小于2%,说明用BCA蛋白浓度测定法测定抗Pg-IgY蛋白浓度试验精密度和回收率均较高,符合方法学要求。

表1 回收率实验(n=9)

表2 精密度试验(n=6)
2.2 抗Pg-IgY脂质体Zeta电位和粒径的测定取3个样品测定Zeta电位和粒径,其平均粒径为(82.48±2.3) nm,多分散指数为0.313±0.01。Zeta电位为(-38.55±0.16) mV,Zeta电位绝对值大于25 mV,多分散指数为0.3左右,表明该系统相对稳定并且粒子不易沉降。
2.3 抗Pg-IgY脂质体包封率的测定本实验选择的透析时间是24 h,在此时游离药物基本释放,透析袋内外的浓度差距随着药物释放越来越小,透析介质内的蛋白浓度已恒定不变,由公式可测得EE为40%(n=3)。如图1。
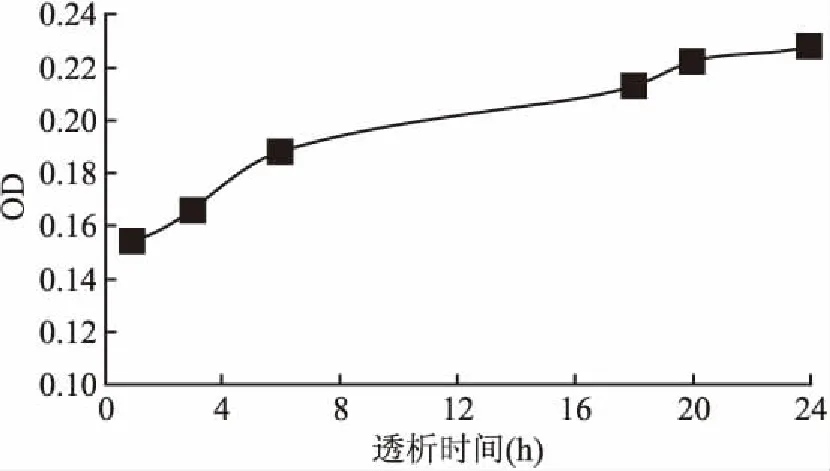
图1 抗Pg-IgY脂质体透析曲线
2.4 抗Pg-IgY脂质体的体外释放行为从图2可以看出,抗Pg-IgY脂质体具有显著的持续释放效果,并且4 h内的累积药物释放速率是20%左右,表明该药物不产生爆发释放。生理盐水中的蛋白质浓度在0.5~24 h显著增加,未释放的游离蛋白质主要在12 h释放。在12~24 h这一阶段,生理盐水中的游离蛋白质的比例增加到约50%,这部分蛋白质来源于抗Pg-IgY脂质体。48 h以后,药物释放趋向平稳,累积释放率由70.5%上升至79.9%,并且可以从趋势中看出108 h后仍然持续释放,说明药物被包封在脂质体内部,通过脂质体的破裂从而达到缓释发挥药效的作用。
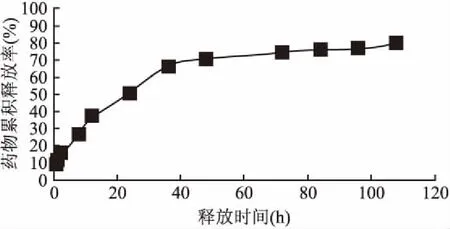
图2 抗Pg-IgY脂质体体外释放率曲线
2.5 抗Pg-IgY脂质体的质量评价通过透射电镜观察抗 Pg-IgY 脂质体,脂质体粒径分布较均一 ,形状呈卵圆形,其层状结构明显,外表光滑,囊泡完整。释放药物后的脂质体在镜下可见囊泡破裂,有磷脂碎片分布在周围,并且此时脂质体已经萎缩变形。如图3。

图3 透射电镜下抗Pg-IgY脂质体形态
A:脂质体分布粒径均一×40 K;B、C:脂质体呈卵圆形,层状结构明显,囊泡完整×60 K;D:释药后的脂质体,囊泡破裂,磷脂碎片分布在周围,脂质体已萎缩变形×30 K
3 讨论
抗Pg-IgY可靶向杀灭牙周病原微生物,在弥补机械治疗不足的同时还有效避免抗生素等过度使用。尽管抗Pg-IgY临床疗效良好,但在口腔环境中易被生物酶降解,无法长期维护牙周健康。脂质体是一种微球系统,由亲油和亲水分子构成双层结构并将药物包封在其中,使其免受生物酶破坏,延长药物在牙周袋内的作用时间。因此抗Pg-IgY脂质体对于牙周病治疗具有重要意义。
卵黄抗体是一种亲水性免疫蛋白,考虑到大量制备的需要,本实验采用薄膜分散法制备抗Pg-IgY脂质体。由此制备出的脂质体多数为大多室脂质体,大多室脂质体是多层结构,主要由小囊泡聚集形成[7]。抗Pg-IgY脂质体即是包裹抗Pg-IgY的双分子层小囊泡,通过囊泡的破裂释放出抗Pg-IgY并发挥其药效。
测定脂质体包封率的方法包括超速冷冻离心法、葡聚糖凝胶层析法、透析法、鱼精蛋白凝聚法、微柱离心法等[8]。IgY的相对分子量约为180 ku。游离IgY可以通过透析袋,而脂质体由具有大分子量的磷脂双层组成,难以通过透析袋。因此本实验选用透析法测定脂质体包封率简便易行且非常经济。2015年版中国药典对脂质体的包封率有明确规定。如果包封率过低,则失去了制备脂质体的意义。本实验制备出的脂质体包封率较高(40%),能够满足进一步的实验要求。
脂质体的Zeta电位及其粒径也是评价脂质体性质的基本参数,较小的脂质体在生物方面的主要优势在于被清除较慢。已有学者[9]证明即使脂质体是空间稳定的,较小的粒径(70~200 nm)和均匀的粒度分布也有利于延长其循环时间。脂质体颗粒的表面电荷是确保颗粒分散体系稳定性的重要因素,其高低可直接反映粒子带电多少,间接反映粒子之间排斥力的强弱。Zeta电位的绝对值越高,颗粒之间的静电排斥越大,物理稳定性越好。通常,Zeta电位的绝对值高于25 mV,那么该系统被认为是相对稳定的。本实验中制备的脂质体的Zeta电位的绝对值大于38 mV,表明脂质体颗粒之间的静电排斥大并且系统相对稳定。同时该实验制备出的脂质体平均粒径为82.48 nm,有利于药物的缓释。
抗Pg-IgY脂质体在体外释放期间表现出两个释放阶段[10]。在0~4 h内快速释放,约占总药物释放量的25%。这是未包封在脂质体中的游离药物的释放,并且脂质体的包封效率为40%,证明存在60%的游离药物;在4~48 h显示药物缓慢释放,因为脂质体内层中的药物必须穿过双分子层才得以进入0.9%生理盐水。
总之,本实验制备的抗Pg-IgY脂质体的粒径、Zeta电位、PDI指数、包封率和体外释放度均符合要求,为进行下一步研究奠定良好基础。
