Rac1和Cdc42对横纹肌肉瘤细胞增殖、侵袭、迁移以及凋亡的影响
2020-06-12刘春霞
商 浩,王 萍,2*,刘春霞,李 锋,3
关键字 横纹肌肉瘤;Rac1;Cdc42
横纹肌肉瘤(rhabdomyosarcoma, RMS)是儿童常见的软组织肉瘤之一,约占所有小儿恶性肿瘤的4.5%,好发于头部和颈部[1]。尽管肿瘤切除、放射疗法和化疗方案等综合治疗在RMS中广泛应用,儿童患者5年生存率有所提高,但高危患儿的存活率仍然较低[2]。因此,探究参与RMS发病的基因,明确其在RMS中所发挥的作用,将为RMS的诊断以及治疗提供新思路。
Rac1、Cdc42属于小G蛋白超家族成员,参与多种细胞信号传导,在维持细胞正常功能中起重要作用。近些年研究[3-5]显示,Rac1、Cdc42在卵巢癌、胃癌、嗜铬细胞瘤等肿瘤中异常表达,参与肿瘤的发生发展。但是,尚未见Rac1、Cdc42在RMS中的报道。该研究通过检测Rac1、Cdc42在RMS细胞中的表达,并分析其对RMS细胞生物学特性的影响,为RMS的分子诊断和靶向治疗提供理论基础。
1 材料与方法
1.1 材料
1.1.1主要试剂 胚胎性RMS RD细胞系购自中国科学院细胞库;腺泡状RMS RH30细胞系购自上海复翔生物技术有限公司;正常骨骼肌HSKMC细胞系购自北纳生物技术有限公司;Rac1和Cdc42过表达质粒以及空载质粒(empty vector,EV)购自上海吉凯基因化学技术有限公司;Lipofectamine 2000购自美国Life technologies公司;Total RNA Kit I购自美国OMEGA公司;miScript Ⅱ RTKit和miScript SYBR Green PCR Kit购自德国Qiagen公司;anti- Rac1、anti- Cdc42和anti-β-actin购自美国Cytoskeleton,Inc公司;CCK-8试剂购自日本Dojindo公司;transwell小室购自美国Costar公司;Matrigel购自美国BD Biosciences公司;Annexin V-APC/PI Apoptosis Detection Kit购自江苏凯基生物技术股份有限公司。
1.1.2主要仪器 倒置显微镜购自日本OLYMPUS公司;7500实时PCR系统购自美国Applied Biosystems公司;电泳仪、转膜仪、凝胶成像系统和全自动酶标仪购自美国BIO-RAD公司;PAS型流式细胞仪购自德国PARTEC公司。
1.2 方法
1.2.1细胞培养 3株细胞系均使用含10%胎牛血清(FBS)和1%双抗(青-链霉素)的DMEM培养基,置于37 ℃、5% CO2条件下培养。
1.2.2细胞转染 将RD和RH30细胞消化、重悬,以4×105细胞/孔接种于含有2 ml 10% FBS-DMEM培养基的6孔细胞培养板中,待细胞密度达到60%~70%时,按照Lipofectamine 2000说明书进行转染。
1.2.3实时荧光定量多聚核苷酸链式反应(quantitative real-time polymerase chain reaction, qRT-PCR) 使用Total RNA Kit Ⅰ从细胞中提取总RNA。使用miScript Ⅱ RTKit将总RNA反转录成cDNA。使用miScript SYBR Green PCR Kit在7500实时PCR系统中进行扩增。Rac1和Cdc42为目的基因,β-Actin为内参基因。实验组和对照组表达差异以RQ值为准,表示实验组中目的基因相对于对照组表达的差异倍数。引物序列见表1。

表1 引物序列
1.2.4Western blot 裂解细胞,提取蛋白。配置10% SDS-PAGE胶,每孔蛋白上样15 μl,电泳分离,切取目的蛋白条带电转至PVDF膜上,5% BSA封闭2 h,一抗( anti-Rac1,1 ∶ 1 000;anti-Cdc42,1 ∶ 1 000;anti-β-actin,1 ∶ 2 000) 4 ℃孵育过夜,洗膜;对应二抗室温孵育2 h,洗膜、显色、曝光。
1.2.5细胞增殖 将转染不同质粒的细胞以4.5×103细胞/孔接种于含有0.1 ml 10% FBS-DMEM培养基的96孔细胞培养板中,待细胞贴壁后以0、24、48和72 h为时间节点向每孔中加入10 μl CCK-8试剂,37 ℃孵育2 h,使用酶标仪测定在450 nm(OD 450)处的吸光度。
1.2.6细胞侵袭和迁移 利用transwell小室检测细胞侵袭和迁移能力能力,将0.2 ml DMEM培养基重悬的2.5×104细胞接种于用Matrigel处理的transwell上室中,将0.6 ml 20% FBS-DMEM培养基加入transwell下室中,置于37 ℃、5% CO2条件下培养48 h,取出小室,对侵袭到膜下的细胞固定、染色、拍照、计数。细胞迁移能力检测基本与细胞侵袭能力检测步骤相同,但无需将Matrigel加入上室中,且细胞加入后只需培养24 h。同时,通过划痕实验进一步检测迁移。在12孔细胞培养板中进行细胞转染,第2天使用无菌的10 μl枪头在长满细胞的孔板中划十字交叉垂线两条,PBS漂洗细胞3次,加2 ml DMEM培养基,分别以0、12和24 h为时间节点观察并拍照。
1.2.7细胞凋亡 细胞转染48 h后,用不含EDTA的胰酶消化细胞成单细胞悬液(消化时间不宜过长,否则容易引起假阳性),预冷的PBS漂洗细胞2次,收集(2~5)×105个细胞,按照Annexin V-APC/PI Apoptosis Detection Kit说明书使用流式细胞仪检测细胞凋亡。

2 结果
2.1 Rac1、Cdc42在RMS细胞中高表达在RMS细胞和正常骨骼肌细胞中分别检测Rac1、Cdc42的表达,以确定Rac1、Cdc42在RMS中的潜在作用。结果如图1 A、B所示,相对于HSKMC细胞系,在RD和RH30细胞系中Rac1、Cdc42 mRNA以及蛋白的表达水平明显升高。

图1 Rac1、Cdc42在RMS细胞中高表达
A:Rac1、Cdc42 mRNA表达水平;B:Rac1、Cdc42蛋白表达水平;与HSKMC细胞系比较:*P<0.05,**P<0.01
2.2 转染后细胞中Rac1、Cdc42的mRNA以及蛋白表达在RD和RH30细胞系中分别转染Rac1、Cdc42过表达质粒,提取总RNA以及总蛋白检测转染效率。结果如图2A、B、C、D所示,与EV相比,转染Rac1、Cdc42过表达质粒后Rac1、Cdc42 mRNA以及蛋白的表达水平显著升高。

图2 转染后细胞中Rac1、Cdc42的mRNA以及蛋白表达
A:Rac1 mRNA表达水平;B:Rac1蛋白表达水平;C:Cdc42 mRNA表达水平;D:Cdc42蛋白表达水平;与EV比较:**P<0.01,***P<0.001
2.3 Rac1、Cdc42促进RMS细胞增殖为研究Rac1、Cdc42对RMS细胞增殖能力的影响,课题组在RD和RH30细胞系中分别转染Rac1、Cdc42过表达质粒,使用CCK-8实验检测细胞的增殖能力。结果显示,与EV相比,过表达Rac1、Cdc42后RMS细胞的增殖能力增强。见图3A、B。

图3 Rac1、Cdc42促进RMS细胞增殖
A:RD细胞系;B:RH30细胞系;与EV比较:*P<0.05,***P<0.001
2.4 Rac1、Cdc42促进RMS细胞侵袭和迁移为研究Rac1、Cdc42对RMS细胞侵袭和迁移能力的影响,课题组在RD和RH30细胞系中分别转染Rac1、Cdc42过表达质粒,使用transwell实验检测细胞的侵袭和迁移能力。结果显示,与EV相比,过表达Rac1、Cdc42后RMS细胞的侵袭(图4A)和迁移(图4B)能力增强。在此基础上,进一步使用细胞划痕实验检测细胞的迁移能力。结果如图4C、D所示,与EV相比,过表达Rac1、Cdc42后RMS细胞的迁移能力增强。
2.5 Rac1、Cdc42抑制RMS细胞凋亡为研究Rac1、Cdc42对RMS细胞凋亡的影响,课题组在RD和RH30细胞系中分别转染Rac1、Cdc42过表达质粒,使用流式细胞术检测细胞的凋亡。结果如图5所示,与EV相比,过表达Rac1、Cdc42后RMS细胞的抗凋亡能力增强。
3 讨论
Rac1全称为Ras相关C3肉毒素底物1,其主要功能是通过启动p21活化的PAK1、PAK2和PAK3调节肌动蛋白细胞骨架,通过丝裂原活化蛋白激酶促进细胞增殖,通过NF-κB途径调节炎症反应等[6-8]。Cdc42全称为细胞分裂周期蛋白42,其可介导20多种下游分子活化,包括蛋白激酶、脂质激酶、支架蛋白等,从而参与一系列细胞功能调节,包括细胞极性、增殖、侵袭、迁移、肌动蛋白细胞骨架重塑等[9]。Rac1和Cdc42的活性主要受鸟嘌呤核苷酸交换因子、GTP酶活化蛋白和鸟嘌呤核苷酸解离抑制剂调节,使其在与二磷酸鸟嘌呤核苷结合的非启动状态和与三磷酸鸟嘌呤核苷结合的启动状态间循环转换,进而扮演了“分子开关”的角色[5]。
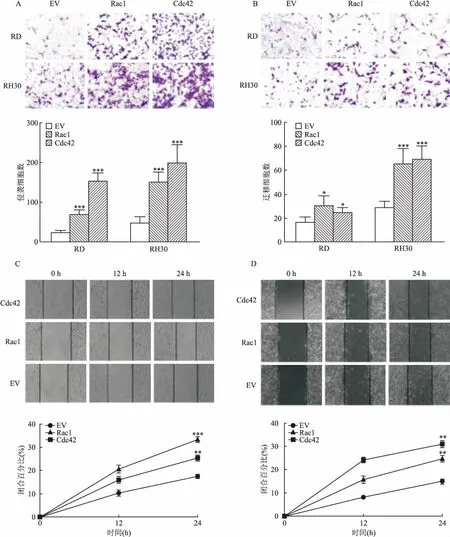
图4 Rac1、Cdc42促进RMS细胞侵袭和迁移
A:侵袭实验;B:迁移实验;C:RD细胞系,划痕实验;D:RH30细胞系,划痕实验;与EV比较:*P<0.05,**P<0.01,***P<0.001
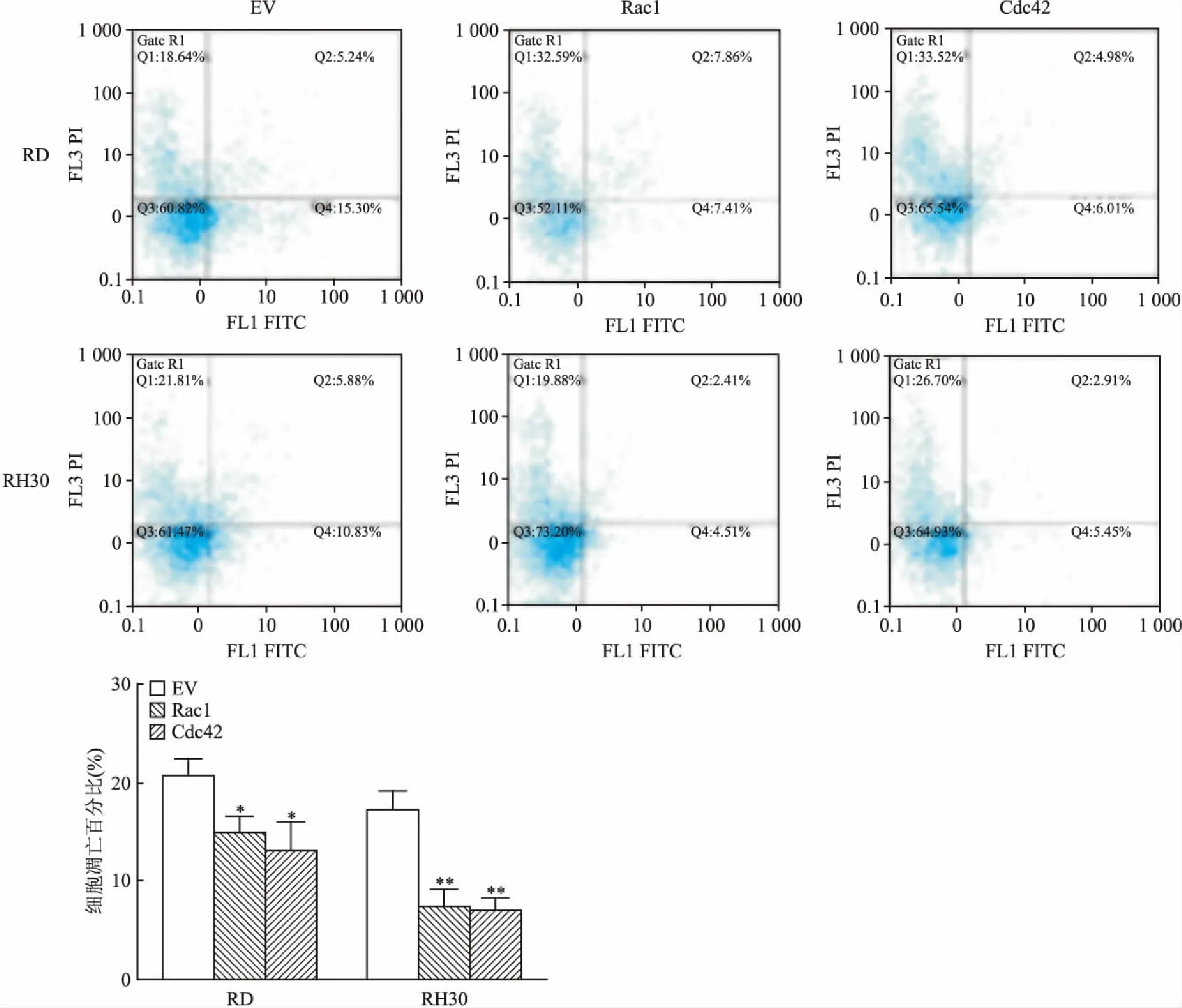
图5 Rac1、Cdc42抑制RMS细胞凋亡与EV比较:*P<0.05,**P<0.01
Rac1、Cdc42在肿瘤中同样具有重要作用,其在多种肿瘤中启动或过表达,参与多种细胞信号传导,调节肿瘤细胞周期、侵袭、迁移、凋亡以及肿瘤新生血管生成等。本研究显示,Rac1、Cdc42在正常骨骼肌细胞中低表达,而在RMS细胞中高表达。在此基础上,课题组在RD和RH30细胞系中转染Rac1、Cdc42过表达质粒,以验证Rac1、Cdc42对RMS细胞功能学的影响。结果显示,转染Rac1、Cdc42过表达质粒后二者表达升高,且相对于空白对照组,RD和RH30细胞的增殖、侵袭、迁移以及抗凋亡能力增强,表明Rac1、Cdc42在RMS中可能发挥癌基因的作用。
近些年随着研究的深入,人们意识到不应单纯的把Rac1、Cdc42看成独立的个体。虽然Rac1、Cdc42的具体作用机制不同,但约有70%的氨基酸序列相同[10],且结构相似,上下游调控分子也常一样,并在多种肿瘤中共同表达,参与肿瘤的发生发展,提示Rac1、Cdc42在参与肿瘤的发生发展过程中可能具有协同作用。研究[11]显示,在移动的细胞中Rac1、Cdc42的定位不断改变,其主要聚集于细胞运动方向的膜前端,当移动方向发生变化时,原部位的Rac1、Cdc42的表达量降低,表明二者可能与肿瘤细胞的转移存在联系。在肿瘤血管生成的研究[12]中证实,Rac1、Cdc42可通过增强p53蛋白泛素化,降低其稳定性,促进血管内皮生长因子的表达。同时,在骨和软骨形成的研究[13]中,Rac1、Cdc42的共同缺失表型比单一缺失表型对骨和软骨形成的影响更加明显,表明Rac1、Cdc42在调节骨和软骨形成过程中具有协同作用。本研究显示,Rac1和Cdc42在RMS细胞中均高表达,且促进细胞的恶性生物学行为。以上研究为Rac1、Cdc42在肿瘤中可能具有协同作用提供了理论基础。
RMS在治疗上取得的重大进步,归因于人们对肿瘤发病机制的深入研究。但危重患儿的5年生存率仍然较低,因此寻找新的诊断标志和治疗靶点具有重要意义。本研究显示,Rac1、Cdc42在RMS中高表达,并促进RMS细胞的增殖、侵袭、迁移以及抑制凋亡,说明Rac1、Cdc42在RMS中可能扮演癌基因的角色。这将为深入研究RMS的分子诊断及靶向治疗提供一定的理论依据。
