贺兰山东麓荒漠藻结皮微生物群落结构及其演替研究
2020-06-11陈丽萍苏建宇
陈丽萍,陈 青,赵 辉,苏建宇
宁夏大学生命科学学院,西部特色生物资源保护与利用教育部重点实验室, 银川 750021
生物土壤结皮(Biological soil crust,BSC)是由菌类、藻类、地衣、苔鲜等多种土壤生物与土壤颗粒形成的复合体,位于土壤表层。BSC能够稳定表层土壤,改良土壤结构,提高土壤肥力,增加土表湿度,具有遏制土壤荒漠化及促进荒漠地区生态系统恢复的重要作用[1- 3]。根据结皮中优势生物类群,BSC可划分成为藻结皮(微生物结皮)、地衣结皮和苔藓结皮3个不同发育阶段。藻结皮是BSC形成发育的早期阶段,在藻结皮的形成和发育过程中,土壤微生物扮演了极为重要的角色。蓝细菌(cyanobacteria)和微藻(micro-algae)等初级生产者及一些异养和自养细菌是藻结皮形成和早期发育的拓殖者[4- 6];在藻结皮的发育进程中,光合、固氮、纤维素降解等不同生理类群的微生物共同作用,形成了具有特定形态结构特征和生理活性的藻结皮[7- 8]。藻结皮通过微生物的生命活动与外界环境进行着活跃的物质交换,微生物的生命活动改变着藻结皮的结构特征和理化性质,影响着藻结皮的发育进程[9]。而藻结皮发育过程中理化性质的变化又促使了结皮层中微生物群落结构发生改变,二者之间的相互作用及发育演替,决定了藻结皮的发育过程[10- 12]。因此,荒漠土壤中藻结皮形成发育的直观表现是其形态结构、理化性质的变化,而内在的因素则是结皮层中微生物的生长及其群落的演替。
由于微生物在藻结皮形成和发育过程中的重要作用,国内外学者通过采用显微观察、平板分离、高通量测序等不同的技术手段对藻结皮中微生物生物量及多样性开展了研究,获得了大量的微生物群落组成方面的研究成果[3,6,13- 22]。BSC中微生物组成取决于其原位土壤环境及地理气候条件,不同地区藻结皮微生物组成及其演替规律具有较大差异。为了更深入的了解藻结皮发育与微生物群落间的相互关系,需要更广泛地对藻结皮发育过程中微生物群落演替进行研究。本文以采自宁夏贺兰山东麓荒漠草原的藻结皮为研究对象,在前期对该地区藻结皮发育过程进行研究的基础上[23],对不同发育阶段藻结皮中微生物的群落结构进行分析,以补充藻结皮发育与微生物群落结构研究方面的基础资料,为阐明BSC早期形成和发育过程中微生物群落变化规律,深入了解荒漠土壤中BSC形成及发育机制提供参考。
1 材料与方法
1.1 研究地区概况
贺兰山位于 38°21′—39°22′N,105°49′—106°42′E,海拔1100 —3565 m。贺兰山东麓处于银川平原西部边缘,为海拔1500 m以下的低山丘陵及洪积扇,平均海拔1230 m,年平均温度 8.5 ℃,1月份平均气温8.4℃,7月份平均气温23.1℃。年均降雨量200 mm左右,年均蒸发量1800 mm左右。
1.2 生物结皮样品
1.2.1样品采集
样品采集自宁夏贺兰山国家级自然保护区拜寺口至苏峪口东麓沿山地带,选择3个相距约1 km,地表无地衣、苔藓分布的100 m×100 m采样区(38°40′N,105°58′E;38°41′N,105°58′E;38°42′N,105°59′E),每个样区内在无植被覆盖的裸露地表随机采集约10 cm×10 cm大小的藻结皮样品100份,连同结皮下层约1 cm的土层一起铲下置于无菌样品袋中。实验室中将样品及其连带土置于垫有滤纸的瓷盘中,向盘中加水至没过结皮样品,4℃放置24 h后铲下结皮层,得到供试BSC样品。
1.2.2结皮发育阶段划分
根据课题组前期提出的藻结皮发育阶段划分标准及方法[23],通过测定供试结皮样品厚度、微生物生物量、叶绿素a含量、有机质含量、全氮含量、结皮持水量和结皮水分入渗速率等指标,得到不同发育阶段的结皮样品。
1.3 测定方法
1.3.1藻结皮理化性质测定
结皮厚度:数显游标卡尺(精度0.02 mm)测量结皮层厚度,测定结果以毫米为单位,保留一位小数。
微生物生物量:总核酸法测定微生物生物量。称取1 g结皮样品,加入10 mL无菌水,震荡20 min,3000 r/min离心10 min,弃上清液;离心管中加入5 mL 4℃的10%三氯乙酸(TCA),震荡20 min,3000 r/min离心10 min,弃上清液,再加入5 mL 10%的TCA,沸水浴30 min,3000 r/min离心10 min;取上清液,以10%TCA为参比液,测定样品在260 nm处的吸光度值。以A260表示样品中微生物生物量。
叶绿素a含量:采用丙酮萃取分光光度法测定叶绿素a的含量[24]。以663 nm下吸光度值(A663)表示叶绿素a含量。
结皮有机质和全氮含量:重铬酸钾外加热法测定结皮有机质含量;凯氏定氮法测定结皮全氮含量。
结皮持水量:采用陈青等的方法[23]。切取2 cm×2 cm室温自然干燥的结皮样品,置于垫有2 层滤纸的120 mm培养皿中,向培养皿中滴加蒸馏水至滤纸完全吸水,盖上皿盖,放置24 h,其间视滤纸水分含量变化进行补水,使之保持完全吸水状态。取结皮样品置于已知重量的铝盒中称重,得到最大持水量时的结皮质量(W1),然后将铝盒置于烘箱中105℃烘干至恒重,得到结皮干重(W2)。

结皮水分入渗速率:采用陈青等的方法[23]。切取2 cm×2 cm结皮样品,在结皮表面滴50 μL蒸馏水,开始计时至水分全部渗入结皮结束,得时间t。
结皮水分入渗速率(μL/s)=50 μL/t。
1.3.2结皮样品高通量测序
结皮样品送上海美吉生物医药科技有限公司,采用Illumina Miseq PE300 平台进行16S rDNA和18S rDNA高通量测序。
1.3.3数据分析
原始测序序列使用 FLASH 软件进行拼接,去除质控后长度低于50 bp 的序列和模糊碱基,根据重叠碱基 overlap将两端序列进行拼接。使用UPARSE 7.1软件对有效数据在97%的相似度水平进行操作分类单元(OTU)聚类,使用UCHIME 软件剔除嵌合体。利用RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,在不同分类水平上统计样本中微生物的群落组成。不同样本在97%一致性阈值下进行α 多样性分析,Canoco 5.0 软件对样本和环境因子之间进行相关性分析(RDA), Excel 2016、SPSS 19.0 进行数据统计与分析。
2 结果与分析
2.1 供试藻结皮样品理化性质
300份结皮样品根据其厚度、微生物生物量、叶绿素a含量、持水量、水分入渗速率、有机质含量和全氮含量等指标划分为4个不同发育阶段,各发育阶段结皮样品数量及其理化性质如表1所示。
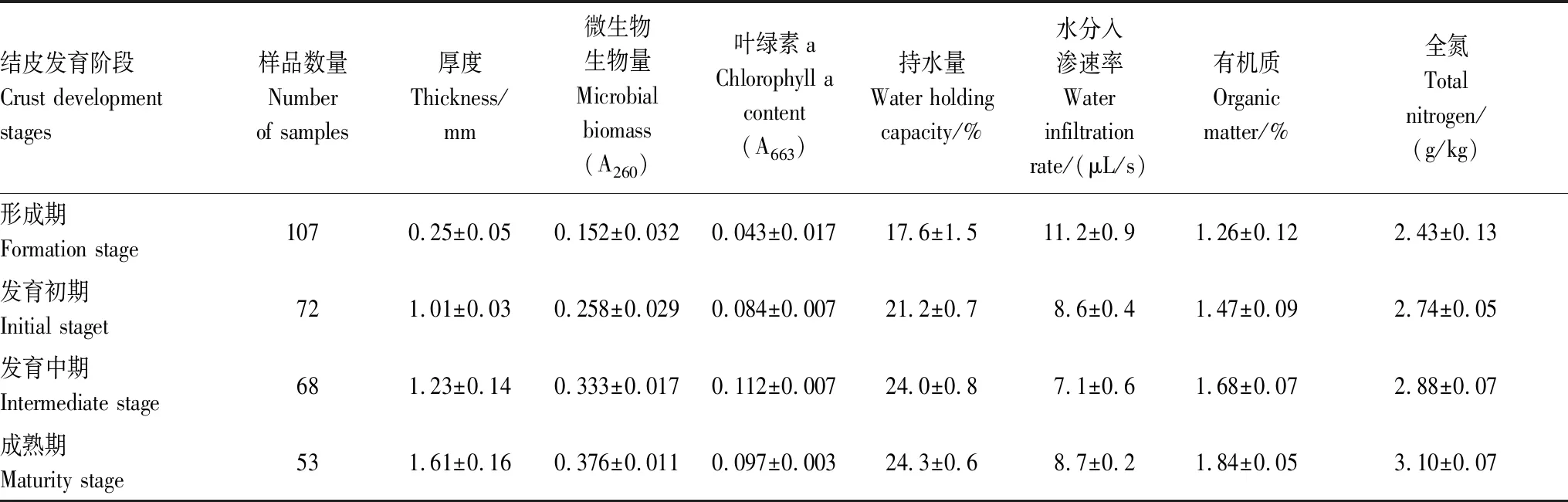
表1 藻结皮样品理化性质
2.2 不同发育阶段藻结皮样品微生物多样性
供试藻结皮样品16S rDNA和18S rDNA测序结果按OTU归类,在97%的相似度水平上进行OTU归并,分别得到521个16S rDNA序列OTU和64个18S rDNA序列OTU,表明结皮中原核微生物多样性远高于真核微生物。4个不同发育阶段(样品编号1—4)结皮样品特有的16S rDNA序列OTU分别为21、30、18和33个,4个阶段共有的OTU为157个(图1);4个不同发育阶段结皮样品特有的18S rDNA序列OTU均为1个,共有的OTU有39个(图2)。结果表明,在藻结皮发育过程中,原核微生物群落多样性明显改变,而真核微生物群落多样性基本稳定。
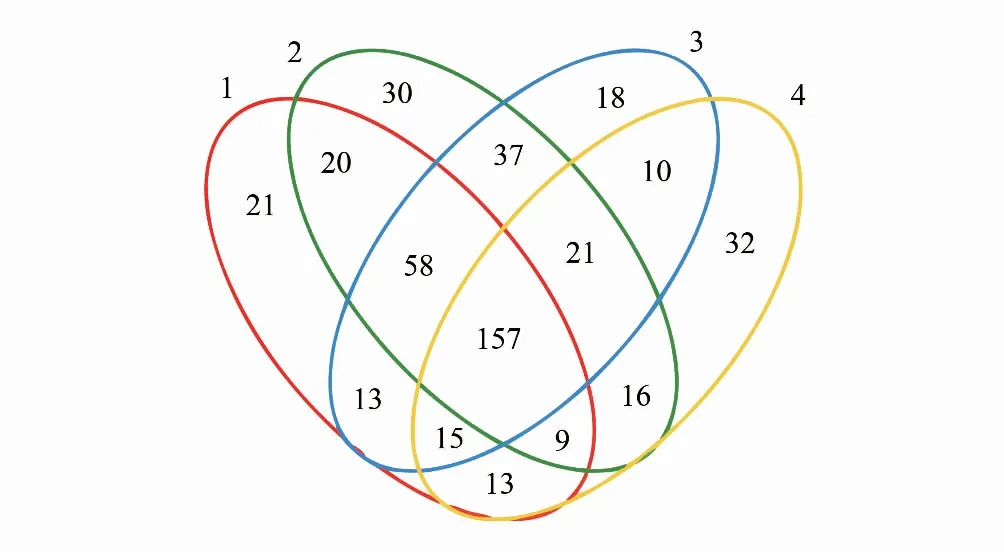
图1 16S rDNA序列OTU分布Venn图 Fig.1 16S rDNA sequence OTU distribution Venn diagram S1、S2、S3、S4: 4 个发育阶段藻结皮样品
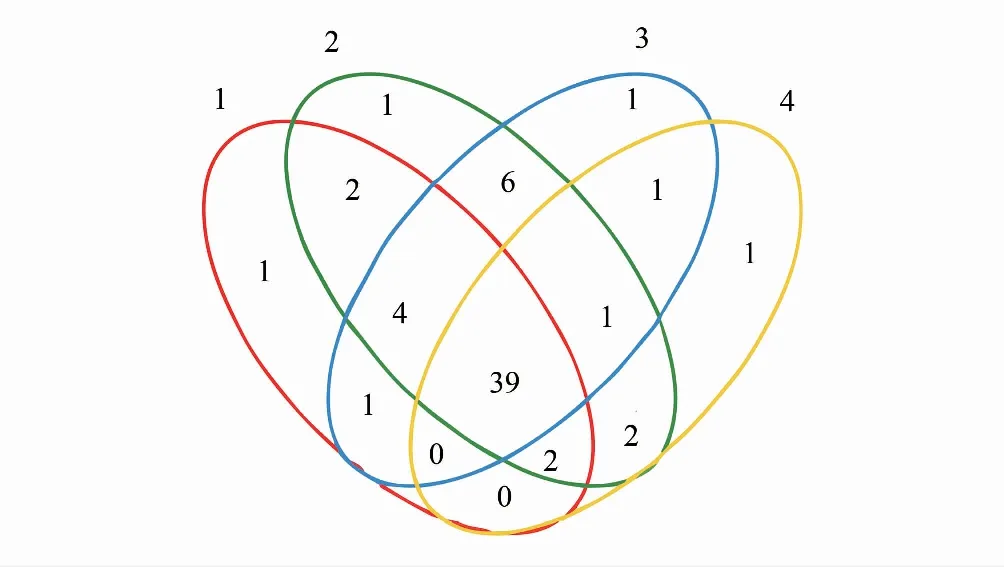
图2 18S rDNA序列OTU分布Venn图Fig.2 18S rDNA sequence OTU distribution Venn diagram S1、S2、S3、S4: 4 个发育阶段藻结皮样品
4个不同发育阶段藻结皮样品16S rDNA和18S rDNA序列OTU多样性指数统计分析结果如表2和表3。由分析结果可知,藻结皮在发育的过程中,原核微生物的丰度总体呈上升趋势,多样性则呈现先降低、再升高的趋势,而真核微生物的丰度基本保持稳定。
2.3 不同发育阶段藻结皮样品原核微生物群落组成
4个发育时期藻结皮样品原核微生物以纲为分类单位的群落Heatmap图见图3。结果表明,贺兰山东麓藻结皮中主要的原核微生物类群分布于26个纲,Cyanobacteria(蓝细菌纲)在各个发育阶段的结皮样品中都是优势微生物类群,说明了蓝细菌在荒漠土壤中分布的广泛性及其在藻结皮形成与发育中的重要性;Actinobacteria(放线菌纲)、Chloroplast、Alphaproteobacteria(变形菌纲)、Bacilli(芽孢杆菌纲)在藻结皮发育的各个阶段相对丰度也较高,是影响本地区藻结皮结构与功能的重要微生物类群。从4个发育阶段原核微生物群落组成来看,形成期原核微生物组成与其他3个时期有较大差异,表明藻结皮的发育对结皮层中原核微生物群落结构有较大的影响。
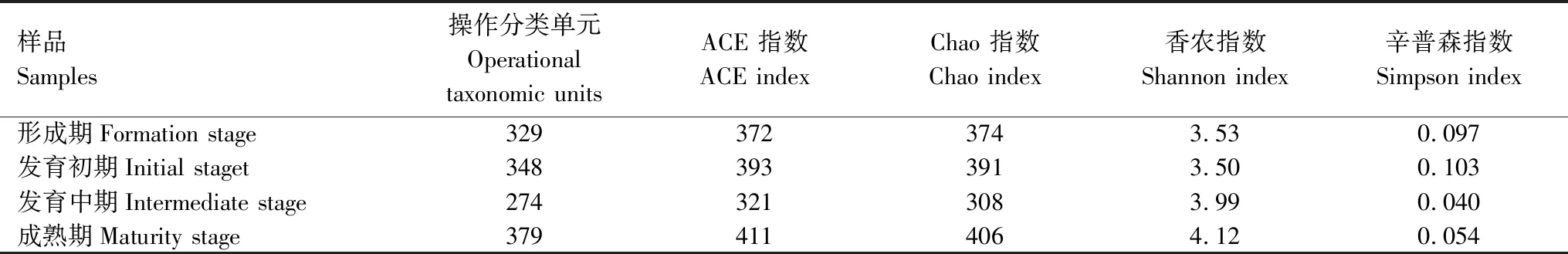
表2 16S rDNA序列统计分析结果

表3 18S rDNA序列统计分析结果

图3 原核微生物群落Heatmap图 Fig.3 Prokaryotic microbial community Heatmap S1、S2、S3、S4: 4 个发育阶段藻结皮样品
4个发育阶段藻结皮样品中原核微生物以属为分类单位的群落结构组成见图4。由图可以看出,Bacillus(芽胞杆菌属)、Leptolyngbya(细鞘丝藻属)、Microcoleus(微鞘藻属)、Microvirga(微枝形杆菌属)、Chroococcidiopsis(拟甲色球藻属)、Rubellimicrobium、Phormidium(席藻属)、Mastigocladopsis、Skermanella(斯科曼氏球菌属)、Nostoc(念珠藻属)、Scytonema(伪枝藻属)共11个属在各个发育阶段的样品中都存在,只是出现了丰度的差异,这11个属除Bacillus和Microvirga外,其他9个属均为蓝细菌。Bacillus在形成期、发育初期和发育中期样品中相对丰度较大,是除蓝细菌外在藻结皮形成早期发挥重要作用的原核微生物。成熟期Bacillus丰度显著下降,而Microvirga丰度较前3个时期明显增加。本地区藻结皮中原核微生物属水平上尚无分类信息和未培养的占较大的比例,其总体相对丰度在4个发育阶段的样品中均超过了50%。

图4 原核微生物群落结构组分图 Fig.4 Prokaryotic microbial community structure component map 丰度极低的部分合并为others在图中显示; S1、S2、S3、S4: 4 个发育阶段藻结皮样品
2.4 不同发育阶段藻结皮样品真核微生物群落组成
4个发育时期藻结皮样品中真核微生物以纲为分类单位的群落Heatmap图见图5。4个发育时期藻结皮样品中主要真核微生物类群分布于13个纲,其中Dothideomycetes(座囊菌纲)和Pezizomycetes(盘菌纲)在各个发育阶段藻结皮样品中丰度都很高,Agaricomycetes(伞菌纲)在形成期样品中相对丰度高达32.6%,但在藻结皮发育过程中其相对丰度迅速下降;在藻结皮的发育过程中,原生生物的相对丰度由形成期的1.7%逐渐增加至成熟期的6.8%;在成熟期藻结皮样品中,Lichinomycetes(李基那地衣纲)相对丰度显著增加,达到28.9%;本地区各发育阶段藻结皮样品中均未检测到真核微藻序列。

图5 真核微生物群落Heatmap图 Fig.5 Eukaryotic microbial community Heatmap map S1、S2、S3、S4: 4 个发育阶段藻结皮样品
4个发育时期藻结皮样品中真核微生物以属为分类单位的群落结构组成见图6。共发现有明确分类学信息的真核微生物13个属,其中4个发育时期样品中共有的为Coniothyrium(盾壳霉属)、Dendryphion、Friedmanniomyces、Phloeopeccania和Sarocladium(帚枝霉属)共5个属,其余8个属则只在个别发育阶段样品中检出;供试藻结皮样品中的真核微生物序列尚未确定种属分类的占大部分,在各个发育阶段的样品中其相对丰度均占70%以上。
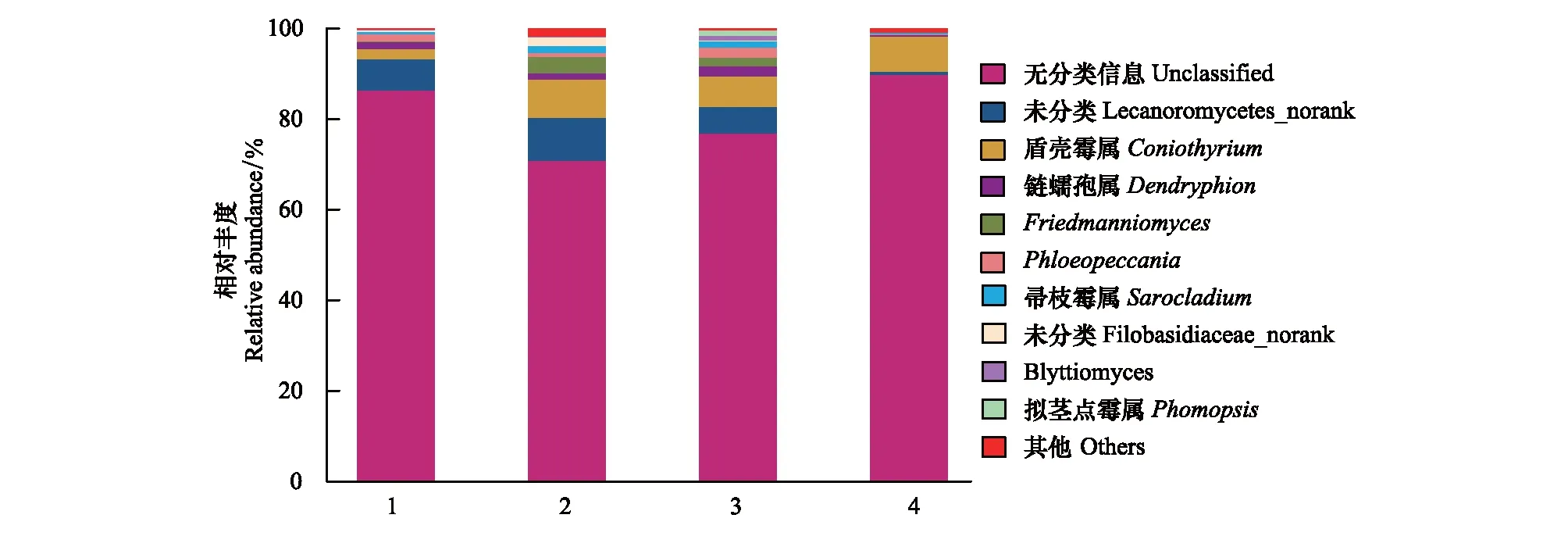
图6 真核微生物群落结构组分图Fig.6 Eukaryotic microbial community structure component map 丰度极低的部分合并为others在图中显示; S1、S2、S3、S4: 4 个发育阶段藻结皮样品
2.5 结皮样品与结皮理化性质相关性分析
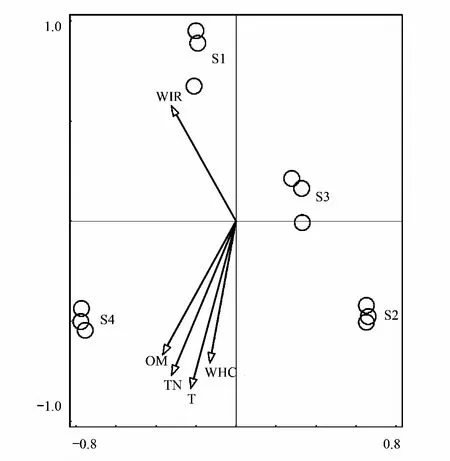
图7 4个发育阶段藻结皮样品原核微生物群落与结皮理化性质的冗余分析Fig.7 RDA for physicochemical properties of 4 development stages algal crust samples and prokaryotic microbial community SI、S2、S3、S4:4个发育阶段藻结皮样品; T:结皮层厚度 Crust thickness;TN:总氮 Total nitrogen;OM:有机质 Organic matter;WIR: 水分入渗速率 Water infiltration rate;WHC:最大持水量 Maximum water holding capacity

图8 4个发育阶段藻结皮样品真核微生物群落与结皮理化性质的冗余分析Fig.8 RDA for physicochemical properties of 4 development stages algal crust samples and eukaryotic microbial community
将不同发育阶段藻结皮样品与结皮理化性质进行冗余分析(RDA),结果如图7和图8所示。RDA结果表明,3个采样区划归为同一发育阶段的藻结皮样品分别聚为一类,而四个发育阶段的样品则彼此分离,表明处于同一发育阶段的藻结皮样品原核微生物和真核微生物组成相似,而不同发育阶段藻结皮样品中微生物群落组成存在明显差异。所分析的5个结皮层环境因子中,结皮层厚度(T)、有机质(OM)、总氮(TN)和最大持水量(WHC)等4个环境因子间高度相关,水分入渗速率(WIR)则与其他4个因子间呈负相关关系。影响结皮原核微生物群落组成和真核微生物群落组成最主要的环境因子均为结皮层厚度、总氮含量和有机质含量。
3 讨论
有研究表明,在BSC的早期发育阶段,除蓝细菌外一些绿藻、硅藻和裸藻等真核微藻也发挥了重要的拓殖作用[4- 5],但贺兰山东麓荒漠藻结皮样品中未检测到真核微藻序列,蓝细菌是试验区唯一优势光合自养生物类群,这可能是试验区干旱、贫瘠的土壤环境及较低的地温和较大的昼夜温差导致该地区土壤中真核微藻缺乏或丰度极低。
BSC的形成和发育是养分和有机质不断富积的过程[25]。在贺兰山东麓荒漠土壤环境中,作为BSC早期发育形式的藻结皮,其从形成到发育至成熟阶段,有机质含量提高了46.03%,全氮含量提高了27.6%(表1),养分积累非常显著。在藻结皮的形成期,土壤中的蓝细菌在适宜水分和温度条件下生长繁殖,其光合作用和自生固氮作用增加了土壤有机质和氮素含量,为芽孢杆菌等异养微生物的生长提供了营养条件,在此过程中,芽孢杆菌、蓝细菌等产生的胞外多糖粘结土壤颗粒,开启了藻结皮的形成和发育过程。随着藻结皮的发育,结皮层微生物生物量不断增加,至藻结皮发育后期,丝状蓝细菌和真菌菌丝体的捆绑作用进一步促进了结皮厚度的增加和结构的形成,是藻结皮后期发育的重要原因[3]。随着藻结皮发育阶段的推进,结皮厚度增加,土壤中的营养物质不断积累,持水性增高,土壤微生境有利于微生物的生长和繁殖,结皮层微生物的数量也不断增加,以土壤核酸含量所表征的土壤微生物生物量增加近1.5倍,二者之间表现出相互促进的关系。
贺兰山东麓荒漠藻结皮发育过程中,结皮层微生物在丰度明显增加的同时,其多样性与群落结构也发生着相应的变化,其中原核微生物群落演替现象尤为明显。原核微生物的多样性在藻结皮发育过程中呈现先降低、再升高的趋势,这可能是由于在发育中期作为优势类群的蓝细菌大量繁殖,抑制了其他原核微生物的生长,但在藻结皮发育成熟期,蓝细菌光合作用和固氮作用使结皮层有机质和氮含量增加,促进了细菌的生长,结皮层原核微生物表现出了较高的多样性。从群落组成来看,尽管蓝细菌的相对丰度在藻结皮发育过程中发生着变化,但这类自养微生物在各发育阶段藻结皮样品中始终占有较大比例,与古尔班通古特沙漠、柴达木盆地、腾格里沙漠、科尔沁沙地、库布齐沙漠等地BSC中微生物群落结构研究结果一致[5,26- 30]。本地区藻结皮中优势蓝细菌包括拟色球藻属(Chroococcidiopsis)、聚球藻属(Synechococcus)、斯塔尼尔氏菌属(Stanieria)、集胞藻属(Synechocystis)、发毛针藻属(Crinalium),与上述已报道的BSC中蓝细菌组成有较大差异,说明BSC中优势微生物类群及其演替具有地区特异性。研究发现,结皮层厚度、总氮含量和有机质含量是影响结皮层微生物群落组成最重要的环境因子,这与吕星宇和张志山[31]对沙坡头固沙植被区土壤微生物的研究结果一致。藻结皮发育过程中原核微生物群落结构变化较大,而真核微生物群落结构基本稳定,这既反映了原核微生物对环境条件变化的敏感性,也说明了藻结皮发育过程中原核微生物在结皮理化性质变化方面发挥了更大的作用。
4 结论
贺兰山东麓藻结皮中主要的原核微生物类群分布于26个纲、82个属。原核微生物中蓝细菌纲在各个发育阶段的藻结皮中都是优势微生物类群,Actinobacteria(放线菌纲)、Chloroplast、Alphaproteobacteria(变形菌纲)、Bacilli(芽孢杆菌纲)也是影响本地区藻结皮结构与功能的重要原核微生物类群。本地区藻结皮中原核微生物无种属分类信息和未培养的占较大的比例,其总体相对丰度在四个发育阶段的藻结皮中均超过了50%。主要真核微生物类群分布于13个纲、14个属,真核微生物主要是子囊菌,担子菌在形成期藻结皮样品中丰度较高,但在藻结皮发育过程中丰度迅速下降。实验区藻结皮中真核微生物尚未确定种属分类的占大部分,在各个发育阶段的藻结皮样品中其相对丰度均占70%以上。实验区各发育阶段藻结皮样品中均未检测到真核微藻。
