野百合碱对人肝窦内皮细胞的毒性机制研究
2020-06-11王蔚倩叶铉玲熊爱珍王峥涛
王蔚倩,叶铉玲,陈 岩,熊爱珍,杨 莉,王峥涛
(上海中医药大学 1.中药研究所中药标准化教育部重点实验室暨上海市复方中药重点实验室、2.交叉科学研究院,上海 201203)
近年来,中药的“毒性”问题已引起国际社会的关注和担忧,继“马兜铃酸”风波之后,另一大类毒性更强、波及面更广的天然植物性毒素-吡咯里西啶生物碱(pyrrolizidine alkaloids, PAs),成为国际上关注的新热点[1]。PAs广泛分布于6000多种高等植物中,目前已经发现660余种PAs及其氮氧化物,其中近一半都被报道对人或者牲畜有毒性[2]。被PAs污染的谷物、牛奶、蜂蜜等食物及含PAs的传统草药、补剂、茶等均可对人类造成极大的危害。PAs可导致肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS)、肝巨大细胞症、肝纤维化坏死等严重的肝脏损伤,目前在临床上尚无有效的预防和治疗药物。
HSOS是肝窦内皮细胞(sinusoidal endothelial cells,SECs)损伤致肝窦流出道阻塞所引起的肝内窦性门脉高压,又称肝小静脉闭塞病(hepatic veno-occlusive disease,HVOD),临床主要症状为肝肿大、肝区疼痛、腹水、黄疸、高血胆红素等[3]。其发病机制可能与SEC内谷胱甘肽耗竭,一氧化氮消耗,基质金属蛋白酶(matrix metalloproteinases,MMPs)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的肝内表达增加,以及凝血因子的激活等有关[4]。HSOS缺乏特效治疗,重症患者常因多脏器功能衰竭而死亡,在发病早期及时识别以及早期干预至关重要[5]。SEC铺衬在肝血窦内,表面富含窗孔,为肝窦和窦周间隙(Disse间隙)之间溶质的交换开放通道,可以通过改变窗孔直径和数量调节肝血窦内外的物质交换与信息交流,参与形成血液—肝细胞屏障[6]。由于SEC是HSOS的最直接损伤部位,所以近年来相关机制研究开始关注肝窦内皮的损伤,并以此作为研究切入点。
野百合碱(monocrotaline,MCT)主要存在于猪屎豆属植物中,是目前研究最多的毒性PAs之一,常用来在动物上建立HSOS模型[7]。MCT进入体内后会被肝脏中的细胞色素P450酶代谢活化为脱氢野百合碱(dehydromonocrotaline,DMCT),并迅速与细胞大分子如蛋白质作用形成吡咯蛋白加合物(pyrrole-protein adducts,PPA),继而引发肝毒性。有研究表明,DMCT与内皮细胞上的F-actin共价结合后,可导致肌动蛋白细胞骨架的解体和内皮细胞的圆形化甚至脱落,并伴随着血红细胞进入窦周间隙,同时导致MMPs的升高,从而降解细胞外基质,由此进一步造成SEC脱落[8-9]。SEC脱落死亡是HSOS发病过程中至关重要的因素,也是HSOS区别于其他类型肝损伤的显著特征。
目前关于PAs对SEC毒性的报道研究大都利用整体动物模型,影响因素较多,而几乎没有将PAs直接作用于人肝窦内皮细胞(human hepatic sinusoidal endothelial cells,HHSECs)上进行体外毒性机制的深入研究。本研究以MCT为代表性药物,研究其体外直接作用于HHSEC的毒性反应及其作用机制,为临床HSOS的治疗提供实验基础和理论依据。
1 材料
1.1 细胞与试剂HHSEC细胞株与其特制培养体系(MED-0002)购于中国武汉原生原代生物医药科技有限公司;人正常肝细胞株(L-02)购自中国科学院细胞库;RPMI 1640培养基(批号2122752)购于美国Life Technology 公司;胎牛血清(批号1739463)及青霉素-链霉素(批号2068824)购于美国Gibco公司;MCT(BP0957)购自成都普瑞法科技开发有限公司; RIPA裂解液(批号TL277222)和BCA 蛋白测定试剂盒(批号UB276926)购于美国Thermo Fisher公司;抗体cleaved caspase-3(#9661)、PARP(#9532)、β-actin(#4970)购于美国Cell Signaling公司;还原型谷胱甘肽(GSH)试剂盒(批号20180821)购于南京建成生物科技有限公司;逆转录试剂盒(批号AI70509A)和实时定量PCR试剂盒(批号AJ10745A)购于日本TaKaRa公司;CCK-8试剂盒(批号PG678)购于日本同仁公司;Caspase-3荧光底物Ac-DEVD-AFC(批号2857919)购于美国Biomol公司;Hoechst染色试剂盒(批号022519190919)购于上海碧云天生物技术有限公司;RNA极速抽提试剂盒(#220011)购于上海飞捷生物技术有限公司。
1.2 仪器细胞培养箱(新加坡ESCO公司);SparkTM多功能酶标仪(瑞士TECAN公司);ABSCIEX QTRAP6500液相色谱-质谱联用仪(美国ABSCIEX公司);凝胶电泳仪、电转仪(美国Bio-Rad 公司);凝胶成像仪(美国GE 公司);荧光显微镜(日本OLYMPUS公司);QuantStudio 6 Flex 型实时荧光定量PCR仪(美国Applied Biosystems 公司)。
2 方法
2.1 药物配制称取适量MCT,用10%的盐酸水溶液充分涡旋溶解,加1 mmol·L-1NaOH 调节至pH 7.2,配制母液500 mmol·L-1。
2.2 细胞培养将HHSEC培养于含5%灭活胎牛血清、1%内皮细胞生长添加剂和1%青霉素-链霉素的人肝窦内皮细胞特制培养基。人正常肝L-02细胞培养于含10%灭活胎牛血清和1%青霉素-链霉素的RPMI1640培养基中。细胞放置在37 ℃,5% CO2的培养箱中培养。
2.3 细胞活力检测CCK-8试剂盒被用于检测细胞活性。将HHSEC接种于96孔板,细胞贴壁后,将细胞分别与不同浓度的MCT,共孵育24 h后弃去原培养基,向每个孔中分别加入100 μL含10% CCK-8培养基,并在培养箱中孵育1 h,用酶标仪测定吸光度(450 nm)。将细胞存活率以对照组的百分比进行标准化并按以下公式计算细胞活力:细胞活力/%=(给药组-空白组)/(对照组-空白组)×100%。
2.4 PPA含量测定参考文献报道的方法,采用柱前衍生化LC-MS法检测细胞及培养基中PPA的含量[10]。采用RIPA裂解液提取细胞总蛋白,细胞蛋白裂解液及培养基分别使用Ehrlich试剂反应衍生化处理,再利用液质连用仪进行检测。以Waters Acquity BEH C18(2.1×100 mm,1.7 μm)色谱柱分离,0.1%甲酸溶液(A)-乙腈(B)为流动相梯度洗脱,梯度洗脱如下:0~1 min,10% B;1~6 min,40% B;6~10 min,95% B。流速为0.4 mL·min-1,进样2 μL。采用多反应监测MRM(341>252;341>296)测定样本中PPA的含量。
2.5 细胞内GSH含量测定将细胞与不同浓度的MCT共孵育24 h,收集细胞,参照GSH试剂盒说明书测定GSH含量。
2.6 Hoechst 33258细胞染色观察将HHSEC接种于96孔板(2×104个/孔),细胞贴壁后分别加入不同浓度的MCT,共孵育24 h后弃去培养基,按照试剂盒说明书,加入固定液固定10 min,PBS洗涤两遍后加入Hoechst 33258染色液染色5 min,再用PBS洗涤两遍,在荧光显微镜下观察。
2.7 Caspase-3酶活性检测使用caspase-3荧光底物(Ac-DEVD-AFC)测定caspase-3活性。将细胞与不同浓度的MCT共孵育24 h,收集细胞,提取蛋白,用BCA 蛋白测定试剂盒测定蛋白浓度。参照试剂盒说明书,取20 μg蛋白,加20 μmol·L-1荧光底物及缓冲液至200 μL于96孔板中,混匀后在37 ℃恒温箱中避光孵育1 h,测定荧光信号。荧光信号通过荧光酶标仪分别在400 nm和510 nm的激发波长和发射波长下检测。根据给药组与空白对照组吸光值的比值计算相对caspase-3活性。
2.8 蛋白免疫印迹法检测将细胞与不同浓度的MCT共孵育24 h,收集细胞,提取蛋白,用BCA 蛋白测定试剂盒测定蛋白浓度。取适量蛋白变性,通过SDS-PAGE凝胶电泳分离蛋白(上样量为每孔30 μg蛋白),然后电泳转移至PVDF膜。先用5% BSA室温封闭2 h,再与一抗(1 ∶ 1 000)4 ℃共孵育过夜,用PBST洗去残留的一抗后与相应二抗(1 ∶ 5 000)孵育1 h,再用PBST洗去多余抗体,最后将膜放于显影液中反应,置凝胶成像仪中观察。以内参蛋白 β-actin为参照,计算目的蛋白的相对表达量。
2.9 实时荧光定量聚合酶链式反应分析将细胞与不同浓度的MCT共孵育24 h,收集细胞,根据RNAfast200总RNA极速抽提试剂盒说明书提取总RNA,用PrimeScript RT Master Mix试剂盒将1 μg RNA逆转录为cDNA。根据SYBR Premix Ex Taq试剂盒说明书使用SYBR green预混物进行实时荧光PCR检测细胞中目的基因mRNA 表达水平。以内参基因GAPDH为参照,通过2-ΔΔCt方法分析目标基因的相对表达量。使用的引物序列见Tab 1。
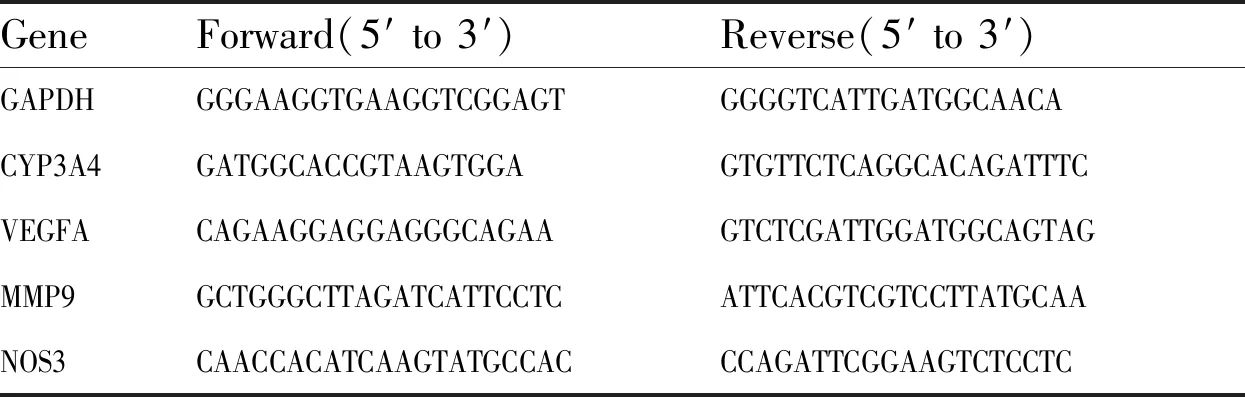
Tab 1 Primers for qPCR analysis
3 结果
3.1 MCT对HHSEC细胞存活率的影响HHSEC与不同浓度MCT(0、0.5、1、5、10 mmol·L-1)共孵育24 h,通过CCK-8试剂盒检测MCT对HHSEC细胞存活率的影响。由Fig 1A可知,与空白组比较,5 mmol·L-1MCT能显著降低HHSEC的细胞存活率至72%,10 mmol·L-1MCT则将细胞存活率明显降低为45%。然而,在测试浓度范围内,MCT(0~10 mmol·L-1)对L-02细胞存活率无显著影响(Fig 1B)。由此可知,HHSEC对MCT的毒性更加敏感。
3.2 细胞及培养基中PPA的含量测定HHSEC与不同浓度MCT(0、1、5 mmol·L-1)共孵育24 h后,检测细胞及培养基中PPA的含量。由Fig 2可知,给药后HHSEC细胞及培养基中都检测到一定含量的PPA,且细胞及培养基中PPA含量均随MCT给药浓度增加而增多。

Fig 1 Cytotoxicity of MCT on HHSECs and L-02
*P<0.05,**P<0.01vs0 mmol·L-1MCT

Fig 2 Concentration of PPA in cell lysate and medium of HHSECs exposed to
*P<0.05,**P<0.01vs1 mmol·L-1MCT.
3.3 MCT降低了HHSEC内GSH的含量HHSEC与不同浓度MCT(0、1、5 mmol·L-1)共孵育24 h后,HHSEC细胞内的GSH含量随MCT给药浓度的增加而减少。如Fig 3所示,5 mmol·L-1MCT给药24 h可显著降低细胞内GSH含量(P<0.05)。
3.4 MCT诱导HHSEC发生凋亡HHSEC与不同浓度MCT(0、5、10 mmol·L-1)共孵育24 h后,通过Hochest染色,caspase-3活性,cleaved caspase-3及cleaved parp的蛋白表达水平检测细胞凋亡。由Hoechst33258染色结果可知(Fig 4A),5和10 mmol·

Fig 3 GSH content in HHSECs decreased by
*P<0.05vs0 mmol·L-1MCT
L-1MCT给药组可见明显细胞核固缩, 提示MCT可诱导HHSEC发生凋亡。5和10 mmol·L-1MCT给药组caspase-3蛋白酶活性显著升高,分别为空白对照组的3.0倍和17.8(Fig 4B)。由Fig 4C可知, MCT(10 mmol·L-1)给药还可显著增加HHSEC细胞凋亡活化蛋白标志物cleaved caspase-3及cleaved parp的蛋白表达水平。以上结果均表明,MCT可诱导HHSEC凋亡。
3.5 相关基因的表达水平检测HHSEC与不同浓度MCT(0、1、5 mmol·L-1)共孵育24 h后,收集细胞并检测了相关基因的mRNA表达水平。结果可知(Fig 5),相比空白对照组,5 mmol·L-1MCT给药组CYP3A4基因表达水平升高3.9倍,VEGFA和MMP-9表达水平分别增加1.9倍和3.1倍,而NOS3表达水平则显著下降,约为空白对照组的54%。
4 讨论
PAs是导致临床HSOS的主要原因之一[3]。近年来,因误服误用含PAs的中草药及复方所致HSOS的报道逐年增多,引起了国际国内社会的广泛关注。目前,关于HSOS的发病机制并不十分明确,涉及多种细胞、分子以及信号通路。大量研究表明,SEC损伤是HSOS发生的起始因素和关键环节[4,15],然而由于SEC细胞上代谢酶含量相对较低,几乎没有将PAs直接作用于SEC的体外研究,大多数研究者采用体内动物模型,使得其机制更加复杂。因此,本研究尝试以HHSEC模型研究MCT的体外毒性作用,并初步探讨其产生细胞毒性的机制。
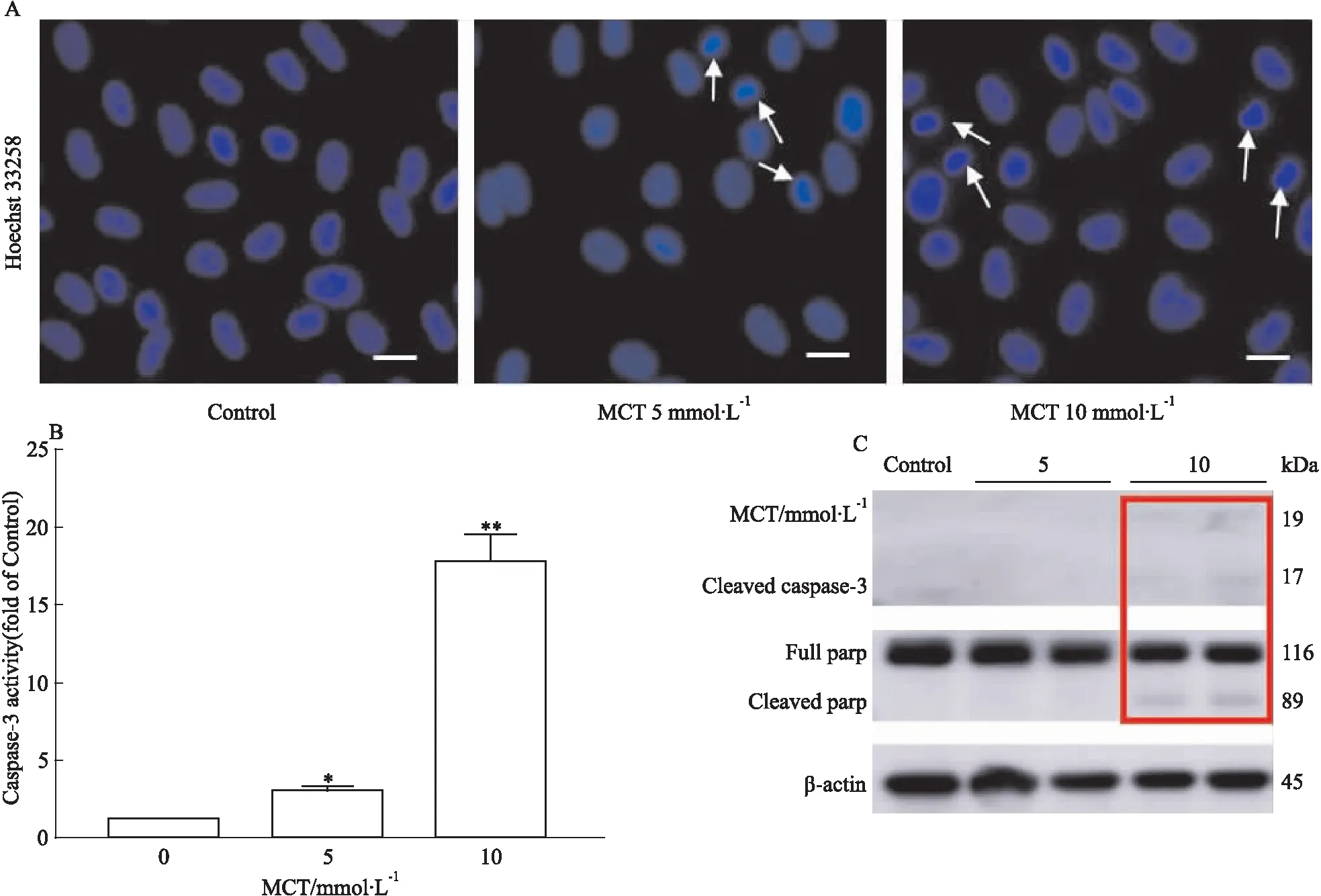
Fig 4 Apoptosis in HHSECs induced by
A:Representative images of Hoechst staining of HHSECs. White arrows denote apoptotic nuclei. The bar represents 25 μm;B:Caspase-3 activity assay of total cell lysates of HHSEC;C:The protein expression levels of cleaved caspase-3 and cleaved parp.*P<0.05,**P<0.01vs0 mmol·L-1MCT

Fig 5 The mRNA expression levels of target genes in
**P<0.01vs0 mmol·L-1MCT
我们首先测试了MCT对HHSEC 的细胞毒性。结果表明MCT(5, 10 mmol·L-1)可显著降低HHSEC的细胞存活率,而同样浓度下MCT对L-02细胞则没有明显毒性,由此证明了MCT对HHSEC毒性的特异性。大部分PAs需过肝脏细胞色素P450酶(主要为CYP3A4酶)代谢活化并生成PPA继而引发肝脏毒性。PPA不仅是PAs代谢活化的直接证据,也被中华医学会消化病学分会肝胆疾病协作组建议作为PAs毒性生物标记物[3]。我们在给药MCT的HHSEC细胞裂解液及培养基中均检测到了大量PPA,且其含量与MCT给药浓度且呈剂量依赖性增加。由此可知,MCT经HHSEC中的药物代谢酶代谢活化后形成活性中间体,一方面与细胞中的蛋白结合形成PPA,另一方面也可排出细胞与培养基中的蛋白结合形成PPA。这与文献在PAs所致HSOS的临床患者及灌胃PAs的动物血液及肝组织检测到PPA的报道相符[10]。我们进一步验证了HHSEC细胞代谢酶的水平,在HHSEC中检测到了一定含量的代谢活化关键酶CYP3A4,而MCT可以诱导CYP3A4的表达,进一步加速MCT代谢活化,从而加剧对HHSEC的损伤。
谷胱甘肽作为细胞内主要的抗氧化剂和自由基清除剂,对于细胞生理功能的维持具有重要作用。研究表明,PAs经代谢活化产生的活性中间体,除了与蛋白结合生成PPA进一步诱发毒性外,还可通过与GSH结合生成GSH结合物从而利于其排出而解毒[11],这也是体内PAs毒性的一条重要的减毒途径。而HHSEC由于自身所含GSH水平较低,GSH大量消耗且无法及时补充,将使其更加易于受到毒物的侵害而死亡,从而加剧了HSOS损害[8]。与本实验中,MCT给药后HHSEC中GSH含量显著下降,与文献报道相符,也是造成其毒性的重要原因之一。
此外,细胞凋亡也被认为是PAs引发毒性的重要机制之一[12-14]。caspases蛋白家族在细胞凋亡过程中具有重要的调节作用。caspase-3蛋白是凋亡的关键执行者,在药物或其他信号分子作用下,caspase-3被剪切活化产生cleaved caspase-3,并剪切其下游靶蛋白PARP产生cleaved parp,启动细胞凋亡。因此,cleaved caspase-3及cleaved parp可用作凋亡的指标物。本实验中,MCT给药可诱导HHSEC细胞核固缩、深染,诱导caspase-3酶活力呈剂量依赖性增加,并诱导细胞中cleaved caspase-3及cleaved parp的蛋白表达水平升高。由此可知,MCT可诱导HHSEC发生凋亡,导致毒性。根据课题组前期的研究及文献报道,PAs可在体内外诱导细胞凋亡导致毒性,但其中涉及到多种信号分子及作用机制,包括降解抗凋亡因子Bcl-xl[12]、诱导Drp1干扰线粒体分裂融合[13]、诱导Fas受体[14]等。然而,MCT诱导HHSEC凋亡具体通过哪些信号通路仍需进一步深入研究。
另有研究表明,MCT可引起大鼠窦状隙内皮细胞中F-actin的解聚,导致SEC中金属蛋白酶-9(MMP9)表达增加,从而降解细胞外基质造成SEC脱落诱导HSOS[15]。而Iguchi等[16]则观察到HSOS患者血清VEGF水平显著升高。我们的研究表明,MCT显著增加了HHSEC细胞中MMP-9和VEGFA的mRNA表达水平,与文献报道结果一致。另外我们还发现MCT可降低HHSEC中NOS3的mRNA表达水平。内皮一氧化氮合酶(eNOS)是一种心血管系统中的重要酶,表达于SEC,可催化一氧化氮(NO)的生成,从而保护内皮细胞[17];在HSOS模型动物中,可见NO含量显著下降[18]。我们的研究表明,MCT降低了NOS3的mRNA表达水平,这可能会减少NO的产生,从而进一步损伤内皮细胞加剧毒性。
综上所述,MCT 经HHSEC内代谢酶代谢活化,同时消耗细胞内GSH破坏肝脏抗氧化系统。MCT代谢活化一方面激活了HHSEC凋亡,另一方面影响内皮及血管系统等进一步加剧HHSEC损伤。本研究探讨了MCT对HHSEC的体外细胞毒性及其毒性机制,为PAs所致临床HSOS疾病的研究提供了理论依据。
