骨肽原液对骨髓间充质干细胞成骨分化作用的影响
2020-06-11吴彦霖杨泽岸胡文言
张 媛, 吴彦霖, 纳 涛, 杨泽岸, 胡文言, 高 华
(1.中国食品药品检定研究院化学药品检定所药理室, 北京 102629; 2.中国生化制药工业协会,北京 100068)
骨肽类药物是由新鲜或冷冻的猪、鹿或胎牛四肢骨经生物技术提取的骨活性物质精制而成,内含有骨形成蛋白(bone morphogenetic protein,BMPs)等多种多肽类骨代谢活性因子,以及多种骨修复所需的无机元素、氨基酸及微量元素等[1,2]。目前骨肽类药物作为治疗骨折的临床常用药物,主要通过刺激成骨细胞增殖,对钙磷代谢进行调节,使得钙沉积有效增加,从而帮助新骨形成[3-4]。骨髓间充质干细胞(marrow mesenchymal stem cells,BMSCs)是骨髓中的一种多能干细胞,具有干细胞的所有共性,即自我更新和多向诱导分化能力,具有来源广泛、获取简单、易于培养、体外增殖能力强和自体移植无排斥反应等特点,广泛应用于组织工程及再生医学领域,被公认为是骨组织工程最为常用的种子细胞[5]。机体骨折后的修复过程类似于胚胎期骨形成,需要骨折部位局部聚集足够数量的BMSCs来进行骨修复,近年来许多体外研究以不同药物作为诱导剂加入BMSCs细胞培养体系中,对其进行成骨诱导分化。在BMSCs诱导分化过程中,多种骨代谢因子发挥了重要作用,骨肽中含有多种骨诱导活性因子,具有诱导BMSCs成骨细胞分化的潜质。因此,本研究选用BMSCs为研究对象,探索骨肽原液诱导胎儿骨髓间充质干细胞(fetal marrow mesenchymal stem cells, F-BMSCs)成骨分化的分子作用机制,并对不同厂家的骨肽原液进行比较。
1 实验材料
1.1 药物与试剂BMSCs完全培养基(HUXMF-90011)、0.1%茜素红S染液,购于赛业生物科技有限公司;Fetal Bovine Serum(10099141C)、0.25%Trypsin-EDTA(25200056)、Stempro成骨诱导分化试剂盒(A1007201)购于Gibco;磷酸盐缓冲液(SH30256.01B)购于Hyclone;CCK-8细胞增殖-毒性检测试剂盒(CK04)购于Dojindo;4%多聚甲醛(P1110-100ml)购于索莱宝;ALP检测试剂盒(P0321)、SDS-PAGE蛋白上样缓冲液(6×)(P0015F)、 Western及IP细胞裂解液(无抑制剂)(P0013J)购于碧云天;TRIzol(15596026)购于Invitrogen;DEPC-treated water(R0601)、RevertAid? First Strand cDNA Synthesis Kit(K1622)购于Fermentas;Runx2 Monoclonal Antibody(AMAB90591)、Anti-Actin antibody(A3853-100UL)购于Sigma;Osteocalcin Polyclonal Antibody (PA5-11849)、Western blotting显影液(34095)购于Thermo;兔源二抗(NA9340-1ML)、鼠源二抗(NXA931-1ML)购于GE;脱脂奶粉(232100)购于DIFCO;硝酸纤维素膜(IPVH00010)购于PALL;人间充质干细胞分析试剂盒(562245) 购于BD。 骨肽原液来源于4个生产厂家:厂家A、B、C、L。
1.2 细胞株大鼠骨肉瘤细胞株(UMR106),购于中国协和医科大学基础医学院细胞中心;胎儿骨髓间充质干细胞(F-BMSCs),购于赛业生物科技有限公司。
1.3 仪器生物安全柜,Thermo,型号:1389 A2;二氧化碳培养箱,Thermo,型号:3141;高速离心机,Beckman Coulter,型号:6R;细胞计数仪,Beckman Coulter,型号:Z2;多功能微板检测仪酶标仪,Biotek,型号: SYNERGY HT;电热恒温水浴锅,上海森信,型号:DK S26;紫外分光光度计,北京普析,型号:TU-1901;实时荧光定量PCR仪,Applied Biosystems,型号:AB7500 FAST;PeqSTAR 96 universal gradient PCR仪,PeqlabGmbH,型号:BCS015850;超微量分光光度计,Malcom,型号E-SPECT;医用洗片机,泰兴市泰晟医疗器械厂,型号 TS435-A;流式细胞仪,BD FACS Calibur;电泳仪,Bio-Rad PowerPac;超纯水机,ADVANTAGE,型号:A10。
2 实验方法
2.1 促UMR106细胞增殖作用[6]UMR106细胞融合度达到80%~90%时,用0.25% Trypsin进行消化。将消化下来的细胞用1%FBS培养基稀释成细胞悬液,调整细胞浓度为2×107·L-1接种至96孔板,每孔加入100 μL。细胞贴壁24 h后,吸弃孔内培养基,设不同组别,更换培养基。其中,阴性对照组加入含PBS(与加入药物等体积)的1%FBS的培养基,供试品组加入含不同浓度骨肽原液的1%FBS培养基,另设不含细胞的完全空白组。将厂家A、B、C、L骨肽原液配制为0.06、0.125、0.25、0.5、1.0、2.0 g·L-1浓度的含药1%FBS培养基,每孔分别加入对应的组别药物100 μL,作用48 h、72 h后使用CCK-8法进行测定,计算细胞增殖率,以细胞增殖率的大小评价骨肽原液促UMR106细胞增殖活性。细胞增殖率/%=[(供试品组OD值-完全空白组OD值)/(阴性对照组OD值-完全空白组OD值)]×100%
2.2 F-BMSCs免疫表型检测F-BMSCs置于37 ℃,5%CO2培养箱中培养,当细胞融合度达到80%~90%时,用人间充质干细胞分析试剂盒中的抗体标记细胞,并用流式细胞仪检测。用FlowJo软件对间充质干细胞表面标志蛋白CD73、CD90、CD105和阴性对照标志蛋白CD11b、CD19、CD34、CD45、HLA-DR进行分析。
2.3 CCK-8法检测骨肽原液对F-BMSCs的影响当培养的F-BMSCs融合度达到80%~90%时,消化并调整细胞浓度为2×107·L-1接种至96孔板,每孔培养体系为100 μL。24 h后,吸弃孔内完全培养基,每孔加入含1 g·L-1骨肽原液的完全培养基100 μL,继续培养,并于加药后72 h、96 h、144 h使用 CCK-8法进行测定,实验操作参照试剂盒说明书。
2.4 骨肽原液对F-BMSCs诱导成骨ALP活性检测当培养的F-BMSCs融合度达到80%~90%时,消化并调整细胞浓度5×107·L-1接种至12孔板中,每孔培养体系为1 mL。培养24 h后,不同组别更换培养基,每孔加入1 mL相应培养基。设置阴性对照组:含PBS(与加入药物等体积)的完全培养基;诱导组:含PBS(与加入药物等体积)的诱导液;供试品组:含1.0 g·L-1骨肽原液的诱导液。每2~3 d更换新鲜的各组培养基。诱导5 d、7 d 时,去除12孔板中培养基,用1 mL PBS洗1遍,尽量将PBS除净,每孔加入100 μL Western及IP裂解液(无抑制剂),用枪吹打数下,使裂解液与细胞充分接触,收集细胞裂解液。按照ALP活性测定试剂盒说明书进行测定。
2.5 茜素红S矿化结节染色当培养的F-BMSCs融合度达到80%~90%时,消化并调整细胞浓度5×107·L-1接种至12孔板中,每孔培养体系为1 mL。培养24 h后,不同组别更换培养基,每孔加入1 mL相应培养基。设置阴性对照组:含PBS(与加入药物等体积)的完全培养基;诱导组:含PBS(与加入药物等体积)的诱导液;供试品组:含1 g·L-1骨肽原液的诱导液。每2~3 d更换新鲜的各组培养基。每2~3 d更换新鲜的各组培养基。诱导14 d 时,经4%多聚甲醛固定30 min,茜素红S染色,显微镜观察,拍照。
2.6 Real time RT-PCR检测
2.6.1RNA抽提 当培养的F-BMSCs融合度达到80%~90%时,消化并调整细胞浓度5×107·L-1接种至6孔板中,每孔培养体系为2 mL。培养24 h后,不同组别更换培养基,每孔加入2 mL相应培养基。设置阴性对照组:含PBS(与加入药物等体积)的完全培养基;诱导组:含PBS(与加入药物等体积)的诱导液;供试品组:含1 g·L-1骨肽原液的诱导液。每2~3 d 更换新鲜的各组培养基。分别在第诱导6、8 d 时,用TRIzol裂解并提取各组细胞RNA。
2.6.2cDNA链的合成 每组取1 μg RNA进行反转录制备得到cDNA用于后续实验。
2.6.3Real time RT-PCR 利用引物设计软件Primer Premier 5.0 进行引物设计,内参为GAPDH。引物信息见下Tab 1。
以SYBR Green定量的Real time-PCR方法检测基因表达,以GAPDH作为内参,采用法计算mRNA的相对表达水平(根据2-△Ct法计算样品中检测基因相对于内参基因GAPDH的相对表达量,具体算法如下:相对表达量=2-(Ct检测基因-Ct GAPDH))。

Tab 1 Primer sequences used for real-time PCR
2.7 Western blot检测当培养的F-BMSCs融合度达到80%~90%时,消化细胞并调整细胞浓度5×107·L-1接种至6孔板中,每孔培养体系为2 mL。培养24 h后,不同组别更换培养基,每孔加入2 mL相应培养基。设置阴性对照组:含PBS(与加入药物等体积)的完全培养基;诱导组:含PBS(与加入药物等体积)的诱导液;供试品组:含1 g·L-1骨肽原液的诱导液。每2d ~3 d 更换新鲜的各组培养基。
在诱导第6 d、8 d、10 d时,使用细胞蛋白裂解液裂解细胞,并将收取的蛋白样品置于-20 ℃保存备用。各组蛋白样品采用SDS-PAGE电泳后,湿转,并将湿转后的硝酸纤维素膜封闭,然后膜与一抗(1 ∶ 1 000)4 ℃孵育过夜后,与二抗(1 ∶ 10 000)室温孵育1 h,最后用化学发光液显色成像。
3 实验结果
3.1 促UMR106细胞增殖作用骨肽原液药物浓度在0.06~2.0 g·L-1范围内对UMR106细胞的影响具体结果详见Fig 1。厂家A的骨肽原液对UMR106细胞无促进增殖作用;厂家B、C、L的骨肽原液对UMR106细胞有促进增殖作用,且在0.06~1.0 g·L-1范围内对UMR106细胞增殖作用呈时间-剂量依赖性。
3.2 F-BMSCs免疫表型检测各表面标志蛋白表达阳性的细胞占细胞总体的比例:CD73为99.6%,CD90为99.0%,CD105为98.5%,均大于95%;各表面标志蛋白表达阴性的细胞占细胞总体的比例:CD11b/CD19/CD34/CD45/HLA-DR为0%。测定结果符合目前国际干细胞协会提出的干细胞鉴别标准。结果详见Fig 2。
3.3 CCK-8法检测骨肽原液对F-BMSCs的影响CCK-8细胞增殖-毒性检测试剂盒测定结果表明,厂家A、B、C、L四个生产厂家的骨肽原液,在1.0 g·L-1浓度作用下,对F-BMSCs的增殖未见明显改变。具体测定结果详见Fig 3。
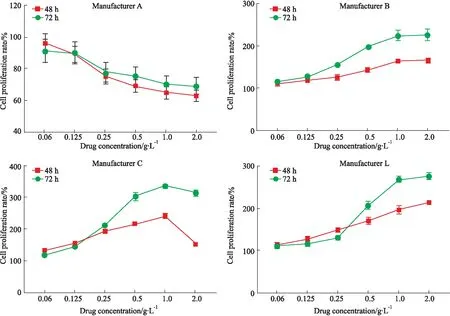
Fig 1 Effect of proliferation on UMR106 cells of ossotide stock solution from four n=3)

Fig 2 Expression rate of various surface marker proteins of F-BMSCs
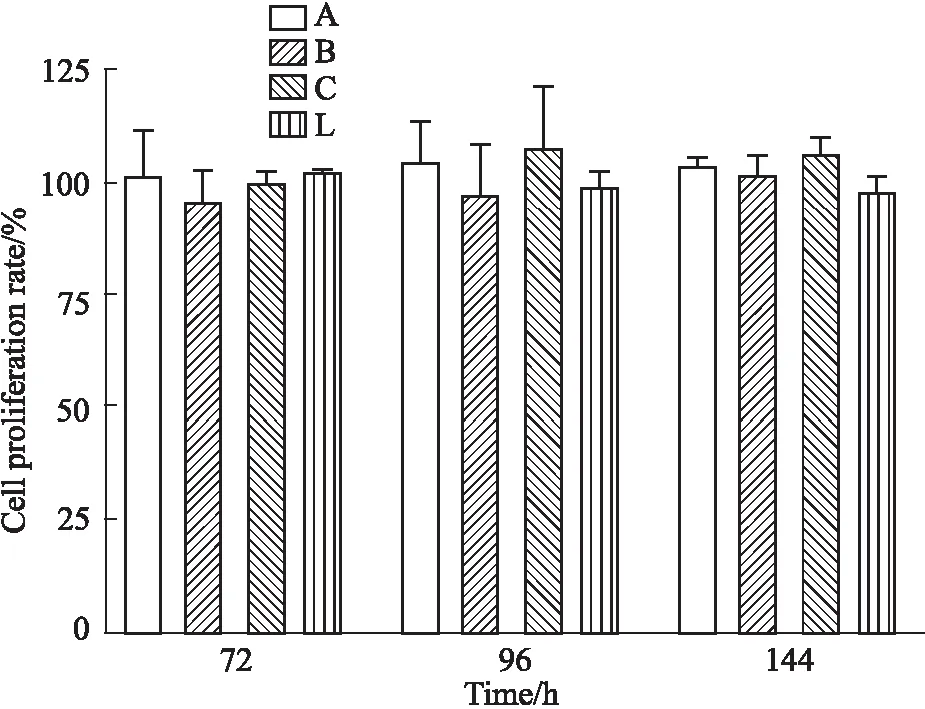
Fig 3 Effect of proliferation on F-BMSCs of ossotide stock solution from four manufacturers n=6)
A,B,C,L :represent for manufacture A,B,C,L
3.4 骨肽原液对F-BMSCs诱导成骨ALP活性检测F-BMSCs诱导7 d 时,与阴性对照组相比,诱导组F-BMSCs的ALP活性为(1.40±0.046)mmol·L-1,明显增加(P<0.05),表明诱导成功。与诱导组相比,供试品组中厂家C骨肽原液处理的F-BMSCs ALP活性明显增高分别为(2.46±0.148)mmol·L-1,差异有显著性(P<0.05);厂家B、L骨肽原液处理的F-BMSCs ALP活性高于诱导组,但差异无显著性(P>0.05)。具体结果详见Fig 4。
3.5 茜素红S矿化结节染色F-BMSCs诱导第14 d,与阴性对照组相比,诱导组F-BMSCs茜素红染色呈阳性,表明诱导成功F-BMSCs。与诱导组相比,肉眼观察供试品组(厂家B、C、L)骨肽原液处理的F-BMSCs红色明显增强;显微镜下,厂家B、C、L骨肽原液处理的F-BMSCs茜素红染色阳性结节状覆盖面积增多。染色结果见Fig 5。

Fig 4 Effect of ossotide stock solution on ALP
**P<0.01vsblank group;#P<0.05vscontrol group. Blank for negative group, control for osteoinduction group;A,B,C,L for ossotide group(manufacturer A,B,C,L).
3.6 Real time RT-PCR测定结果F-BMSCs诱导6 d时,与阴性对照组相比,诱导组、供试品组(厂家B)F-BMSCs中成骨分化标志物基因OPN、OCN、Runx2、ALP的mRNA表达量无明显变化;诱导8 d 时,供试品组F-BMSCs 上述mRNA的表达量增加,且高于诱导组。检测结果见Fig 6。
3.7 Western blot检测结果F-BMSCs诱导第6~8 d 时,与阴性对照组相比,诱导组与供试品组(厂家B)F-BMSCs的Runx2、Osteocalcin(OCN)蛋白表达均增加,但两组无明显差别;诱导第10 d 时,供试品组F-BMSCs Runx2、OCN蛋白表达明显高于诱导组。检测结果见Fig 7。
4 讨论
BMSCs作为骨组织工程的常用细胞,具有成骨细胞群的增殖和分化行为,即高ALP活性和形成矿化骨基质的能力。BMSCs在体外向成骨细胞方向诱导分化时,大致主要经历细胞增殖期和细胞分化期:首先根据细胞所在微环境进行谱系定向;继而进入细胞增殖阶段;之后为成骨早期,细胞分泌大量ALP,促进细胞外基质成熟;最后为成骨后期,即基质矿化阶段,成熟的成骨细胞矿化活力增加,促进细胞外基质矿化,形成钙化结节[7-8]。因而,ALP及矿化结节分别是BMSCs向成骨细胞分化的早期及晚期的特异性标志。因此,ALP活性测定和茜素红染色是成骨分化最为常用的鉴定手段[9]。本研究选取4个不同生产厂家的骨肽原液进行成骨分化实验,部分厂家的骨肽原液作用于BMSCs后,供试品组F-BMSCs的ALP活性及茜素红染色均较诱导组明显增强,且两指标测定结果基本一致。表明骨肽原液可一定程度促进BMSCs的成骨作用。

Fig 5 Results of Alizarin red staining assay. Blank for negative group, control for osteoinduction group.

Fig 6 The expression results of osteogenic differentiation related marker genes detected by RT-PCR after osteogenic induction of F-BMSCs by ossotide (manufacturer B)
Blank for negative group, control for osteoinduction group.
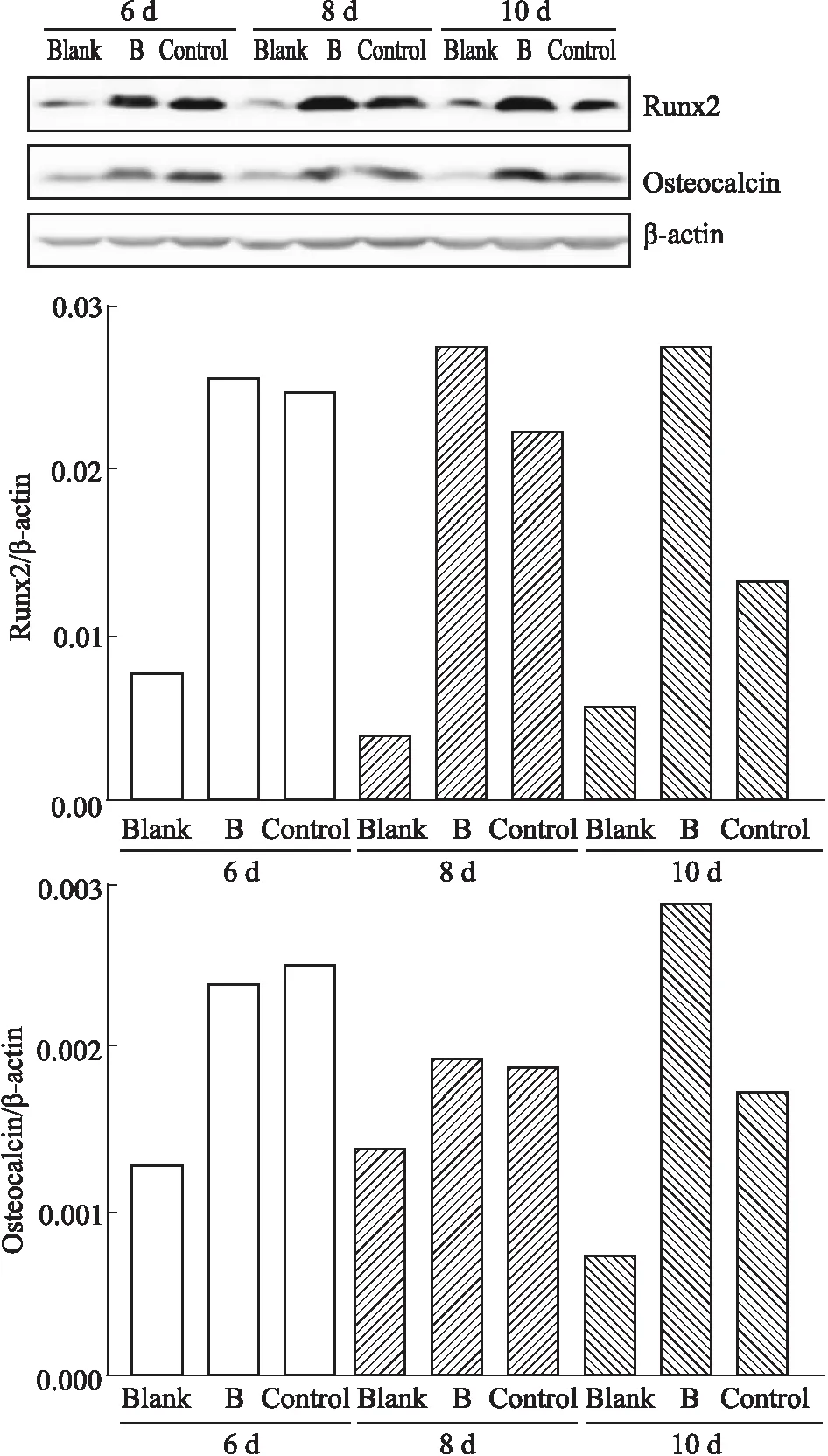
Fig 7 The expression results of osteogenic differentiation related protein detected by Western blot after osteogenic induction of F-BMSCs by ossotide (manufacturer B)
Blank for negative group, control for osteoinduction group, B for ossotide group(manufacturer B).
成骨相关基因的表达亦是BMSCs 向成骨细胞分化的特点,这是体内成骨的典型特征。ALP、Runx2、OCN、OPN等基因是成骨细胞标志基因。成骨分化过程中,ALP、Runx2、OCN、OPN等成骨相关基因表达上调,这些基因在成骨分化不同时期表达,调控骨基质的分泌和矿化。其中,Runx2 是 Runx 家族的转录因子之一,可与许多其他转录因子和共调节因子在其靶基因的转录调控中相互作用,是成骨分化和骨形成过程中关键的转录因子,亦是骨形成过程中早期并最具特征性的标志蛋白[10-12]。OCN是由成熟成骨细胞分泌的最丰富的非胶原蛋白之一,促进骨形成矿化物质沉积的正常钙化,维持骨的正常矿化速率,与羟磷灰石结合抑制其结晶的形成,并抑制软骨细胞矿化的速率,从而促进骨组织矿物质沉积的正常钙化过程,是成骨细胞分化晚期的特异性指标[13-14]。实验结果显示:与诱导组相比,BMSCs细胞经骨肽原液处理后,可使得ALP、Runx2、OCN、OPN基因的 mRNA表达量显著上调,Runx2、OCN蛋白表达量增加,表明骨肽原液具有促进诱导F-BMSCs成骨细胞分化的作用。
此外,本研究采用王灿等[6]报道的骨肽类药物体外活性测定方法,对4个生产厂家的骨肽原液进行活性测定,测定结果显示厂家A生产的骨肽原液对UMR106细胞无促进增殖作用;厂家B、C、L生产的骨肽原液对UMR106细胞有促进增殖作用,且在一定剂量范围内对UMR106细胞增殖作用呈时间-剂量依赖性。以上结果表明,骨肽原液的生物活性高低与其促进BMSCs诱导成骨作用的强弱基本一致。
综上所述,骨肽原液可通过上调ALP、Runx2、OCN、OPN等成骨相关标志基因,促进Runx2、OCN等成骨相关蛋白的表达,发挥促进骨形成的活性作用。
